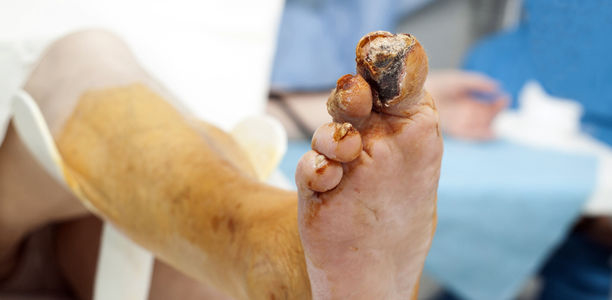
Für die allermeisten Amputationen der unteren Extremitäten sind chronische Wunden verantwortlich. pAVK, chronisch-venöse Insuffizienz und Diabetes sind wiederum dafür die Ursache. Was man tun kann, weiß Dr. Holger Diener.
Trotz besserer Möglichkeiten in Diagnostik und Therapie ist die Behandlung chronischer Wunden eine große Herausforderung. Die chronische Wunde – definiert als Integritätsverlust der Haut mit fehlender Abheilung innerhalb von acht Wochen – ist für die meisten der jährlich etwa 45 000 Amputationen an unteren Extremitäten verantwortlich. Sie entwickelt sich oft infolge von peripherer arterieller Verschlusskrankheit (pAVK), chronisch-venöser Insuffizienz und Diabetes mellitus.
Vor der Therapie Ulkusentität klären
Die Mehrzahl chronischer Wunden geht auf eine angiogentische Ursache zurück, was die Forderung nach einer differenzierten Abklärung der Ulkusentität unterstreicht, bevor das therapeutische Regime geplant wird.
Primär liegen Erkrankungen wie das Diabetische Fußsyndrom (DFS), venöse Ulcera, arteriell bedingte Ulcera, das Ulcus mixtum oder Dekubitalgeschwüre zugrunde. Häufigster Grund von nicht spontan heilenden Wunden ist die chronisch-venöse Insuffizienz (Ulcus cruris venosum) mit einer Rezidivrate von mehr als 90%.
In 4 bis 30% der Fälle ist die pAVK unmittelbar für die fehlende Heilung verantwortlich. Diabetes mellitus, arterielle Hypertonie, Fettstoffwechselstörungen und Rauchen sind Risikofaktoren der pAVK. Neben der klassischen Claudicatiosymptomatik sind trophische Hautstörungen erkennbar, in deren Folge sich bei ausgeprägten Perfusionsstörungen mit Unterbrechung des Hautintegments ein nicht abheilendes Ulcera entwickelt. Auch eine Gewebeschädigung aufgrund lang anhaltender Druckbelastung (Dekubitalgeschwür) kann Auslöser chronischer Ulcerationen sein, die von oberflächlichen Hautläsionen bis zur Knochenbeteiligung reichen.
Bei etwa 10% aller Ulcera wird von einem Ulcus multifaktorieller Genese (Ulcus mixtum) ausgegangen, wobei es sich meist um ein Ulcus cruris venosum vor dem Hintergrund von Erkrankungen wie Diabetes mellitus, arterielle Verschlusskrankheit oder rheumatoide Arthritis handelt
Infektionsgefahr durch Verlust der Hautintegrität
Patienten mit DFS sind prädestiniert dafür, dass Wunden schlecht heilen und die Infektionsgefahr erhöht ist. Einerseits führt die gestörte Durchblutung dazu, dass Phagozyten nicht oder in unzureichendem Maße an den Entzündungsort gelangen. Andererseits wird durch Glykolisierung die humorale Infektabwehr beeinträchtigt bei gleichzeitiger Einschränkung der Gewebsmakrophagen.
Eine diabetische Neuropathie verursacht aufgrund der Sensibilitätsstörung rezidivierende mechanische und thermische Traumen. Die motorische Neuropathie mit Flexionsdeformität der Zehen und abnormalem Gehmuster führt zu Zonen erhöhtem Druck. Persistierende Druck- und Scherkräfte fördern die Entwicklung subkeratotischer Hämatome, die nach Auftreten kleinerer Hautläsionen den idealen Nährboden für Bakterien bilden.
Diabetes: Systemische Hinweise können fehlen
Die autonome Neuropathie begünstigt das Entstehen von rissiger und trockener Haut. Der Verlust der Hautintegrität schafft die Voraussetzung, dass Mikroorganismen eindringen können, die Weichteilinfektionen bis zur Knochenbeteiligung auslösen. Durch zusätzliche Überwucherung der Hautläsion mit nachgebildeter, überschießender Hornhaut können sich die Erreger bis in die Tiefe ausbreiten.
Grundsätzlich sollte in der Diagnostik die venöse und arterielle Durchblutungssituation abgeklärt werden, wobei sich die Verschlussdruckmessung (ABI: ankle-brachial-index; Knöchel-Arm-Index) als Screeningmethode bewährt hat. Ein ABI von 0,9 weist in 95% aller Fälle auf eine angiographisch nachweisbare Gefäßläsion hin. Liegt der Wert unter 0,8 kann von einer signifikanten arteriellen Verschlusskrankheit ausgegangen werden.
Bei Verdacht auf mikrovaskuläre Erkrankung bieten sich farbcodierte Duplexsonographie und Angiographie an. Zudem liefert die transkutane Sauerstoffpartialdruckmessung (TCPO2-Messung) Informationen. Laborchemische Untersuchungen (Blutzuckerspiegel, Entzündungsparameter) sollten die Diagnostik ergänzen.
Rötung, Schwellung, Überwärmung, Schmerzen oder purelente Sekretion deuten auf eine Infektion hin. Systemische Infektzeichen wie Fieber, Leukozytose, Blutsenkungsgeschwindigkeit (BSG) und C-reaktives Protein (CRP) sind bei Patienten mit Diabetes mitunter weniger ausgeprägt als bei Nicht-Diabetikern. Sie können trotz vorhandener Infektion fehlen. Fieber und der Anstieg von Muskelenzymen sind Hinweise dafür, dass schon benachbarte Gewebe von der Infektion betroffen sind.
Primäres Ziel: Optimales Wundmilieu schaffen
Die Behandlung chronischer Wunden umfasst die systemische und lokale Therapie, idealerweise im integrierten Versorgungskonzept organisiert und mit Einbezug aller spezialisierten Professionen. Zugrunde liegende Erkrankungen und Risikofaktoren (Diabetes, Blutdruck, Fettstoffwechsel, Gerinnung) müssen zielwertgerecht eingestellt sein, der Immunstatus des Patienten verbessert und Mangelernährung vermieden werden. Eine vorhandene vaskuläre Minderdurchblutung sollte insofern erforderlich durch interventionelle Eingriffe (Dilatation) oder gefäßchirurgische Rekonstruktion (Bypass) beseitigt werden.
Primäres Ziel der Wundbehandlung ist es, ein optimales (physiologisch feuchtes) Wundmilieu zu schaffen, in dem die Zellproliferation gefördert wird und körpereigene Wachstumshormone und Zytokine freigesetzt werden. Die Wahl der Wundauflage richtet sich nach der Wundsituation bzw. dem Wundstadium (Nekrose, Fibrinbeläge, infizierte Wunden, Wundgeruch), der Exsudataufnahme und Exsudatrückhaltefähigkeit, der Vermeidung von Mazeration und der Praktikabilität für Patienten.
Bei stark sezernierenden Wunden werden Alginate oder Hydrofaser und bei mäßig sezernierenden Wunden Polyurethanschaum oder Hydrokolloidverbände eingesetzt. Für trockene Wunden sind Hydrogele und Hydrogelkompressen das Mittel der Wahl. Der Zusatz Carbon ist geruchsbindend. Silberionen wirken antiseptisch, allerdings fehlen vergleichende Studien.
Gewebe abtragen
Das Debridement zur Entfernung von nicht-vitalem Gewebe aus der Wunde entzieht den Nährboden für Infektionen. Damit kann auch der Wundgrund und die Wundtiefe beurteilt werden, was dokumentiert werden muss. Großflächige Wunddebridements sind unter Anästhesie durchzuführen, auch mit begleitender Schmerztherapie. Das chirurgische Debridement mit Skalpell, Schere und/ oder scharfem Löffel kann Zeitersparnis für den Heilungsprozess der Wunde bedeuten.
Beim mechanischen Debridement erfolgt die Wundreinigung z.B. mit niederfrequenten Ultraschall oder mit Wasserstrahldissektor, was eine selektive Nekrosektomie bewirkt, Mikroorganismen reduziert und die enzymatische endogene Fibrinolyse verstärkt. Durch autolytische Wundreinigung wird eine tiefe Quellung von Nekrosen und avitalen Belägen in der Wunde erreicht. Beim biochirurgischen Debridement werden speziell gezüchtete Fliegenmaden zur Reinigung unsauberer und infizierter Wunden eingesetzt.
Bei multiresistenten Keimen, insbesondere beim Methicillin resistenten Staphylococcus aureus (MRSA) scheinen Fliegenmaden sehr wirksam zu sein. Im Falle der Besiedelung von Pseudomonas spec. sollten sie nicht verwendet werden. Fliegenmaden benötigen viel Sauerstoff und ausreichend Flüssigkeit, deshalb dürfen die Wunden nicht zu feucht oder zu trocken sein.
Zudem können sterile, nicht resorbierbare Spüllösungen, die körperwarm appliziert werden sollten, zur Wundreinigung eingesetzt werden.
Bewährte und neue Ansätze der Therapie
Schon seit einiger Zeit hat sich in der lokalen Therapie das Verfahren der Vakuumversiegelung (Behandlung mit angelegtem Unterdruck von 80-125mmHg) bewährt. Dabei werden Wundsekret und Gewebetrümmer über einen Schwamm mit Drainage abgesaugt, um den Wundgrund zu reinigen und Granulationsgewebe zu bilden. Durch den Unterdruck wird die Keimdichte verringert, inhibierende Gewebsfaktoren wie Matrixmetalloproteinasen (MMP) werden aufgenommen und zelluläre Immunmechanismen aufgrund der Hyperperfusion verstärkt. Dadurch konnten höhere Konzentrationen der Wachstumsfaktoren Vascular Endothelial Growth Factor (VEGF) und Platelet Derived Growth Factor (PDGF) nachgewiesen werden.
Eine noch junge und vielversprechende Methode ist die Behandlung mit extrazellulärer Matrix (ECM), die das Potential hat, Zellproliferation und Angiogenese zu begünstigen. Meist sind diese Matrizen porcinen und bovinen Ursprungs oder aus Amnion. Die dezellularisierte Matrix aus Fischhaut vom Nordatlantik-Dorsch ist relativ neu. Sie enthält neben Kollagenproteinen einen hohen Anteil von Omega-3-Fettsäuren. Verglichen mit porcinen Matrizen und solchen aus Amnion konnte bei dezellularisierter Matrix in-vitro höhere Stammzellmigration und -proliferation und in-vivo vermehrte Angiogenese gezeigt werden.
Erste klinische Erfahrungen bei Patienten mit Diabetes mellitus und pAVK in unserem Zentrum in Hamburg weisen auf eine verbesserte Wundheilung mit azelluärer dermaler Matrix aus Fischhaut hin. Ob die Therapie bei chronischen Wunden im Vergleich zur alleinigen Behandlung mit Schaumverbänden überlegen ist, wird aktuell in einer prospektiven randomisierten Studie untersucht.
- Kein DFS darf ein Leben zerstören
- Management chronischer Wunden
- Einsatz von Kaltplasma in der Wundbehandlung
- Plastische Deckung chronischer Wunden
Erschienen in: Diabetes-Forum, 2018; 30 (4) Seite 15-17