Aufgrund der demografischen Entwicklung ist über den altersbedingten Anstieg der Prävalenz des Diabetes mellitus mit einer Zunahme diabetischer Sekundärkomplikationen zu rechnen. Als Folge daraus wird die diabetische Retinopathie auch weiterhin eine der häufigsten Erblindungsursachen in Deutschland bleiben.
In Europa erhöht sich durch das steigende Durchschnittsalter der Bevölkerung besonders die Anzahl der Patienten mit Typ-2-Diabetes. Eine Prognose aus dem Jahr 2007 geht von einem Zuwachs von ca. 40 Prozent bis zum Jahr 2032 aus (Candrilli et al. 2007). Sowohl für Typ-1- als auch für Typ-2-Diabetiker ist lange bekannt, dass das Risiko, eine Retinopathie zu entwickeln, entscheidend von der Diabetesdauer abhängt.
So liegt die Prävalenz für Typ-2-Diabetiker in den ersten Jahren unter 5 Prozent. Nach 25 Jahren entwickeln nahezu alle Patienten mit Diabetes mellitus eine Retinopathie (Klein et al. 2009). Möglicherweise wird die längere Überlebenszeit der Patienten, die nach modernen Gesichtspunkten therapiert werden, langfristig eine weitere Zunahme der Sekundärkomplikationen wie diabetische Retinopathie (DRP) oder diabetische Polyneuropathie (DNP) bewirken (Klein et al. 2009).
Vor diesem Hintergrund wächst die Bedeutung einer hochspezifischen und sensitiven Frühdiagnostik. Neue bildgebende Verfahren in der Ophthalmologie ermöglichen nicht nur die differenzierte Darstellung mikrovaskulärer Veränderungen der Netzhaut, sondern auch eine sehr frühe Beurteilung neurodegenerativer Diabeteskomplikationen am Auge.
Weitwinkeloptiken ermöglichen Blick in Netzhautperipherie
Seit langem gilt die ophthalmoskopische Untersuchung des Augenhintergrundes in Mydriasis als wichtigstes Standardverfahren zur Beurteilung der diabetischen Retinopathie. Andere Augenbeteiligungen wie die diabetische Katarakt oder die diabetische Optikopathie sind ebenfalls klinisch leicht zu erkennen.
Als weiterführende Diagnostik insbesondere zur Bewertung einer diabetischen Makulopathie ist seit Jahrzehnten die Fluoreszenzangiographie etabliert. Die hierbei resultierenden Aufnahmen zeigen die Verteilung des Farbstoffs im retinalen Gefäßsystem und auch mögliche Leckagen wie beispielsweise bei der proliferativen diabetischen Retinopathie (PDR) oder beim diabetischen Makulaödem (DMÖ).
Die gängigen Kameramodelle liefern Aufnahmen in einem Ausschnitt von 30° bis 40°, mit denen im Wesentlichen nur der hintere Augen-Pol untersucht werden kann. Seit kurzem stehen Weitwinkeloptiken zur Verfügung, die eine Gesamtübersicht bis in die Netzhautperipherie ermöglichen. Hierdurch erhält man wichtige Informationen über die Durchblutungssituation der peripheren Netzhaut. So können z.B. auch klinisch nicht sichtbare periphere Proliferationen entdeckt werden. Durch die heute gebräuchlichen digitalen Kamera- und Bildarchivierungssysteme sind die Aufnahmen sofort verfügbar und über die Praxis/Klinik-Software abrufbar.
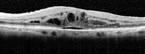
Die klinische Einführung der optischen Kohärenztomographie (OCT) hat die diagnostischen Möglichkeiten erheblich erweitert. Seit etwa 10 Jahren steht damit ein Verfahren zur Verfügung, welches hochauflösende Schnittbilder von okulären Strukturen liefert. Besonders in der Netzhaut-Diagnostik und bei der Beurteilung von Glaukomschäden hat sich das Verfahren sehr bewährt. Das Spektral-Domain-OCT (SD-OCT) mit einer axialen Auflösung von unter 5 Mikrometer liefert Bilder, die vom Detailreichtum an histologische Schnitte erinnern (Abb. 1).
Die Untersuchung ist patienten- und anwenderfreundlich und inzwischen fester Bestandteil der augenärztlichen Diagnostik. Besonders bei der Darstellung der zentralen Netzhaut im Rahmen der AMD-Diagnostik und bei verschiedenen Formen des Makulaödems ist die Methode heute unverzichtbar.
Bei Diabetes Ausdünnung von retinaler Nervenfaserschicht und Photorezeptoren-Schicht feststellbar
Mit der OCT ist es möglich, die Dicke einzelner Netzhautschichten mittels spezieller Segmentierungs-Algorithmen sehr genau zu bestimmen. Bei Diabetikern konnte mit dieser Technik eine Ausdünnung der retinalen Nervenfaserschicht sowie der Photorezeptoren-Schicht gegenüber Nichtdiabetikern festgestellt werden (Bialosteriski et al. 2007, Oshibari et al. 2009, Verma et al. 2012). Diese Veränderungen zeigen sich sowohl bei Typ-1- als auch bei Typ-2-Diabetikern bereits vor dem Auftreten einer diabetischen Retinopathie. Mehrere klinische Studien beschäftigen sich gegenwärtig mit dieser Thematik.
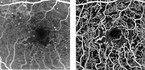
Moderne OCT-Geräte sind heute mit Zusatzmodulen ausrüstbar, die Schichtaufnahmen einzelner Netzhautebenen ermöglichen. Hierbei ist auch die Dynamik des retinalen Blutflusses darstellbar, was als OCT-Angiographie derzeit klinisch erprobt wird (Abb. 2). Die Aufnahmen sind hochauflösend und bieten detaillierte Einblicke in die Mikroarchitektur der Netzhaut und des Gefäßsystems. Dass hierbei kein Farbstoff appliziert werden muss, ist zwar für den Patienten sehr angenehm, andererseits kann aber mit dieser Methode weder eine Leckage noch eine Farbstoffansammlung (Pooling) dargestellt werden. Eine abschließende Bewertung der klinischen Bedeutung dieser Technik steht noch aus.
Korneale konfokale Mikroskopie zur Früherkennung
Die korneale konfokale Mikroskopie (CCM) ist ein weiteres innovatives Untersuchungsverfahren, welches für Diabetiker in ersten klinischen Studien getestet wurde. Mit dieser Methode kann u.a. das subbasale Nervenfasergeflecht der Hornhaut dargestellt werden (Abb. 3), was für die Diagnostik der diabetischen peripheren Neuropathie und anderer Polyneuropathie-Formen von großem Interesse ist. Das Verfahren ist nicht-invasiv und ermöglicht durch digitale Überlagerung von Einzelbildern auch die Bewertung größerer Gewebeareale.
Mittels einer geeigneten Software können so Dichte, Länge und die Art der Verzweigung innerhalb des Nervenplexus analysiert werden. Erste Studien deuten darauf hin, dass mit der kornealen konfokalen Mikroskopie eine diabetische Polyneuropathie vor dem Auftreten von elektrophysiologischen oder klinischen Veränderungen erfasst werden kann (Ziegler et al. 2014).
Verfahren wie OCT und CCM haben großes Potenzial
Die demografische Entwicklung der Bevölkerung in Europa lässt eine Zunahme der diabetischen Sekundärkomplikationen erwarten. Daher gewinnt die möglichst frühzeitige Erfassung mikrovaskulärer und neurodegenerativer Schäden zunehmende Bedeutung. Möglicherweise können neuartige diagnostische Verfahren am Auge wie die optische Kohärenztomografie (OCT) oder die korneale konfokale Mikroskopie (CCM) einen Beitrag dazu leisten.
In einer Übersicht der aktuellen Literatur fanden De Clerck und Mitarbeiter weitgehende Übereinstimmung darin, dass neurodegenerative Schäden am Auge deutlich vor der klinischen Manifestation einer diabetischen Retinopathie auftreten. Auch zeigte sich, dass eine in der OCT sichtbare Ausdünnung der retinalen Nervenfaserschicht als frühes Zeichen einer beginnenden DRP zu werten ist. Mit der konfokalen Mikroskopie der Hornhaut wurde gezeigt, dass ein verändertes korneales Nervengeflecht bereits bei vielen Typ-2-Diabetikern vorliegt, die noch keine klinischen Zeichen einer diabetischen Polyneuropathie aufweisen.
Einmal proliferative Retinopathie – immer proliferative Retinopathie muss nicht sein
Bei dauerhaft guter Glukoseeinstellung mit Werten nahe dem Zielbereich und bei Reduktion von Risikofaktoren ist mittlerweile im langjährigen Verlauf nicht selten eine Rückbildung selbst fortgeschrittener mikrovaskulärer Sekundärkomplikationen am Auge zu sehen. Die klinisch gebräuchliche Formel "Einmal proliferative diabetische Retinopathie – immer proliferative Retinopathie" gilt heute nur noch mit Einschränkung. Es erscheint vielmehr sinnvoll, in diesen Fällen von einem "postproliferativen" Stadium zu sprechen.
Im Gegensatz dazu konnte eine Rückbildung neurodegenerativer Schäden bisher nicht beobachtet werden. Möglicherweise wird die Anwendung der beschriebenen innovativen Untersuchungstechniken neue Erkenntnisse bringen. Für gut eingestellte Diabetiker wird diskutiert, die routinemäßigen ophthalmologischen Untersuchungsintervalle auf bis zu 24 Monate auszudehnen. Welche Intervalle für die Frühdiagnostik neurodegenerativer Sekundärkomplikationen sinnvoll sind, kann bisher nicht abgeschätzt werden.
- Retinopathie: Diagnostik und Therapie optimieren
- Neurodegenerative Veränderungen der Retina
- Sekundärkomplikationen bei Retinopathie diagnostizieren
Erschienen in: Diabetes-Forum, 2018; 30 (12) Seite 21-23