Seit der Entdeckung des Insulins vor fast 100 Jahren versuchen Wissenschaftler zu entschlüsseln, wie genau das Hormon mit seinem Rezeptor interagiert. Dies ist wichtig, um bessere therapeutische Insuline entwickeln zu können. In einer neuen Studie haben Forscher nun ein kritisches Teil des Puzzles gelöst. Sie konnten zeigen, wie Insulin an einer zweiten Bindestelle mit seinem Rezeptor interagiert.
Frühere Studien haben die zentrale Rolle von Insulin als Regulator des Blutzuckers untersucht und dessen Beteiligung an Diabetes und anderen chronischen Erkrankungen, einschließlich neurodegenerativer Erkrankungen und Krebs, nachgewiesen. Die biologische Wirkung von Insulin wird dabei durch seinen Rezeptor – den Insulinrezeptor – vermittelt, der auf der Zelloberfläche lokalisiert ist.
Vermutung über zweite Bindungsstelle gibt es schon länger
„Als in den 1920er Jahren zum ersten Mal Insulin an Patienten verabreicht wurde, war dies ein echter Durchbruch in der Diabetesbehandlung. Es ist jedoch nach wie vor eine Herausforderung, Insuline zu erzeugen, die das gesamte Spektrum der endogenen Insulinwirkung widerspiegeln“, erklärt Dr. Ünal Coskun, Forschungsgruppenleiter am Institut für Pankreatische Inselzellforschung (IPI) und Paul-Langerhans-Institut Dresden (PLID).
„Der Hauptgrund dafür ist, dass wir immer noch nicht genug darüber wissen, wie Insulin an seinen Rezeptor bindet und wie dieses Signal innerhalb der Zelle weitergegeben wird“, so Dr. Coskun.
Bereits vor 40 Jahren wurde erstmals vermutet, dass Insulin an zwei verschiedenen Stellen auf dem Rezeptor bindet. Obwohl mittlerweile viel über die Wechselwirkungen bekannt ist, die an der ersten dieser Bindestellen auftreten, war nur sehr wenig darüber bekannt, was an der zweiten Stelle passiert. Doch erst das genaue Verständnis, wie Insulin mit seinem Rezeptor an beiden Bindestellen interagiert, erlaubt es den Forschern nun, verbesserte Wirkstoffe für insulinbedingte Erkrankungen zu entwickeln.
Leistungsstarke Technologie deckt molekularen Mechanismus auf
In der neuen Studie zeigt nun ein internationales Forscherteam, wie Insulin an die zweite Stelle bindet. Mit einer leistungsstarken Technologie, der so genannten Kryoelektronenmikroskopie, erhielten die Forscher ein detailliertes 3D-Bild der Ektodomäne (der Abschnitt eines Membranproteins, der in den Zellzwischenraum ragt) des Insulinrezeptors, welcher Insulin gebunden hat.
Die Wissenschaftler des Paul-Langerhans-Instituts Dresden (PLID; ein Satellit des Helmholtz-Zentrums München und Partner des Deutschen Zentrums für Diabetesforschung) und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden haben die Ergebnisse der Zusammenarbeit mit Kollegen des Max-Planck-Instituts für Biochemie (MPIB) in München, der McGill University in Kanada und der Universität Helsinki in Finnland im „Journal of Cell Biology“ veröffentlicht.
„Der Schlüssel lag darin, den äußeren Teil des Insulinrezeptors, die Ektodomäne, zu untersuchen, nachdem er mit hohen Insulinkonzentrationen gesättigt wurde“, erklärt Dr. Theresia Gutmann vom PLID und Mitautorin der Studie. Und Co-Autor Dr. Ingmar Schäfer vom MPIB ergänzt: „Wir haben mehr als 8.000 elektronenmikroskopische Bilder aufgenommen und mehr als 300.000 einzelne Rezeptorpartikel analysiert, aus denen wir 2D-Bilder des T-förmigen Komplexes zur Rekonstruktion eines 3D-Bildes erzeugen konnten.“
Erkenntnisse lassen auf neue Ansätze für therapeutische Insuline hoffen
Mit diesem Verfahren gelang es den Forschern erstmals direkt die Bindung von Insulin an der zweiten Stelle zu beobachten und zu zeigen, wie der Insulinrezeptor seine Konformation zu einer T-förmigen Struktur verändert. Der Rezeptor besteht aus zwei identischen Teilen, die jeweils zwei Insulinbindungsstellen enthalten, so dass bis zu vier Insulinmoleküle durch einen einzigen Rezeptor gebunden werden können (s. folgende Abbildung).
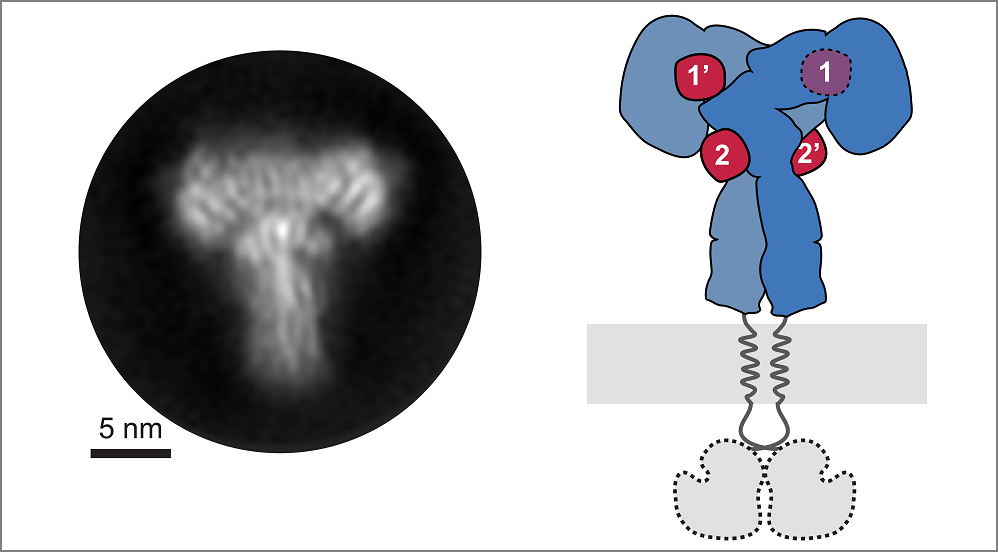 © Gutmann, Schäfer, Poojari et al. 2019 | 2D-Ansicht der mit Insulin gesättigten Insulinrezeptor-Ektodomäne (l.) und das entsprechende Schema des Rezeptors (r.). Die Ektodomäne des Insulinrezeptors ist blau und die 4 Insuline sind rot.
© Gutmann, Schäfer, Poojari et al. 2019 | 2D-Ansicht der mit Insulin gesättigten Insulinrezeptor-Ektodomäne (l.) und das entsprechende Schema des Rezeptors (r.). Die Ektodomäne des Insulinrezeptors ist blau und die 4 Insuline sind rot.
Parallel dazu nutzten die Wissenschaftler computergestützte Modellierungs- und Simulationsmethoden, um diese Wechselwirkungen auf atomarer Ebene zu verstehen. „Solche Computertechniken werden immer wichtiger, um komplizierte dynamische Prozesse in lebenden Zellen zu analysieren. Sie bieten zudem den zusätzlichen Vorteil, dass Wirkstoffscreens am Computer durchgeführt werden können“, sagt Prof. Ilpo Vattulainen von der der Universität Helsinki.
Frühere Studien, die die Struktur des Insulinrezeptors analysierten, waren schwer mit biochemischen und genetischen Daten in Einklang zu bringen, die zeigen, wie Insulin mit seinem Rezeptor interagiert. Die Wissenschaftler hoffen nun, dass diese neuen Details zu den Interaktionen zwischen Insulin und seinem Rezeptor die aktuellen Modelle der Insulinbindung erweitern und den Weg für neue Ansätze des strukturbasierten Wirkstoffdesigns ebnen werden.
Quelle: Deutsches Zentrum für Diabetesforschung (DZD) | Redaktion

