Wissenschaftler des Berliner Instituts für Gesundheit in der Charité (BIH) haben gemeinsam mit Kollegen der Charité - Universitätsmedizin Berlin und der Universitätskliniken Bonn und Aachen einen Typ von Immunzellen gefunden, der bei schwer kranken COVID-19-Patienten besonders aktiv ist. Die CD16-positiven T-Zellen haben eine erhöhte zytotoxische Wirkung, insbesondere auf die innere Zellschicht der Blutgefäße. Ihr Vorhandensein wird zusammen mit Faktoren des Komplementsystems mit einem tödlichen Ausgang der Krankheit in Verbindung gebracht. Die Wissenschaftler haben ihre Ergebnisse jetzt in der Fachzeitschrift Cell veröffentlicht.
Es ist nun so gut wie sicher, dass ein gestörtes Immunsystem eine Schlüsselrolle bei der schweren COVID-19-Krankheit spielt: Überaktive Immunzellen greifen körpereigenes Gewebe an und zerstören es, auch wenn die eigentliche Virusinfektion bereits eingedämmt oder sogar überwunden ist.
Professor Birgit Sawitzki, Leiterin der Abteilung Translationale Immunologie am BIH, interessiert sich besonders für die Rolle der T-Zellen bei der SARS-CoV-2-Infektion. "T-Zellen sind die Dirigenten des ganzen Orchesters von Immunzellen und Signalmolekülen", erklärt sie. "T-Helferzellen ermöglichen eine gezielte Abwehr mit maßgeschneiderten Antikörpern, T-Killerzellen zerstören gezielt infizierte oder bösartige Zellen im Körper, und regulatorische T-Zellen sorgen dafür, dass alles im Takt bleibt. Leider sind bestimmte T-Zellen für einen besonders schweren Verlauf von COVID-19 verantwortlich."
Sicherheitsmechanismus wird außer Kraft gesetzt
"Wir wussten, dass eine SARS-CoV-2-Infektion dazu führt, dass sich T-Zellen vermehren, die das Spike-Protein spezifisch erkennen und darauf ansprechen - auch bei Patienten, die einen schweren Krankheitsverlauf entwickeln. Der schwere Krankheitsverlauf ist also offenbar nicht auf eine zu schwache Immunantwort zurückzuführen", erklärt Philipp Georg, Mitautor der aktuellen Arbeit und Doktorand bei Prof. Leif Erik Sander vom Institut für Infektionskrankheiten und Beatmungsmedizin der Charité.
Sander war maßgeblich an der Forschung beteiligt und leitete unter anderem den klinischen Teil der Studie. Um herauszufinden, welche Rolle T-Zellen bei COVID-19 spielen, untersuchten die Wissenschaftler mit Hilfe von Einzelzellanalysen das Blut von Patienten mit leichter oder schwerer COVID-19-Erkrankung und verglichen es mit dem Blut von Gesunden und von Patienten mit anderen Virusinfektionen. Dabei entdeckten sie bei Personen mit schwerer COVID-19-Erkrankung T-Zellen, die das CD16-Molekül auf ihrer Oberfläche tragen.
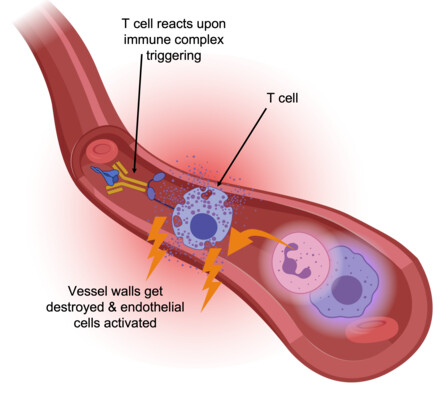
Die fatale Rolle der T-Zellen bei COVID-19
"Das war eine Überraschung für die Immunologen", berichtet Sawitzki, "denn CD16 wird eigentlich auf Zellen des angeborenen Immunsystems wie natürlichen Killerzellen oder Monozyten erwartet, aber nicht auf T-Zellen, die zum erworbenen oder spezifischen Immunsystem gehören."
CD16 hilft Zellen des angeborenen Immunsystems, virusinfizierte Zellen im Körper zu erkennen und abzutöten. Das Molekül erkennt Antikörper, die an virusinfizierte Zellen gebunden sind, und stimuliert dann Immunzellen zur Freisetzung zytolytischer Enzyme, die die virusinfizierten Zellen zerstören. Die T-Zellen brauchen diese Hilfe jedoch nicht.
"T-Zellen erkennen virusinfizierte Zellen über ihren T-Zell-Rezeptor, der spezifisch an präsentierte Virusbestandteile bindet und dadurch die T-Zelle anregt, die Zielzelle zu töten. Eine zusätzliche Aktivierung durch CD16, unabhängig vom T-Zell-Rezeptor, kann die zerstörerische Funktion der T-Zellen erheblich steigern", erklärt Sawitzki.
"Das ist gefährlich, weil T-Zellen eigentlich einen eingebauten Sicherheitsmechanismus haben: Sie nutzen ihre T-Zell-Rezeptoren, um fremde Eiweißstoffe aufzuspüren, so dass sich ihre Aktivität nur gegen infizierte oder veränderte Körperzellen richtet. Die Aktivierung über CD16 setzt diesen Sicherheitsmechanismus außer Kraft, so dass auch nicht infizierte Gefäßzellen angegriffen werden können."
Auch das Komplementsystem ist beteiligt
In Laborexperimenten beobachteten die Forscher, dass die CD16-positiven T-Zellen bei Kontakt mit Antikörpern zytotoxische Moleküle freisetzten und Lungengefäßzellen schädigten. In Zusammenarbeit mit Aachener Forschern entdeckten sie CD16-positive T-Zellen auch in der Lunge von verstorbenen COVID-19-Patienten. "Dies bestätigte unsere Vermutung, dass diese Zellen eine fatale Rolle im Verlauf der COVID-19-Erkrankung spielen", erklärt Rosario Astaburuaga Garcia, einer der Hauptautoren und Doktorand bei Professor Nils Blüthgen vom Institut für Pathologie der Charité und vom Integrativen Forschungsinstitut für Lebenswissenschaften der Humboldt-Universität zu Berlin. "Wir waren überrascht von der Tatsache, dass aktivierte CD16-positive T-Zellen bei Menschen mit anderen schweren Infektionen wie HIV oder Hepatitis nicht vorkommen.
Bei der Suche nach dem Ursprung der CD16-positiven T-Zellen stießen die Wissenschaftler auf das so genannte Komplementsystem: Dieses umfasst über 30 Proteine, die im Blutplasma gelöst sind und der Abwehr von Mikroorganismen dienen. Sie werden im Verlauf der Immunantwort durch verschiedene Mechanismen, etwa durch gebundene Antikörper, aktiviert und führen zur Eliminierung infizierter Zellen.
"Wir haben festgestellt, dass bestimmte Komponenten dieses Systems bei Patienten mit einem schweren Verlauf von COVID-19 reichlich produziert werden und zur Entstehung von CD16-positiven T-Zellen beitragen. Hier scheinen wir eine wichtige neue Verbindung entdeckt zu haben", vermutet Sawitzki. "Wenn sich dieser Zusammenhang bestätigt, könnte die Hemmung des Komplementsystems möglicherweise dazu beitragen, schwere Verläufe auf ein Minimum zu reduzieren."
Genau in diese Richtung wollen die Wissenschaftler nun weiterforschen. Die Forschung wurde unter anderem durch das AP4-Programm "COVIM" des Deutschen Netzwerks für Hochschulmedizin (NUM) unterstützt.
Quelle: Berliner Institut für Gesundheit in der Charité (BIH) | Redaktion