Ein internationales Forschungsteam unter Beteiligung der Philipps-Universität Marburg hat in einer Studie die Struktur des Glucagon-Rezeptors analysiert und dabei Erkenntnisse gewonnen, die bei der therapeutischen Regulierung des Blutzucker-Stoffwechsels hilfreich sein könnten.
Die Steuerung des Blutzuckerspiegels geht an einer entscheidenden Schaltstelle langsamer vor sich als vergleichbare hormonelle Vorgänge. Das ergibt sich aus der Struktur und Funktion des Rezeptors, der auf die Ausschüttung des Hormons Glucagon reagiert: Er übersetzt diese in eine zelluläre Antwort, die zu einem Anstieg des Blutzuckerspiegels führt – aber eben mit Verzögerung.
Analyse der Struktur des Glucagon-Rezeptors
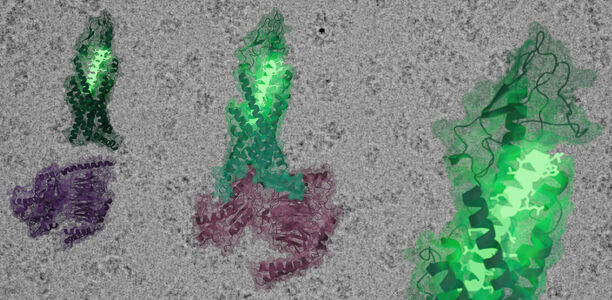
Schüttet die Bauchspeicheldrüse das Hormon aus, so führt dies über eine komplizierte Abfolge molekularer Wechselwirkungen also dazu, dass Zucker freigesetzt wird. Zu Beginn steht dabei die Kopplung von Glucagon an seinen Rezeptor, der in der Zellmembran verankert ist. Ein internationales Forschungsteam um den Marburger Biologen Dr. Daniel Hilger hat diesen Rezeptor nun in einer Studie genauer unter die Lupe genommen
Sobald Glucagon auf der Zelloberfläche an den Rezeptor koppelt, stößt dieser im Zellinneren eine Kaskade von Reaktionen an, die schließlich eine erhöhte Zuckerabgabe ins Blut zur Folge hat. Der kettenförmige Rezeptor besitzt 7 Transmembran-Domänen, die die Zellmembran durchlaufen um den Rezeptor in dieser zu verankern. Das kettenförmige Rezeptormolekül ist in eine Vielzahl von Schlaufen gelegt, die den Rezeptor in der Zellmembran verankern.
Die Wissenschaftlerinnen und Wissenschaftler um Dr. Hilger klärten die Struktur des Rezeptors mittels Kryo-Elektronenmikroskopie auf, bei der die Moleküle stark gekühlt werden. „Wir haben ein künstliches Glucagonmolekül mit verbesserter Löslichkeit hergestellt, das wir in Komplex mit dem Rezeptor untersuchten“, erklärt Dr. Hilger, der diese Forschungsarbeiten noch in seiner Zeit an der Stanford Universität in den USA durchführte.
Neue Möglichkeiten für die Diabetes-Therapie?
Eine der Molekülschlaufen Transmembrandomänen enthält eine ausgeprägte Bruchstelle; sie kommt bei verwandten Rezeptoren für andere Botenstoffe nicht vor – ein Unterschied, der nicht ohne Folgen bleibt: Dadurch verlangsamt sich offenbar die Aktivierung der Proteine, die im Zellinneren nachgeschaltet sind.
„Das Glucagon-Hormon hat eine starke Tendenz, an den Rezeptor zu koppeln und dort zu verbleiben“, erläutert der Biologe. Das könnte dazu führen, dass der Blutzuckerspiegel immer weiter steigt. „Wir vermuten, dass durch die erschwerte Aktivierung der nachgeschalteten Signalproteine eine bessere Kontrolle des Blutzuckerspiegel-Anstiegs ermöglicht wird“.
Die Gruppe analysierte auch noch weitere Proteine derselben Rezeptorfamilie. „Die Ergebnisse legen nahe, dass die beobachteten Unterschiede sich für die gesamte Klasse verwandter Rezeptoren verallgemeinern lassen“, berichtet Dr. Hilger. Wenn man Wirkstoffe finde, die die Bruchstelle stabilisieren, so könne dies ganz neue Möglichkeiten für Therapien eröffnen, vermutet der Gruppenleiter – zum Beispiel bei Diabetes und krankhaftem Übergewicht. Diese Ergebnisse wurden im Wissenschaftsmagazin „Science“ publiziert.
Quelle: Philipps-Universität Marburg | Redaktion