Im Schwerpunktthema der Diabetes-Forum-Ausgabe 4/2019 hat das Autorenteam die Therapie mit selbstgebauten Closed-Loop-Systemen und die rechtliche Situation dieser "Do it yourself"-Systeme unter die Lupe genommen. Der Experte Dr. Andreas Thomas mit einer Nachlese.
Zweifellos ist das Thema "Looper" faszinierend und trifft das Interesse vieler Patienten und Diabetesteams. Dass Patienten angesichts der Verfügbarkeit der wichtigsten Komponenten für ein "Closed-Loop-System" oder besser gesagt ein AID-System (Automatic Insulin Delivery) zur "Selbsthilfe" greifen, solche Systeme selbst bauen und zum Einsatz bringen, weil sie "nicht länger warten wollen" (einer ihrer Slogans) ist eine hochinteressante Entwicklung ("openAID").
Die gezeigten Stoffwechselergebnisse sind hervorragend, auch wenn die Patienten dafür einen beträchtlichen Aufwand betreiben müssen. Zurückkommend auf die Darstellung in besagtem Heft wäre aber das Schwerpunktthema besser unter dem Begriff "Looper" zu bezeichnen gewesen. Es darf nämlich nicht verkannt werden, dass es in den USA seit Juni 2016 und in einigen europäischen Ländern seit Ende 2018 bereits ein kommerzielles AID-System auf dem Markt gibt, welches ca. 200.000 Patienten nutzen.
Seit 1999 wird intensiv an AID-Systemen geforscht
Darüber hinaus wird an solchen Systemen geforscht, seit Glukosesensoren für die kontinuierliche Glukosemessung verfügbar sind (seit 1999). Erste ernsthafte Forschungsergebnisse wurden mit implantierten Glukosesensoren und implantierbaren Pumpen im Jahr 2000 von Arbeitsgruppen aus Montpellier (Frankreich) und Santa Barbara (USA) (Projekt: Firma MiniMed) und mit externen Insulinpumpen/Glukosesensoren aus Arbeitsgruppen in Bern/Ulm (ADICOL-Projekt (Fa. Disetronic/ Roche) berichtet.
Diese Entwicklung intensivierte sich seitdem von Jahr zu Jahr. Es hat sich ein regelrechtes Wetteifern nach den oftmals auch als "künstliches Pankreas" bezeichneten AID-Systemen entwickelt, mit aktuell mehr als 200 Publikationen pro Jahr, Aktivitäten über die JDRF-Initiative ("Juvenil Diabetes Research Foundation", eine amerikanische Patientenorganisation) und dem Markteintritt des hybriden AID-Systems MiniMed 670G.
Es lässt sich also feststellen, dass im Rahmen des Schwerpunktthemas "Closed Loop" die "Looper" mit weltweit schätzungsweise 3.000 bis 4.000 Aktivisten (in Deutschland ca. 500 bis 1.000) nur einen Teil der Initiativen einnehmen, bei aller Hochachtung dafür. Nachfolgend soll deshalb eine kurze Übersicht über das gesamte Thema gegeben werden.
Vielfalt der Entwicklung von AID-Systemen
Grundsätzlich ist die technische Realisierung eines AID-Systems an das Vorhandensein von Insulinpumpen und kontinuierlich messenden Glukosesensoren geknüpft. Folglich ist es nicht verwunderlich, dass der Aufschwung in Richtung AID an die Marktverbreitung und zunehmende Messqualität letzterer gebunden ist.
Während die Firma Medtronic von vornherein die Entwicklung ihrer Glukosesensoren mit dem Ziel des Einsatzes in AID-Systemen vorantrieb (bei der Gründung der 2001 von Medtronic übernommenen Firma MiniMed stand die Vision eines AID Pate), hat sich Dexcom als Entwickler und Hersteller von CGM-Systemen für die Therapieunterstützung gesehen, unabhängig davon, für welche therapeutische Option diese zum Einsatz kommen (im Rahmen der ICT oder CSII). Damit kann jede Firma oder sogar jeder Patient eine Insulinpumpe mit einem Glukosesensor technisch koppeln.
Zusätzlich benötigt wird dann einen Algorithmus, welcher die Glukosewerte in die notwendige Insulindosis zur Herstellung der Glukosehomöostase umrechnet. Der Algorithmus muss also neben der technischen Systemregelung grundlegende physiologische Zusammenhänge und die Pharmakodynamik des Insulins berücksichtigen.
Grundlegende Algorithmen dazu sind bekannt, wie:- das PID-Model (p – proportional, i – integral, d – derivative),
- der MPC-Algorithmus (model predictive controller),
- das ESM (empirical subject model) und
- Fuzzy Logic.
An einem der Algorithmen sei die Funktionsweise erläutert. So regelt das PID-Modell die Glukosekonzentration ähnlich wie eine Heizung, nur umgekehrt. Ist bei einer Heizung die Raumtemperatur höher als die eingestellte Solltemperatur, so gibt sie keine Wärme ab. Liegt gerade die Solltemperatur vor, so wird dagegen eine geringe Erhaltungswärmemenge zugeführt (proportionaler Anteil).
Ist es im Raum jedoch zu kalt, so wird unterschieden, ob die Temperatur nur wenig unter dem Sollwert liegt – dann wird eine kleinere Wärmemenge zugegeben (integraler Anteil) oder ob es sehr kalt ist, so dass viel Wärme zur Erreichung der gewünschten Temperatur zugeführt werden muss (derivativer Anteil).
Bei der Regelung des Glukosespiegels ist dagegen der angestrebte Glukosewert der Sollwert und die Insulindosis als Äquivalent zur Wärmemenge die Stellgröße. Liegt die Glukosekonzentration unterhalb eines eingestellten Glukosewertes, so wird kein Insulin abgegeben. Auf der Höhe des Zielwertes erfolgt die Abgabe einer Insulinmenge, welche die Erhaltung des Sollwertes garantiert (proportional).
Liegt der Glukosespiegel dagegen zu hoch, so wird dem Patienten die Insulindosis zugeführt, die nach einer endlichen Zeit (ca. 1 bis 2 Stunden) das Erreichen des Sollwertes garantiert (integral). Bei sehr hohen Glukosewerten muss die Insulindosis entsprechend hoch sein (derivativer Anteil).
Im Gegensatz dazu kann die Fuzzy-Logic eine Art selbstlernendes System sein. Dazu müssen die Glukosedaten für verschiedene Situationen – Mahlzeitenaufnahme, Sport, Stress usw. bekannt sein, bzw. in der entsprechenden Situation im System gespeichert werden. Zukünftig kann eine solche Logik ein bekanntes Szenarium selbst erkennen und darauf reagieren.
AID-System- vs. physiologische Glukose-Regulation
Grundsätzlich sind also die Voraussetzungen sowohl seitens der Hardware als auch der Algorithmen gegeben. Die größte Limitierung besteht in der zeitlichen Verzögerung zwischen der Regulierung des AID-Systems und der physiologischen Glukoseregulation. Das Problem ist dabei das Insulin. Aus Nutzen-Risiko-Erwägungen ist die unter der CSII bewährte Insulinzufuhr über das Unterhautfettgewebe die sinnvollste Lösung.
Allerdings wirkt das Insulin damit verzögert und nicht wirklich physiologisch, weil es zunächst in die Peripherie des Organismus geht und erst später die Leber erreicht. Wegen des zu langsamen Wirkeintritts des Insulins, selbst wenn es sich um sehr schnell wirkende Analoga handelt, wie das Fiasp, ist die Zeitachse von Insulinabgabe, Insulinwirkung und Senkung der Glukosekonzentration gedehnt. Nicht adäquate Glukoseanstiege können die Folge sein. Dieser Unterschied von externer Insulinzufuhr und Physiologie muss durch den Algorithmus abgefangen werden.
Eine weitere Limitierung ist gegeben, wenn nur Insulin zugeführt wird. Bei falsch zu hoher Dosierung (zum Beispiel nach unerwarteter starker körperlicher Aktivität) ist die glukosesenkende Wirkung des Insulins nur schwer zu kompensieren. Ein Ausweg besteht deshalb in sogenannten "Bionik-Pankreas", also Systemen mit Insulin- und Glukagonsteuerung (z.B. das System "iLet" der Firma BetaBionics).
Das System wird damit aber auch komplizierter und vermutlich kostenintensiver, mal abgesehen davon, dass stabiles, flüssiges Glukagon zwar entwickelt, aber noch nicht erhältlich ist. Die folgende Übersicht zeigt die Vielfalt von Systemen, verfügbar bzw. in der Entwicklung:
Verfügbare AID-Systeme
"Do it yourself"- Systeme sind zwar verfügbar, aber sie sind nicht kommerziell. Dagegen können die Patienten in den USA und in verschiedenen europäischen Ländern das kommerzielle System MiniMed 670G erhalten. Dabei handelt es sich um ein "Hybrid-System", was bedeutet, dass zwei verschiedene Funktionsweisen die Insulinabgabe bestimmen: die anhand kontinuierlich gemessener Glukosewerte adaptierte, automatische basale Insulinabgabe und die manuelle Abgabe des Insulinbolus durch den Patienten.
Seitens der Funktionalität entspricht eine solche Lösung also noch keinem vollautomatisierten Pankreas. Solche Zwischenlösungen sind einer eher vorsichtigen Herangehensweise geschuldet, die wiederum etwas mit der Sicherheit der Systeme und den Zulassungsverfahren zu tun haben.
Die ausschließlich adaptive basale Insulingabe ist weitgehend unkritisch. Sie hat zwar bei Erwachsenen normalerweise einen Anteil am Tagesinsulinbedarf von ca. 40 bis 50 Prozent, es werden aber immer nur geringe Mengen Insulin pro Zeiteinheit abgegeben. Eine inadäquate Basalrate unter der Insulinpumpentherapie kann zwar dazu führen, dass die Glukosewerte häufig nicht im Zielbereich liegen, sie stellen aber keine so hohe Gefahr in Bezug auf Hypoglykämien dar wie die Gabe eines Bolus, bei welchem eine größere Insulindosis über einen kürzeren Zeitraum wirksam wird.
Insofern bekommt ein solches System aus regulatorischer Sicht problemloser eine Zulassung als ein vollständiges AID, was bei dem MiniMed-System der Fall. Die hohe Zahl der Anwender sorgt nun für die ausreichende Erfahrung in Bezug auf künftige Entwicklungen bis zum vollständigen AID.
Die MiniMed 670G ist modular, das heißt ohne Anbindung von CGM ist sie ausschließlich eine Insulinpumpe. Wird CGM über die Funkschnittstelle angekoppelt, so gibt es zwei Betriebsarten, einen "manuelle Modus" und einen "Auto-Modus". Im manuellen Modus erfolgt die Abgabe des Insulingrundbedarfs (Basalrate) auf Grundlage des einprogrammierten Basalratenprofils, so wie es allen Insulinpumpen der Fall ist.
Allerdings existiert eine Hypoglykämieabschaltung, die wirksam wird, wenn die Gefahr einer Hypoglykämie besteht. Das Insulinmanagement im "manuellen" Modus entspricht dem des Systems MiniMed 640G, also der Sensorunterstützten Pumpentherapie (SuP). Im "Auto-Modus" wird dagegen die basale Insulinabgabe an die aktuell durch den Glukosesensor gemessenen Glukosewerte angepasst (adaptive Basalabgabe). Das erfolgt bei jedem Messwert, also alle 5 min.
Die Anpassung orientiert sich an einen fest vorgegebenen Sollwert von 120 mg/dl (6,7 mmol/l). Wird ein Glukosewert > 120 mg/dl gemessen, so sorgt der oben beschriebene PID-Algorithmus dafür, dass Insulin abgegeben wird, um ein weiteres Ansteigen der Glukosewerte zu verhindern. Bei Glukosewerten < 120 mg/dl erfolgt keine Insulinabgabe. Das schützt den Patienten vor zu hohen Werten. In diesen "Auto-Modus" ist auch ein Sicherheitsalgorithmus eingebaut.
Treten Unstimmigkeiten auf, zum Beispiel die Unterlassung der notwendigen Kalibrierung des Glukosesensors, so schaltet die MiniMed 670G in einen Sicherheitsmode um. Reagiert der Patient darauf nicht, so geht die Insulinpumpe selbständig in den "manuellen Mode" über. Sowohl im manuellen Modus als auch im "Auto-Modus" wird der Insulinbolus zum Abdecken von Mahlzeiten und ggf. zur Korrektur erhöhter Glukosewerte vom Patienten manuell abgeben, so wie es unter der Insulinpumpentherapie üblich ist.
Es lässt sich feststellen, dass die adaptive Insulingabe die bisher ausgefeilteste Form der Pumpentherapie darstellt. Der entscheidende Unterschied lässt sich zusammenfassend so darstellen:
"Bisher (CSII, SuP) und auch im "manuellen Modus" war die basale Insulinabgabe fix (fest programmierte Basalrate), worauf der Glukosespiegel variierte. Im "Auto-Modus" ist die Insulinzufuhr durch die adaptive Basalgabe variabel, was den Glukosespiegel fix hält."
Die Ergebnisse dieser adaptiven basalen Insulinanpassung sind überzeugend. Es ist schwer vorstellbar, dass unter den derzeit meist angewendeten therapeutischen Optionen, also ICT und CSII, mit und ohne CGM, eine größere Population von Patienten mit Typ-1-Diabetes Ergebnisse erreicht mit:- einem HbA1c < 7 Prozent,
- ohne schwere Hypoglykämien,
- nur 2 Prozent Werte pro Tag < 3,9 mmol/l (70 mg/dl),
- eine "Time in Range" (Zeit im Zielbereich) von 3,9-10,0 mmol/l (70-180 mg/dl) > 70 Prozent
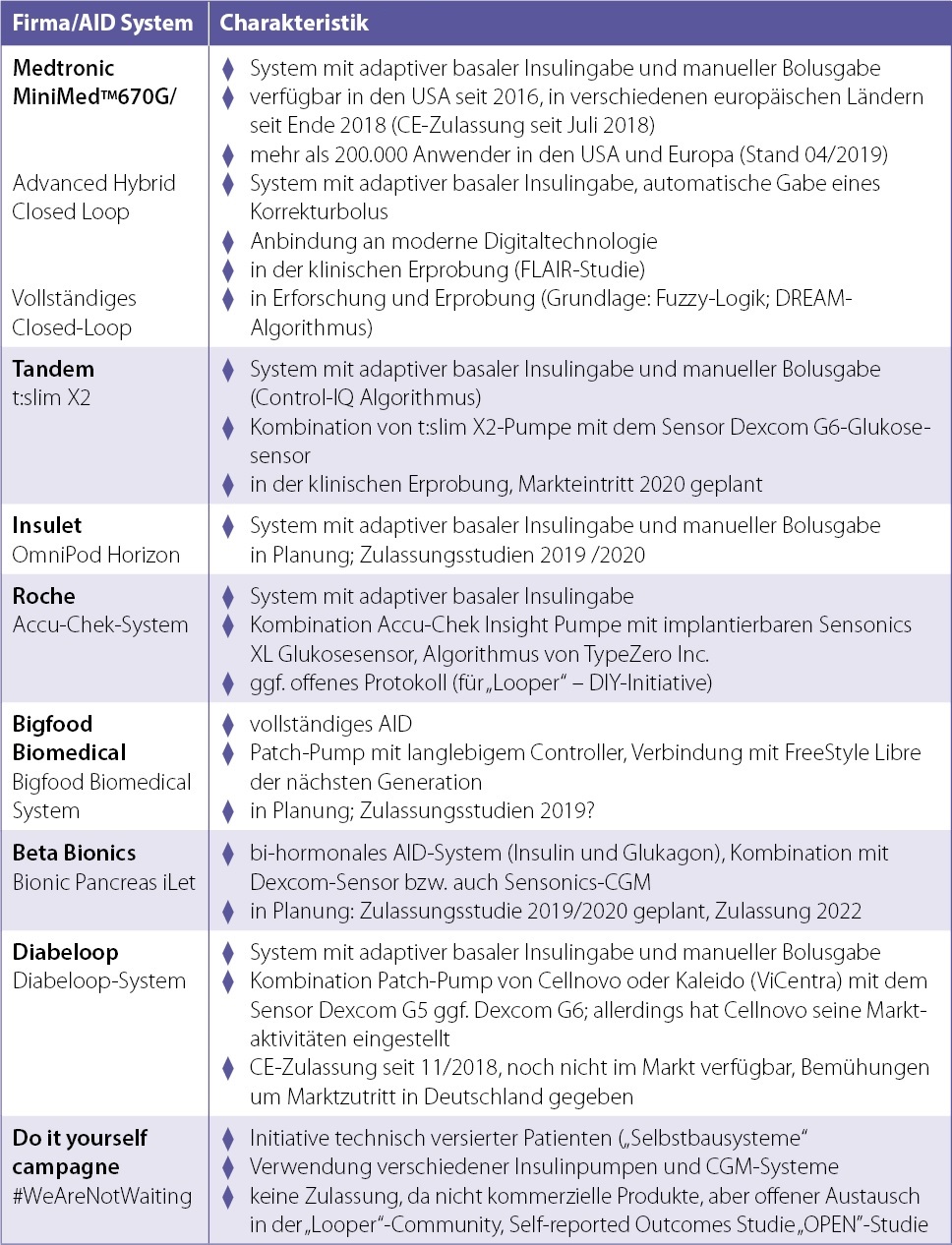
und das ohne größeren Aufwand beim Therapiemanagement. Solche Ergebnisse im Auto-Modus zeigt die Auswertung der Real-World-Daten von > 55.000 Patienten in den USA mit der MiniMed 670G. Aus den vorliegenden Mittelwerten der Glukosekonzentration ergibt sich ein durchschnittlicher HbA1c von 6,8 Prozent, ohne schwere Hypoglykämien, mit einem Anteil der Zeit unter 70 mg/dl (3,9 mmol/l) von 2 Prozent und einer Zeit im Zielbereich von 73,3 Prozent (rechte Säule in Abb.1).
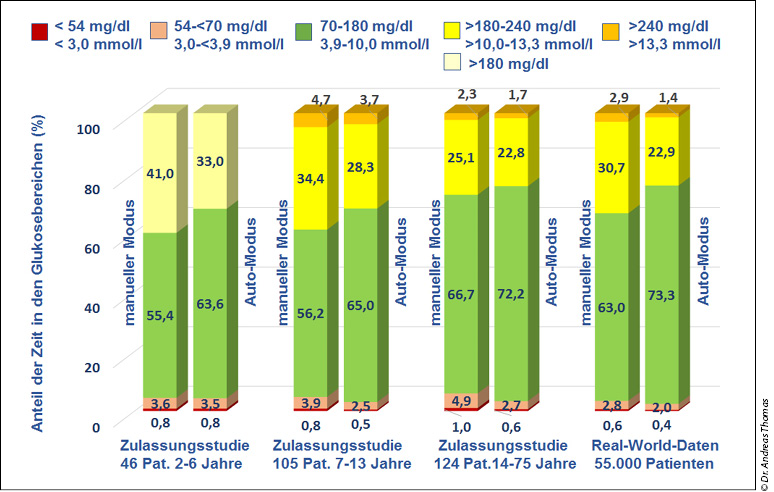 Abb. 1: Anteil der durchschnittlichen Zeiten/Tag in verschiedenen Glukosebereichen. Verglichen sind die Daten aus den prospektiven Studien (jeweils 3 Monate Nutzung des Systems unter Alltagsbedingungen) in verschiedenen Altersgruppen und die Real-World-Daten. Die Zeiten/Tag im Glukosezielbereich (grüne Felder) sind im Auto-Modus mit adaptiver basaler Insulinabgabe signifikant höher als im manuellen Modus mit fest programmierter Basalrate.
Abb. 1: Anteil der durchschnittlichen Zeiten/Tag in verschiedenen Glukosebereichen. Verglichen sind die Daten aus den prospektiven Studien (jeweils 3 Monate Nutzung des Systems unter Alltagsbedingungen) in verschiedenen Altersgruppen und die Real-World-Daten. Die Zeiten/Tag im Glukosezielbereich (grüne Felder) sind im Auto-Modus mit adaptiver basaler Insulinabgabe signifikant höher als im manuellen Modus mit fest programmierter Basalrate.
Diese Daten bestätigen die in den klinischen Studien erzielten Ergebnisse für die verschiedenen Altersgruppen, ebenfalls dargestellt in Abb.1. Damit gelingt erstmals, dass eine breite Population von Patienten mit Typ-1-Diabetes die in diversen Leitlinien angestrebten Zielwerte erreicht. Im Grunde genommen ist das eine Diabetesbehandlung ohne akute Komplikationen und mit sehr geringem Risiko für die Entwicklung von diabetische Folgeerkrankungen, zumindest ab dem Zeitpunkt der Nutzung des Systems.
Kommerzielle vs. selbstgebaute AID-Systeme
AID-Algorithmen sind mathematisch nicht überaus kompliziert. Aus der Kenntnis der aktuellen Glukosekonzentration, des Glukosegradienten (Trend), der zu dem jeweiligen Tageszeitpunkt bestehende Insulinempfindlichkeit und der dosisabhängige, pharmakodynamische Insulinwirkung lässt sich ein Glukoseverlauf und dessen Regulation berechnen. Die "Looper" beweisen das.
Hardwareseitig sind die Komponenten (Insulinpumpen und Glukosesensoren) vorhanden. Wie schreiben Saskia Wolf und Dr.Martin Lederle im Heft 4 des Diabetes Forum? "Looper sind des Wartens auf kommerzielle Lösungen überdrüssig". Abgesehen davon, dass mit der MiniMed 670G prinzipiell ein kommerzielles System verfügbar ist, hat mancher Betroffene den Eindruck, dass sich seitens der Industrie zu wenig tut. Das ist allerdings zu oberflächlich gedacht.
"Looper" adaptieren die in der "Looper-Community" verbreiteten Algorithmen auf ihre Bedürfnisse. Das setzt profunde Kenntnisse voraus, weniger technisch, denn da hilft sich die Community, sondern vor allem auch bezüglich der Glukoseregulation. Ein Patient jedoch, der ein kommerzielles System einer Firma anwendet, erwartet, dass dieses grundsätzlich funktioniert und zwar ohne, dass er dafür einen übermäßigen Aufwand zu dessen Programmierung bzw. individuellen Spezifizierung leisten muss.
Ein kommerziellen AID muss von beliebigen Patienten mit entsprechender Indikation einfach anwendbar und dabei sicher sein. Umfangreiche Programmierungen auf Grundlage umfangreichen Wissens über den Stoffwechsel verbieten sich dabei. Schlussendlich muss ein kommerzielles System die regulatorischen Vorschriften der Genehmigungsbehörden erfüllen, die auf Medizinproduktegesetzen basieren.
Ist die Leistungsfähigkeit von selbstgebauten und dem vorhandenen kommerziellen System vergleichbar? Dazu gibt es bisher wenig Erfahrungen. Ein Beispiel kann gezeigt werden von einem Patienten in Deutschland, der von dem "OpenAID" auf das kommerzielle System gewechselt ist.
 Abb.2: Beispiel zum Vergleich der Daten eines Patienten, zunächst mit „openAID“ (oberes Bild, Zeitverlauf über 5 Tage) und dann mit dem kommerziellen System über 3 Tage. Die Glukoseregulation ist unter beiden Optionen vergleichbar.
Abb.2: Beispiel zum Vergleich der Daten eines Patienten, zunächst mit „openAID“ (oberes Bild, Zeitverlauf über 5 Tage) und dann mit dem kommerziellen System über 3 Tage. Die Glukoseregulation ist unter beiden Optionen vergleichbar.
Ob ein solches Beispiel repräsentativ ist muss sich zeigen. Es entspricht aber auch den Erfahrungen aus den USA, dass mit dem kommerziellen System ähnlich gute Ergebnisse erzielt werden wie mit dem "openAID". Der Unterschied besteht darin, dass das kommerzielle System zugelassen und damit rechtlich sicher, dass der zu betreibende Aufwand deutlich geringer und dass es auch ohne tiefe Erkenntnisse über die Programmierung zu betreiben ist.
Varianten von AID-Systemen
Das verfügbare hybride, also halbautomatisierte System wird bis zum vollautomatischen AID weiterentwickelt. In der Weiterentwicklung sind aber nicht nur die Systeme zu sehen, die ausschließlich Insulin abgeben. Obwohl schon beim Hybrid-AID im Auto-Modus Hypoglykämien selten und schwere Hypoglykämien fast gar nicht auftreten, wäre ein bi-hormonales System mit Insulin/Glukagon noch sicherer.
Eine relativ zu hohe Insulindosis, zum Beispiel nach ungeplanter bzw. nicht als solche wahrgenommene körperliche Aktivität (z.B. Gartenarbeit) kann wegen des Fehlens von Glukagon besonders bei Patienten mit langer Diabeteshistorie zu Hypoglykämien führen. Die Hinzunahme von Glukagon würde das verhindern. Solche "bi-hormonellen AID" sind neben der in Tabelle 1 aufgeführten Firma Beta Bionics auch in der holländischen Firma Inreda in Entwicklung.
Auch die Zugabe des ß-Zellhormons Amylin ist denkbar, welches in den USA als Amylinanalogon erhältlich ist (Pramlintide, Handelsname Symlin). Dieses sorgt für geringere postprandiale Glukoseauslenkungen und damit für eine verringerte glykämische Variabilität. Ähnliches wurde auch schon über die Hinzunahme von GLP-1-Mimetika erfolgreich versucht.
Schließlich wird die Entwicklung von AID-Systemen nicht bei der Regulation ausschließlich über Glukosewerte stehen bleiben. Neue Sensoren auf Multisensorarrays mit Messung der Glukosekonzentration, der Herzfrequenz, der Atmungsfrequenz, der Hautfeuchtigkeit, der Hauttemperatur usw. werden Messsignale abgeben, welche die optimale Glukosestoffwechselregulation unterstützen werden.
Auch die Implementierung von fotografischen Aufnahmen von Mahlzeiten zur optimalen (automatisierten) Bolusgabe zählt dazu. Allerdings müsste eine solche Datenflut dann mit digitalisierten Systemen unterstützt werden. Im Alltag wäre das für die Diabetesteams nicht mehr handhabbar.
Ausblick
AID-Systeme zu entwickeln ist aktuell stark in den Fokus geraten. Ein erstes teilautomatisiertes System ist auf dem Markt verfügbar und wird auch in Deutschland erwartet. Es erfüllt bei einem breiten Kreis von Patienten die in den verschiedenen Leitlinien der Diabetesgesellschaften angestrebten Werte und dürfte dazu beitragen, dass bei diesen Patienten schwerwiegende Komplikationen, akut (Hypoglykämien) und langfristig (Folgeerkrankungen), selten sein sollten.
Die weiteren Schritte zu vollständigen AID-Systemen werden aktuell vollzogen, so dass diese in den kommenden Jahren möglicherweise zum Standard der Behandlung von Patienten mit Typ-1-Diabetes werden könnten.
Conflict of Interest: Dr. Andreas Thomas ist Scientific Manager der Firma Medtronic, Geschäftsbereich Diabetes.
Erschienen in: Diabetes-Forum, 2019; 18 (6) Seite 26-30