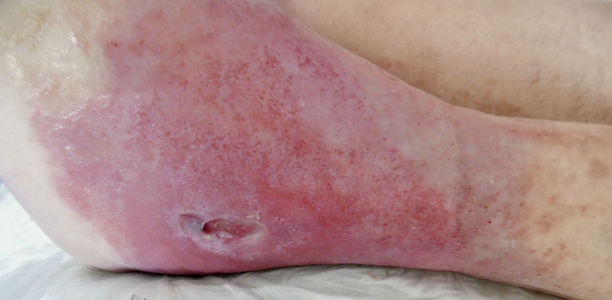
Bei Menschen mit Diabetes ist die Wundheilung wegen des geschwächten Immunsystems oft gestört. Fuß-Ulzerationen können sich deshalb schnell infizieren. Wie man vorbeugen kann, erfahren Sie hier.
Eine gravierende Komplikation bei Diabetes sind Fußulzerationen, die bei 12 bis 25 % aller Diabetiker auftreten. Fußulzerationen sind schwer zu therapieren und sind der häufigste Grund für eine Krankenhauseinweisung bei Diabetikern. Die Ätiologie der Fußulzerationen ist vielfältig und schließt mehrere Faktoren, wie mangelnde Durchblutung, periphere Neuropathie und Fußdeformationen mit ein.
Antibiotische Therapie versagt oftmals
Aufgrund der schlechten Heilung und des durch den Diabetes geschwächten Immunsystem werden die Ulzerationen schnell infiziert. Meist findet man verschiedene Bakterienspezies, die sich möglicherweise ergänzen, z.B. im Rahmen von Biofilmbildung- eine Art "Schleimmatrix", die den Bakterien Schutz bietet. Die Standardmethode zum Nachweis von Keimen ist noch immer die Kultur, doch gibt es seit kurzem auch kulturunabhängige, molekularbiologische Verfahren, die ein umfassenderes Bild liefern.
Hier zeigte sich, dass wahrscheinlich weit mehr Mikroorganismen in Fußulzerationen vorhanden sind, als ursprünglich angenommen; dies schließt auch schwer- bzw. nicht-kultivierbare Bakterien und niedrig virulente Keime, z.B. Corynebakterien, ein. Inwieweit diese Mikroorganismen interagieren und zur Progression einer Ulzeration beitragen, muss in zukünftigen Forschungsarbeiten untersucht werden.
Breitet sich die Infektion bis zum Knochen aus, kann eine Osteomyelitis (Knocheninfektion) entstehen. Dies ist zum einen durch die stark geminderte Schmerzempfindlichkeit bzw. Sensibilität bei diabetischen Patienten begünstigt. Kleinere Wunden werden dadurch zu spät wahrgenommen. Zum anderen versagt oftmals die antibiotische Therapie. Als Folge muss oft eine Fuß- oder Beinamputation durchgeführt werden, was einen schwerwiegenden Eingriff für den Patienten darstellt.
Fußulzerationen: S. aureus häufigstes isoliertes Pathogen
In zahlreichen Studien zu infizierten, diabetischen Fußulzerationen wurde S. aureus als häufigstes isoliertes Pathogen identifiziert. S. aureus ist ein fakultativ pathogener Mikroorganismus, der häufig den Nasenrachenraum und die Haut kolonisiert. Etwa ein Drittel der erwachsenen Bevölkerung ist mit S. aureus besiedelt, ohne Krankheitszeichen aufzuweisen. Es ist jedoch auch bekannt, dass kolonisierende S. aureus-Stämme die Quelle für eine Infektion darstellen können, wie bei Blutstrominfektionen und Gewebeinfektionen bereits beschrieben.
Um Infektionen durch Methicillin-resistente S. aureus (MRSA)-Stämme zu vermeiden, wird bei einem geplanten Krankenhausaufenthalt bei Patienten ein Nasen-Rachen-Screening und ggf. eine Eradikationsbehandlung durchgeführt. Es gibt jedoch bisher kein Screening auf sensible S. aureus-Stämme, die durch beta-Laktam-Antibiotika therapiert werden können, jedoch genauso virulent oder sogar virulenter sein können als MRSA-Stämme.
Staphylococcus aureus kann jedes Organ infizieren
S. aureus kann im Körper fast jedes Organ infizieren und dabei schwere invasive Infektionen verursachen. Um eine Infektion zu etablieren, verfügt S. aureus über eine Vielzahl von Virulenzfaktoren. Das sind bakterielle Faktoren, die zur Infektion beitragen. Eine Gruppe dieser Faktoren sind die Adhäsine – bakterielle Oberflächenmoleküle, die das Anheften der Bakterien an Wirtsstrukturen vermitteln.
Wirtsgewebe wird zerstört
Diese Adhärenz stellt einen ersten wichtigen Schritt im Infektionsgeschehen dar. Weiterhin sezerniert S. aureus eine Vielzahl von Toxinen, die Wirtsgewebe zerstören können und das Eindringen der Bakterien in tiefe Gewebeschichten ermöglichen. In der aktuellen Wissenschaft wird S. aureus zunehmend als intrazelluläres Pathogen wahrgenommen, da die Bakterien in verschiedene Wirtszellen eindringen und dort für längere Zeit verbleiben (persistieren) können.
Bakterien regulieren ihre Adhärenz hoch
Während einer langen intrazellulären Persistenz regulieren die Bakterien ihre Adhärenz hoch und ihre Toxinproduktion als auch den Stoffwechsel herunter und treten in eine Art "Schlafzustand" ein. Dadurch werden sie von dem Immunsystem des Wirtes nicht erkannt. Aufgrund ihrer niedrigen Stoffwechselleistung überleben sie auch Antibiotikatherapien.
Diese raffinierten Anpassungsstrategien ermöglichen es S. aureus, einerseits sehr lange in Zellen bzw. Gewebe des Wirtes zu überleben und andererseits auch durch dynamische Hochregulation des Stoffwechsels immer wieder erneut einen Schub einer Infektion auszulösen. Aufgrund des dynamischen Verhaltens ist es sehr schwierig, bei invasiven Gewebe- und Knocheninfektionen S. aureus vollständig zu eliminieren.
Oft trägt die Konstellation aus nicht vorhandener Sensibilität und nicht adäquat passendem Schuhwerk dazu bei, dass Verletzungen der Fußsohle erst sehr spät bemerkt werden.
Mit infiziertem Ulkus in die Klinik
Meist kommt der "diabetische Fußpatient" mit einem infizierten Ulkus der Fußsohle in die Klinik. Hier gibt es verschiedene Schweregrade des Infektionsgeschehens. Es gilt, bei der Aufnahmeuntersuchung die oberflächlichen, infizierten Defekte von den tiefen zu trennen. Bei Letzteren kann eine Phlegmone (Infektion des umgebenden Weichteilmantels), ein Defekt bis zu den darunter liegendem knöchernen Strukturen, oder eine Entzündungshöhle (Abszess) vorliegen. Die Therapie basiert zum einen auf der antibiotischen und zum anderen auf der chirurgischen Intervention.
Antibiotische Therapie
Bei nicht bekanntem Keimspektrum gilt es, die Infektion über ein breit wirksames Antibiotikum, ggf. in Kombination mit einer zweiten Substanzklasse, zu bekämpfen. Zum Aufnahmezeitpunkt wird ein Abstrich gewonnen, wobei nach Eingang dieses Ergebnisses die Antibiose abgeändert wird. Die Antibiose wird anfangs hochdosiert und intravenös verabreicht, um sie dann im weiteren Verlauf auf orale Medikamente umzustellen.
Die Zeitdauer der antibiotischen Therapie richtet sich nach dem Verlauf der Therapie und hängt wesentlich davon ab, ob die Infektion auf den Knochen übergegriffen hat und ob die betroffenen Knochen chirurgisch entfernt werden konnten oder nicht.
Chirurgische Therapie
Direkt zur Aufnahmeuntersuchung werden die infizierten Nekrosen entfernt. Wenn eine Abszesshöhle vorhanden ist, muss diese entlastet, gespült und mehrzeitig saniert werden. Im weiteren Verlauf ist -sofern erforderlich- die Durchblutungssituation zu verbessern, damit zum einen die systemisch angewandten Antibiotika an den Ort der Infektion kommen, zum anderen damit die ggf. erforderliche chirurgische Sanierung mit einer ausreichenden Wundheilung einhergeht.
Die weitere Diagnostik im Vorfeld einer chirurgischen Sanierung besteht aus einer Röntgenaufnahme (Ausmaß der Auflösung des Knochens i.S. einer Osteitis, Störung der Statik des Fußes) und einem MRT (Weichteilinfektion, Abgrenzung zu einem "Charcot-Fuß"). Die definitive chirurgische Sanierung muss neben der resultierenden Statik des Fußes auch die Möglichkeit der Deckung des Defektes mit einem belastbaren Weichteilmantel berücksichtigen.
Neben den ablativen Maßnahmen (Amputationen) sind im weiteren Verlauf plastische Deckungen mit Eigenhaut oder einer Lappenplastik möglich. Ziel ist der Erhalt von möglichst viel belastbarem Fuß unter sicherer Entfernung des untergegangenen und entzündeten Gewebes. Hier sind die Lebenssituation und der Anspruch an die resultierende Mobilität zu berücksichtigen. Die oft kardiopulmonal stark vorbelasteten Patienten profitieren nicht immer vom mehrzeitigen Vorgehen der Grenzzonenamputation.
Chronischer Verlauf bei vielen Patienten
Leider befindet sich ein Großteil der Patienten bereits seitens der Grunderkrankung in einem weit fortgeschrittenen Stadium. Auch nach stattgehabter Grenzzonenamputation und erfolgreicher Wundheilung werden sie wiederholt vorstellig. Inwieweit das Problem durch die weitere Anwendung von inadäquatem Schuhwerk oder durch in situ verbliebenen Bakterien aufrechterhalten wird, ist oft nicht hinreichend zu klären.
In den meisten Fällen findet sich jedoch der ätiologische Keim des Erstbefundes wieder, so dass bei der erneuten Aufnahmeuntersuchung mit dem Antibiotikum der letzten Resistenzbestimmung begonnen wird. Oft ist die zum Operationszeitpunkt durchgeführte Aufdehnung der Blutgefäße erneut verschlossen. Es ist allerdings nachgewiesen, dass auch eine temporäre Verbesserung der Durchblutung die Wundheilung ausreichend verbessert.
Ansonsten gelten die gleichen Algorithmen wie bei der Erstvorstellung, wobei mit dem Patienten nach mehreren Eingriffen und langdauernden Krankenhausaufenthalten über die Möglichkeit einer Major-Amputation (Amputation oberhalb des Sprunggelenkes) kritisch diskutiert werden muss.
Erschienen in: Diabetes-Forum, 2017; 29 (3) Seite 47-50