Zusammenfassung
Einleitung: Das Diabetische Fußsyndrom ist eine der gefürchtetsten Komplikationen des Diabetes mellitus. Bei diabetischen Ulzera sowie bei anderen chronischen Wunden aus der allgemeinärztlichen/diabetologischen Praxis sind interdisziplinäre Behandlungskonzepte zum Vermeiden von Infektionen und von fortschreitenden Komplikationen primäres Behandlungsziel. Die Kaltplasmatherapie kann hier einen wertvollen Beitrag leisten.
Methodik: Ein kleines, batteriebetriebenes Kaltplasmagerät wurde bei zehn Patienten (elf Wunden) mit chronischen Problemwunden aus der diabetologischen Schwerpunktpraxis einmal wöchentlich zusätzlich zur Standardtherapie eingesetzt.
Ergebnisse: Bei sieben von elf Wunden kam es zu einer Verbesserung der Wundverhältnisse. In vier Fällen reduzierte sich die Wundfläche deutlich, in drei Fällen kam es zu einem nahezu vollständigen Wundverschluss innerhalb von wenigen Wochen. Eine Wunde stagnierte. Drei Wunden profitierten nicht von der Kaltplasmatherapie, wobei in einem Fall die Allergie des Patienten auf das Verbandsmaterial Grund für das vorzeitige Ende der Behandlung war.
Schlussfolgerung: Die Kaltplasmatherapie ist eine heilungsfördernde Ergänzung zur leitlinien- und stadiengerechten Wundbehandlung von Problemwunden. Sie kann mithilfe eines mobilen Geräts gut in die ambulante Therapie und Pflege integriert werden. Schlüsselwörter
kaltes atmosphärisches Plasma, Kaltplasmamedizin, Diabetisches Fußsyndrom, chronische Wunden, plasma care®
Improved Healing in Problem Wounds with Cold Plasma Therapy Using a Handheld Device: Ten Clinical Case Studies in Diabetology
Summary
Background: Diabetic foot syndrome is one of the most dreaded complications in diabetes mellitus. Diabetic ulcers and other chronic wounds in general medical practice require interdisciplinary treatment approaches to prevent infection and further complications. Cold plasma therapy as an adjunct to standard-of-care may provide a health benefit in these cases.Method: We report on the use of a portable battery-operated cold atmospheric plasma medical device once weekly on ten patients (eleven wounds) with problematic chronic wounds at a diabetes clinic.
Results: Wound condition improved in seven of eleven wounds. The wound surface area decreased significantly in four cases, and wound closure was almost complete within a few weeks in three cases. One wound stagnated. Three wounds (two patients) did not benefit from cold plasma therapy; in one case the therapy stopped pretermly because of the allergy of the patient to the dressing material.
Conclusion: Cold plasma therapy supports wound healing as an adjunct to guideline and stage-specific wound therapy of problematic wounds, and portable devices make for easy integration in outpatient care. Key words
cold atmospheric plasma, plasma medicine, diabetic foot syndrome, hard-to-heal wounds, plasma care®
Einleitung
Das Diabetische Fußsyndrom (DFS) stellt die mit am meisten gefürchtete Komplikation des Diabetes mellitus dar. Die hohe Prävalenz und Inzidenz von Fußkomplikationen bei Typ-2-Diabetikern zeigt die Notwendigkeit und Wichtigkeit für abgestimmte Prävention, Diagnostik und Therapie des Diabetischen Fußsyndroms.
Als Diabetisches Fußsyndrom werden verschiedene Komplikationen einhergehend mit Veränderungen der Fußanatomie und Druckgeschwüren mit meist verzögerter Wundheilung, Infekttendenz und einem hohen Risiko für Amputation zusammengefasst [diabetesDE 2020, Reike 1999].
Als Ursachen für die gefürchtete Fußkomplikation sind die fortschreitende Schädigung der Nerven (Neuropathie) und die Schädigung der Blutgefäße (Angiopathie) des Fußes zu nennen. Oft liegen beide Ursachen in Kombination vor [Reike 1999, Schaper 2020].
Den neuropathischen Fuß mit Osteoarthropathie bis zum Charcot-Fuß zeichnet eine Schädigung der peripheren Nerven durch jahrelang zu hohe Blutzuckerwerte aus. Dies führt zu Veränderungen des Spannungszustands der Fußmuskulatur, Bänder und Sehnen können das Fußgewölbe nicht mehr halten, es sackt in sich zusammen. Druckstellen an den Zehen und vor allem an der Fußsohle entstehen und werden von den Betroffenen aufgrund der vorhandenen Taubheit erst spät oder gar nicht wahrgenommen.
Beim angiopathischen Fuß kommt es aufgrund arterieller Durchblutungsstörungen zur Ischämie in den betroffenen Arealen. Gewebsnekrosen und Gangrän sind die Folge. Dieses zeigt sich oftmals zuerst im Bereich der Zehen.
Bei beiden Faktoren, ob einzeln oder in Kombination, ist jedoch die Verletzung das ausschlaggebende Moment. Liegt eine offene Wunde vor, beginnt in der Regel ein oft jahrelanges Ringen um Wundheilung [Reike 1999, Schaper 2020]. Rezidivierende Ulzera mit Wundinfektionen führen häufig zum Verlust von Zehen bis hin zur Amputation ganzer Gliedmaßen [Heller 2004, Kröger 2017]. Dass in Deutschland jährlich ca. 40 000 Amputationen bei dieser Patientengruppe durchgeführt werden, zeigt, wie hoch die Gefahr einer Amputation als unwiderrufliche Therapie für Patienten mit DFS ist. Die Konsequenz einer Amputation ist neben lebenslanger Pflegebedürftigkeit die Gefahr, den Eingriff nicht zu überleben. Die Mortalität nach einer Amputation ist dabei direkt abhängig von der Amputationshöhe [Narres 2019].
Patientenorientiertes Handeln mit definierten Therapiezielen sowie die Prävention des DFS sollten daher bei der Behandlung von Diabetikern oberstes Ziel sein [Braunwarth 2020, Reike 1999, Schaper 2020]. Bei Patienten mit vorhandenen Fußulzera sind interdisziplinäre Behandlungskonzepte zum Vermeiden von Infektionen und fortschreitenden Komplikationen das primäre Therapieziel. Neben einer leitlinien- und stadiengerechten Wundtherapie mit ausreichendem Débridement, Druckentlastung und engmaschiger Kontrolle leistet die Kaltplasmatherapie hier einen wertvollen Beitrag.
Als Plasma wird in der Physik ein ionisiertes Gas bezeichnet. Dabei handelt es sich um den vierten Aggregatzustand nach fest, flüssig und gasförmig. Natürliche Plasmen wie die Sonne und Blitze sind viele Tausend Grad heiß und sind somit für medizinische Applikationen ungeeignet. Jedoch ist es auch möglich, ein nicht thermisches „kaltes“ Plasma zu erzeugen. Dabei werden nur einzelne Gasteilchen (ca. 1 pro 109) durch Energiezufuhr ionisiert, sodass nur wenig Hitze ohne Schädigungspotenzial entsteht [Gerling 2016].
In der Gastroenterologie ist bereits seit vielen Jahren die Argon-Plasma-Koagulation (APC) etabliert. Dabei handelt es sich um eine elektrochirurgische thermoablative Methode (ca. 100 – 110 °C) zum endoskopischen Management von Erkrankungen wie der hämorrhagischen Proktitis, dem GAVE (Gastric Antral Vascular Ectasia)-Syndrom, blutenden Magengeschwüren und Darmvarizen [Canady 2006, Zenker 2008]. In den letzten 15 Jahren hat sich aber auch ein weiteres medizinisches Anwendungsgebiet etabliert: das Wundmanagement mithilfe von kaltem Atmosphärendruck-Plasma (KAP) [Heinlin 2010, von Woedtke 2019]. Im Gegensatz zur APC haben kalte Plasmen für die Wundbehandlung Temperaturen von unter 40 °C, sodass keine Gewebeschädigung durch Hitze erfolgt. Stattdessen basiert die therapeutische Wirkung bei der Kaltplasmabehandlung unter anderem auf der Interaktion von reaktiven Sauerstoff- und Stickstoffspezies – langlebigen Komponenten des Kaltplasmas – mit Wundpathogenen und dem Gewebe [Schmidt 2018, von Woedtke 2019].
Kaltes Plasma verursacht lokal und temporär oxidativen Stress [Graves 2014]. Das führt zur Bildung von Mikroporen von wenigen Mikrometer Durchmesser in der Zellmembran. Durch diese Poren dringen die hochreaktiven Plasmaspezies in die Zellen ein [Leduc 2009]. Während die Plasmaspezies in Mikroorganismen einschließlich multiresistenter Erreger die Zerstörung von intrazellulären Strukturen wie Proteinen, Lipiden und der freiliegenden DNA verursachen [Morfill 2009] und Pathogene auf diese Weise inaktivieren, zeigt menschliches Gewebe eine mitohormetische Reaktion auf die Kaltplasmaapplikation [Ristow 2014]: Der oxidative Stress stimuliert in eukaryotischen Zellen Stress-Response-Mechanismen, wie den Nrf2-Signalweg [Schmidt 2018]. Bis zu einer gewissen Konzentration führt das zu einer Steigerung der Zell- und Gewebefitness, bevor es bei höheren Stressdosen zur Einleitung des programmierten Zelltods, der Apoptose, kommt [Graves 2014]. Insgesamt kann die Veränderung der Mikroumgebung in der Wunde durch die vorübergehende Applikation von kaltem Plasma daher bei Patienten mit unterschiedlichen Wundgenesen zur Stimulation des Heilungsprozesses führen.
In zahlreichen präklinischen Untersuchungen [Becker 2018, Ermolaeva 2011, Klämpfl 2012, Maisch 2012 (a), Maisch 2012 (b), Maisch 2012 (c), Maisch 2017, Theinkom 2019, Zimmermann 2012] und klinischen Prüfungen [Al Shakaki 2019, Daeschlein 2012, Daeschlein 2015, Heinlin 2013, Hilker 2017, Isbary 2012, Klebes 2015, Rotering 2020] wurde bereits die antimikrobielle Wirkung von kalten Atmosphärendruck-Plasmen belegt, ohne dass es zu Nebenwirkungen oder Resistenzbildung bei Bakterien kam. Zudem verdichteten sich die Hinweise auf eine verbesserte Wundheilung bei akuten und chronischen Wunden durch die Anwendung von KAP [Brehmer 2015, Heinlin 2013, Isbary 2012, Isbary 2013, Kisch 2016, Ulrich 2015). Dies wurde in einer kürzlich veröffentlichten randomisierten und kontrollierten Studie bei Patienten mit diabetischen Fußulzera auch erstmals mit statistischer Signifikanz belegt [Stratmann 2020]. Stratmann und Kollegen zeigten, dass die Kaltplasmabehandlung mit einem Plasmajet unabhängig vom Vorliegen einer Infektion zu einer Verbesserung der Wundheilung im Hinblick auf Wundflächenreduktion und die Zeit bis zum Wundverschluss führte.
Hier berichten wir nun von dem Einsatz eines neuen, für die Ambulanz geeigneten, batteriebetriebenen Kaltplasmageräts bei zehn Patienten mit problematischen Wundverhältnissen in einer diabetologischen Schwerpunktpraxis mit zertifizierter ambulanter Fußbehandlungseinrichtung (Arbeitsgemeinschaft Diabetischer Fuß der Deutschen Diabetes Gesellschaft).
DFS: Diabetisches Fußsyndrom
GAVE: Gastric Antral Vascular Ectasia
KAP: kaltes Atmosphärendruck-Plasma
LADA: late autoimmune diabetes in adults
pAVK: periphere arterielle Verschlusskrankheit
ZAFE: zertifizierte ambulante Fußbehandlungseinrichtung
Methodik
Patienten
Im Zeitraum März bis August 2020 wurden zehn Patienten (elf Wunden) mit Diabetischem Fußsyndrom, Ulcus cruris oder traumatischem Hämatom und problematischen Wundverhältnissen aus einer diabetologischen Schwerpunktpraxis mit zertifizierter ambulanter Fußbehandlungseinrichtung (ZAFE) für eine Anwendungsbeobachtung von der Kaltplasmatherapie als Add-on zur leitliniengerechten Wundbehandlung ausgewählt. Die Patienten wurden vom behandelnden Arzt aufgeklärt. Die Behandlung mit Anwendungsbeobachtung erfolgte in Übereinstimmung mit der Deklaration von Helsinki.
Kaltplasmagerät
Das plasma care® ist ein kleines, batteriebetriebenes Kaltplasmagerät mit einer Zulassung für den europäischen Wirtschaftsraum als Medizinprodukt der Klasse IIa. Es nutzt die Oberflächenmikroentladungstechnologie zur Produktion von kaltem atmosphärischem Plasma direkt aus der Umgebungsluft. Das plasma care® hat folgende Betriebsparameter: Spannung 3,5 kVpp, Wechselstromfrequenz 4 kHz, Plasmaleistung 0,4 – 1,5 W. Es wird in Kombination mit einem sterilen Einmalaufsatz, dem plasma-care®-Abstandhalter, benutzt. Die zulässige Gesamtbehandlungsdauer für ein einzelnes Behandlungsareal von 13 cm² beträgt 1 bis 3 Minuten. Eine Kaltplasmabehandlung ist alle 24 Stunden möglich. Das plasma care® wurde im Rahmen seiner Zweck-bestimmung benutzt.
Wundbehandlung
Nach Aufklärung durch den behandelnden Arzt erhielten die Patienten eine leitlinien- und stadiengerechte Wundbehandlung mit Kompressions- oder Entlastungstherapie, wenn indiziert, und zusätzlich einmal wöchentlich Kaltplasma für unterschiedlich lange Zeiträume (siehe Tab. 1). Eine Fotodokumentation der Wunden erfolgte bei jedem Praxisbesuch.
Bestimmung der Wundgröße
Die Wundfläche wurde anhand der Fotografien mithilfe von ImageJ (ImageJ 1.53e, Wayne Rasband and contributors, NIH, USA) bestimmt; in jedem Bild mit Lineal wurde zunächst anhand des fotografierten Lineals und der „Straight“-Funktion das Pixel-pro-Zentimeter-Verhältnis bestimmt und über die „Set Scale“-Funktion von ImageJ für das jeweilige Bild festgelegt. Anschließend wurde mithilfe der „Freehand Selection“-Funktion der Wundrand markiert. Zuletzt wurde die umrandete Wundfläche mithilfe der „Measure“-Funktion bestimmt. Da die Fotografien nicht standardisiert wurden (z. B. hinsichtlich Winkel, Distanz zur Wunde, Belichtung), ist aus diesen Informationen lediglich ein Trend ersichtlich.
Ergebnisse
Zwischen März 2020 und August 2020 wurden zehn Patienten mit elf chronischen Wunden, davon sechs Männer und vier Frauen im Alter von 45 bis 86 Jahren, aus einer diabetologischen Schwerpunktpraxis für eine Kaltplasmatherapie ausgewählt. Acht Patienten waren Diabetiker (7-mal Diabetes mellitus Typ 2, 1-mal Diabetes mellitus Typ 1 [late autoimmune diabetes in adults, LADA]) mit einem durchschnittlichen HbA1c-Wert von 7,5 ± 1,2 % bei der letzten Messung. Die Diagnose Diabetes mellitus bestand im Schnitt seit 14,6 ± 8,1 Jahren. Alle acht Patienten waren insulinbehandelt. Abgesehen von einem Patienten mit Diabetes mellitus Typ 2 wiesen alle Patienten diabetische Folgeerkrankungen auf. Beide Nichtdiabetiker waren aufgrund von offenen Beinen (Ulcus cruris) mit stagnierender Wundheilung in Behandlung. Komorbiditäten waren bei sieben von zehn Patienten bekannt. Weitere Details zu den einzelnen Patienten sind in Tabelle 1 angegeben.
Ein Patient (Patient 10) wies subjektiv bei der Beurteilung der Wundbilder eine Besserung der Wundverhältnisse sowie eine Reduktion der Wundfläche auf. Aufgrund technischer Probleme war eine quantitative Auswertung der Wunde nicht möglich, weshalb der Patient aus der weiteren Beurteilung herausgenommen wurde.
Der Großteil der Patienten (8/9) wies jeweils eine Wunde an einer unteren Extremität auf. Bei einem Patienten (Patient 04) wurden Teilamputationen an beiden Vorfüßen vorgenommen, in deren Folge sich an beiden Lokalisationen chronische Ulzera entwickelten. Alle Wunden wurden über unterschiedliche Zeiträume von 5 bis 13 Wochen mit Kaltplasma behandelt. Die Behandlung erfolgte jeweils einmal pro Woche in der Praxis zusätzlich zur leitlinien- und stadiengerechten Wundversorgung.
Bei zwei Patienten verschlechterten sich die Wundverhältnisse leicht während der Kaltplasmatherapie. Dieses betraf Patient 04 mit der beidseitigen Vorfußamputation sowie Patientin 08 mit einem Ulcus cruris nach einem Trauma mit Erysipelbildung. In beiden Fällen kam es nach einer initialen Besserung im weiteren Verlauf wieder zu einer Vergrößerung der Wundfläche. Insgesamt führte die Kaltplasmatherapie bei sechs von neun Patienten mit problematischen Wunden zu einer Verbesserung der Wundverhältnisse mit besserer Abheilungstendenz bis hin zu einem nahezu vollständigen Wundverschluss in drei Fällen.
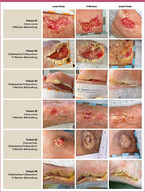
Im Folgenden werden anhand von sechs Beispielen Behandlungsverläufe aus der Patientenkohorte beschrieben:- Fallbericht Patient 01: Der stark adipöse Patient mit insulinbehandeltem Diabetes mellitus Typ 2 entwickelte vor mehr als fünf Jahren ein Ulcus cruris am rechten Unterschenkel bei diagnostisch abgeklärten guten Durchblutungsverhältnissen. Trotz leitlinien- und stadiengerechter Wundbehandlung sowie eines insgesamt befriedigend eingestellten Diabetes heilte die Wunde nicht. Die Vorbehandlung erfolgte sowohl durch den Hausarzt als auch durch einen Dermatologen/Phlebologen. Zusätzlich zur stadiengerechten Wundbehandlung und Kompressionstherapie wurde Ende März 2020 eine Therapie mit Kaltplasma initiiert. Die Wunde wurde unter der Kaltplasmabehandlung zunächst optisch sauberer. Nach neun Wochen musste die Therapie mit CAP aufgrund der allergischen Reaktionen des Patienten auf das Verbandmaterial beendet werden. Eine allergische Reaktion auf CAP selbst liegt nicht vor. Die Wunde zeigt daher nur eine geringe Verkleinerung der Wundfläche von 6 % (siehe Abb. 1, erste Reihe). Dieser Verlauf ist beispielhaft für einen vorzeigen Abbruch der Behandlung mit CAP aufgrund äußerer Umstände, welche nicht immer ausgeschlossen werden können.
- Fallbericht Patient 02: Ein leicht adipöser, 60-jähriger Patient mit Diabetes mellitus Typ 2 und Hypertonie entwickelte ein Diabetisches Fußsyndrom auf dem Boden einer diabetischen peripheren Neuropathie. Im September 2019 musste der linke Fuß auf Höhe des oberen Sprunggelenks amputiert werden. Seitdem erfolgte eine leitlinien- und stadiengerechte Wundbehandlung bei gleichzeitiger Vollentlastung im Gehapparat. Jedoch kam es zu einem protrahierten Verlauf in der Wundheilung. Ende März 2020 wurde die Kaltplasmatherapie initiiert, woraufhin sich eine sehr gute Abheilungstendenz einstellte. Die Wundfläche verringerte sich innerhalb des Behandlungszeitraums von 11 Wochen um ca. 85 % (siehe Abb. 1, zweite Reihe).
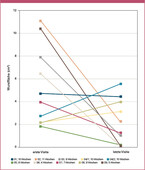
- Fallbericht Patient 03: Ein adipöser, 55-jähriger Patient mit Diabetes mellitus Typ 2 sowie diversen Komorbiditäten einschließlich Bluthochdrucks, einer Fettstoffwechselstörung, Metabolischen Syndroms und einer dilatativen Kardiomyopathie mit chronischer Herzinsuffizienz entwickelte ein Diabetisches Fußsyndrom auf dem Boden einer diabetischen peripheren Neuropathie, sodass der linke Vorfuß Anfang 2020 teilweise amputiert werden musste. Trotz leitlinien- und stadiengerechter Wundbehandlung und gleichzeitiger Vollentlastung im Entlastungsschuh blieben die Wundverhältnisse problematisch. Ende März 2020 wurde die Kaltplasmatherapie initiiert und über einen Behandlungszeitraum von 7 Wochen stellte sich eine gute Abheilungstendenz bis zu einem nahezu vollständigen Wundverschluss ein (siehe Abb. 1, dritte Reihe). Die Wundfläche reduzierte sich um mehr als 90 % (siehe Abb. 2).
- Fallbericht Patient 05: Ein 74-jähriger Patient mit Fettstoffwechselstörung und peripherer arterieller Verschlusskrankheit (pAVK) stellte sich mit einem bereits seit mehreren Monaten bestehenden prätibialen Ulcus cruris rechts in der Praxis vor. Die Vorbehandlung erfolgte durch den Hausarzt. Nach Revaskularisation wurde bei dem Patienten Ende März 2020 die Kaltplasmatherapie zusätzlich zur leitlinien- und stadiengerechten Wundbehandlung initiiert. Innerhalb von einem Behandlungszeitraum von 5 Wochen kam es zu einer deutlichen Verbesserung der Wundverhältnisse bis hin zur fast vollständigen Abheilung. Die Wundgröße reduzierte sich unter der Therapie um 94 % (siehe Abb. 1, vierte Reihe).
- Fallbericht Patient 06: Ein adipöser, 65-jähriger Patient mit Diabetes mellitus Typ 2, Metabolischem Syndrom und Hypertonie entwickelte ein Diabetisches Fußsyndrom auf dem Boden einer diabetischen peripheren Neuropathie und einer diabetischen Neuroosteoarthropathie. Der Patient war bereits seit mehreren Monaten wegen plantarer Druckulzerationen in Behandlung und erhielt neben der leitlinien- und stadiengerechten Wundbehandlung eine weitgehende Vollentlastung der betroffenen Stellen in Entlastungsschuhen. Ende März 2020 wurde auch bei diesem Patienten die Kaltplasmatherapie initiiert und führte zu einer vollständigen Abheilung der Wunde innerhalb von 5 Wochen (siehe Abb. 1, fünfte Reihe).
- Fallbericht Patient 09: Ein normalgewichtiger, 58-jähriger Patient mit Diabetes mellitus Typ 2 und Diabetischem Fußsyndrom auf dem Boden einer diabetischen peripheren Neuropathie stellte sich im Februar 2020 in der Praxis vor. Nach einem Krankenhausaufenthalt mit Exazerbation eines Fußulkus und operativer plantarer Versorgung zeigte die Wunde eine zunächst schlechte Abheilungstendenz. Im Mai 2020 wurde zusätzlich zur leitlinien- und stadiengerechten Wundbehandlung und Kompressionstherapie einmal wöchentlich die Kaltplasmabehandlung initiiert. Dadurch kam es zu einem deutlichen Fortschritt in der Abheilung des Ulkus, sodass sich die Wundfläche schon nach 5 Wochen um ca. 40 % reduziert hatte (siehe Abb. 2). Nach einem Behandlungszeitraum vom 11 Wochen war die Wunde nahezu vollständig verschlossen (siehe Abb. 1, sechste Reihe).
Folgerungen
In der vorliegenden Fallserie wurde bei sechs von zehn Wunden eine Verbesserung der Wundverhältnisse erreicht, bei drei davon konnte sogar ein nahezu vollständiger Wundverschluss innerhalb von wenigen Wochen erreicht werden. Drei Wunden vergrößerten sich leicht unter der Kaltplasmatherapie. Eine Wunde stagnierte.
Heilungs- und Therapierfolg hängen von einer Vielzahl von Faktoren ab. So müssen lokale Einflüsse wie kritische bakterielle Kolonisation, das Vorhandensein eines Biofilms und andere mögliche lokale Ursachen sowie ggf. weitere Differenzialdiagnosen erwogen und immer wieder neu beurteilt werden. Weitere Faktoren, die eine Wundheilung trotz leitliniengerechter Versorgung verhindern, sind häufig eine geschwächte Immunabwehr, unzureichende Blutversorgung, die Stoffwechsellage, nicht ausreichende Kausaltherapie und Medikamente. Aber auch Umstände wie mangelnde Körperhygiene und eine ungesunde Lebensweise haben Einfluss auf die Wundheilung. Außerdem gehört das Evaluieren von begleitenden Maßnahmen, wie der Kompressionstherapie und Entlastungsmaßnahmen, zu einer notwendigen Ursachenforschung.
Die Ergebnisse der vorliegenden Fallserie bestätigen, dass die Kaltplasmatherapie eine heilungsfördernde Ergänzung zur leitlinien- und stadiengerechten Wundbehandlung von Problemwunden aus der diabetologischen Schwerpunktpraxis mit Fußambulanz ist. Zudem kann sie mithilfe eines mobilen Geräts gut in die ambulante Versorgung integriert werden. Weitere kontrollierte Studien sind notwendig, um die Effektivität der Kaltplasmatherapie bei der Behandlung von Problemwunden zu validieren.
Für die Praxis
Wir berichten von dem Einsatz eines neuen, für die Ambulanz geeigneten, batteriebetriebenen Kaltplasmageräts bei zehn Patienten, davon acht Diabetiker, mit problematischen Wundverhältnissen:
- Bei sechs von zehn Wunden wurde eine Verbesserung der Wundverhältnisse erreicht, bei drei davon konnte ein nahezu vollständiger Wundverschluss innerhalb von wenigen Wochen erreicht werden.
- Drei Wunden vergrößerten sich leicht unter der Kaltplasmatherapie.
- Eine Wunde stagnierte.
Danksagung
Wir bedanken uns bei Jens Kirsch für wertvolle Diskussionen und Review.
Autoren
Jasmin Reinert Reinert¹, Claudia C. Roskopf², Stefanie Ascher², Nikolaus Scheper¹
(1) Praxis Dr. Scheper & Schneider & Veit, Marl
(2) terraplasma medical GmbH, Garching
Manuskript eingegangen: 10. Dezember 2020
Manuskript angenommen: 11. Mai 2021
Interessenkonflikte
Jasmin Reinert gibt keinen Interessenkonflikt in Bezug auf die Inhalte des Artikels an.
Claudia C. Roskopf und Stefanie Ascher geben an, dass sie Angestellte sind bei der terraplasma medical GmbH.
Nikolaus Scheper gibt an, dass er Mitglied in der DiaMed e. G. (Genossenschaft der Diabetologen) ist.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2021; 30 (4) Seite 221-228