In den nächsten Jahren ist zu erwarten, dass es zahlreiche Neuentwicklungen in der Insulintherapie geben wird. Inwieweit alternative Applikationswege in Zukunft die subkutane Applikation ersetzen, ist derzeit noch kritisch zu hinterfragen. Professor Thomas Forst berichtet.
Für Patienten mit einem Diabetes mellitus Typ 1 und viele Patienten mit einem Diabetes mellitus Typ 2 ist die externe Zufuhr von Insulin essentieller Bestandteil der Therapie. In Gegensatz zu anderen Hormonsubstitutionsbehandlungen spielt die Dosiswirkungskurve bei der Insulinsubstitution eine entscheidende Rolle um eine norm-nahe Blutzuckereinstellung unter Vermeidung von Hypoglykämien zu erzielen.
So sollte idealerwiese der Insulinspiegel zu jedem Zeitpunkt, egal ob nüchtern oder nach einer Mahlzeit, exakt auf den erforderlichen Bedarf abgestimmt sein. Derzeit ist die subkutane Insulininjektion der übliche Zugangsweg für die exogene Insulinzufuhr. Hierbei wird die Insulinmenge (Dosis) durch den Patienten anhand von Kohlenhydrataufnahme, aktuellem Glukosewert und dem Grad der körperlichen Aktivität geschätzt und anschließend in das subkutane Gewebe gespritzt.
Aufgrund der Absorptionskinetik des Insulins aus dem subkutanen Gewebe und einer unphysiologischen Verteilung des Insulins in verschiedenen Kompartimenten im Organismus ist die subkutane Insulintherapie jedoch nur sehr eingeschränkt in der Lage eine physiologische Insulinwirkung nachzuahmen. So folgt die Insulinwirkung nach subkutaner Gabe den Absorptionseigenschaften des verwendeten Insulins, und nicht der des aktuellen Insulinbedarfs. Die Insulinversorgung der Zielzellen unterliegt somit nicht ihrem aktuellen metabolischen Bedarf, sondern den pharmakokinetischen und pharmakodynamischen Eigenschaften des subkutan applizierten Insulins.
Die klinische Konsequenz sind unphysiologische Blutzuckerschwankungen mit ausgeprägten hyperglykämischen und hypoglykämischen Phasen. Um den individuell erforderlichen Insulinbedarf bestmöglich abzubilden, wurden in den vergangenen Jahren zahlreiche neue Insulinformulierungen in die Therapie des Diabetes mellitus eingeführt. Hierbei werden lang- und ultra lang wirkende Basalinsuline von schnell- und ultra schnell wirkenden Mahlzeiteninsulinen unterschieden. Mit diesen Insulinen nähern wir uns zunehmend physiologischen Insulinprofilen.
Insulinphysiologie und Limitationen einer subkutanen Insulintherapie
Trotz Einführung zahlreicher neuer Insuline mit optimierten pharmakodynamischen Eigenschaften zur Anpassung der Insulinkinetik an den basalen und den postprandialen Insulinbedarf bleibt die subkutane Insulintherapie weit hinter dem physiologischen Anspruch zurück. Unter physiologischen Aspekten wird Insulin blutzuckerabhängig von der Betazelle freigesetzt und wirkt dabei zunächst als parakrines Hormon auf die umgebenden alpha- und delta Zellen innerhalb der Langerhans’schen Insel.
Diese parakrine Wirkung des Insulins ist wesentlicher Bestandteil einer intakten Kopplung zwischen Insulinsekretion und der Glukagonsekretion aus den alpha Zellen der Langerhans’schen Inseln. Die Konzentration des Insulins an der alpha-Zelle liegt hierbei etwa 100-fach über der in der peripheren Blutbahn messbaren Insulinkonzentration. Gemeinsam werden Insulin und Glukagon im Weiteren in das Pfortaderkreislauf abgegeben, wo ihr Konzentrationsverhältniss (Insulin/Glukagon-Quotient) die Glukoseaufnahme oder Glukosefreisetzung aus der Leber bestimmt.
Vierzig bis achtzig Prozent des Insulins werden bei der ersten Passage durch die Leber im Sinne eines "First Pass Effektes" degradiert, so dass die Konzentration des Insulins in der Peripherie im Vergleich zu der im Pfortaderkreislauf deutlich geringer ist. Man spricht hierbei auch von einem hepato-peripheren Insulingradienten der wiederum entscheidende Bedeutung für die Aufrechterhaltung einer ausgewogenen hepatischen Glukoseregulation im Verhältnis zur peripheren Glukoseutilisation aufweist.
So führt eine Verdopplung der Insulinfreisetzung aus der Betazelle zu einer 80-prozentigen Hemmung der Glukosefreisetzung aus der Leber, während die periphere Glukoseutilisation lediglich um ca. 20 Prozent gesteigert wird (1). Bei der Regulation des Nüchtern- und postprandialen Glukosestoffwechsel spielt neben der absoluten Insulinkonzentration der hepatische Insulin-Glukagon-Quotient sowie der hepato-periphere Insulingradient eine wichtige Rolle zur Aufrechterhaltung einer ausgewogenen Glukosehämostase.
Schwierigkeit der differenzierten physiologischen Wirkung
Aus diesen komplexen Wirkungen des Insulins in verschiedenen Kompartimenten wird klar, dass eine differenzierte physiologische Wirkung des Insulins in verschiedenen Kompartimenten durch die derzeitige subkutane Insulinsubstitution nur sehr eingeschränkt wiedergespiegelt werden kann. Die Schwierigkeit besteht darin, eine an den aktuellen Glukosespiegel angepasste Insulinmenge, zur richtigen Zeit, bedarfsgerecht und gewebsspezifisch, zur Verfügung zu stellen.
Die pharmakodynamischen Eigenschaften subkutan applizierter Insuline werden insbesondere durch ihr Absorptionsverhalten aus dem subkutanen Gewebe bestimmt. Hierbei modulieren zahlreiche Faktoren wie die Beschaffenheit des subkutanen Gewebes, die Dichte des lokalen Kapillarbettes, die Hauttemperatur, die lokale Durchblutung, u.v.a. die Absorptionskinetik und damit die pharmakodynamischen Effekte des Insulins. Die Folge ist eine nicht bedarfsgerechte Bereitstellung des Insulins mit der Entwicklung von Hyper- und Hypoglykämien.
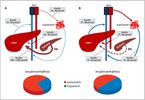
Ein weiterer Nachteil des subkutanen Zugangsweges für Insulin ergibt sich aus der daraus folgenden unphysiologischen Insulinverteilung im Körper. Der Insulingradient von der Alphazelle über die Pfortader bis in die Peripherie wird dabei völlig aufgehoben. Hieraus ergeben sich relativ zu niedrige Insulinkonzentrationen an der Alphazelle und der Leber, während in der Periphere ausnahmslos eine Hyperinsulinämie vorherrscht (Abbildung 1).
Eine Reduktion des hepatischen Insulin/Glukagon-Quotienten bedingt eine Entkopplung der hepatischen Glukosefreisetzung (2), welche insbesondere mit postprandialen Hyperglykämien einhergeht. Demgegenüber bedingt der Verlust des peripher/hepatischen Insulingradienten eine verstärkte periphere Glukoseutilisation, welche insbesondere mit einem Anstieg des Hypoglykämierisikos während der Nacht in Verbindung gebracht wird (1).
Trotz vieler Errungenschaften in der Anpassung der Insulinwirkung an den physiologischen Bedarf durch moderne Insulinanaloga mit optimierten pharmakokinetischen und pharmakodynamischen Eigenschaften, verbesserten Injektionstechniken, Insulinpumpen und zahlreicher neuer Möglichkeiten der Stoffwechselkontrolle, bleibt unsere derzeitig subkutan basierte Insulintherapie weit hinter dem Anspruch einer physiologischen Regulation des Glukosestoffwechsels zurück. Die Entwicklung neuer Technologien und neuer Insuline erscheint daher nach wie vor eine große Herausforderung an die klinische Diabetologie zu sein.
Glukoseadaptierte Insulinfreisetzung
Ein wesentlicher Fortschritt in der Insulintherapie wäre in einer an die aktuelle Glukosekonzentration adaptierten Insulinwirkung zu sehen. Die Entwicklung kontinuierlicher Glukosemesssysteme und damit verbundener automatischer Insulinpumpensysteme (Closed Loop) hat in den letzten Jahren bahnbrechende Fortschritte erzielt, und kann erheblich zur Reduktion von Glukoseschwankungen beitragen. Ein limitierender Faktor dieser neuen technischen Optionen muss jedoch in der verzögerten Absorption des Insulins aus dem subkutanen Gewebe gesehen werden.
Ein schnellerer Zugang des Insulins in die Zirkulation und damit eine schnellere Wirkung in den Zielzellen könnte hier eine weitere Optimierung der Insulintherapie nach sich ziehen. So konnte in einer klinischen Studie mit einem Closed-Loop-Insulin-Pumpensystem durch eine intraperitoneale Insulinapplikation eine bessere Glukosekontrolle im Vergleich zur subkutanen Applikation des Insulins mit dem gleichen Closed Loop System dargestellt werden (2). Insbesondere postprandiale Glukoseexkursionen konnten durch die schnellere intraperitoneale Insulinaufnahme deutlich besser kontrolliert werden.
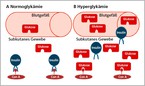
uch wenn diese Studie die Bedeutung einer schnellen Insulinverfügbarkeit und des primär portalen Zugangsweges für eine optimale Glukosekontrolle unterstreicht, erscheint der intraperitoneale Weg für die Mehrzahl der Patienten mit einem Diabetes eher unrealistisch. Neue Insuline mit einer weiter beschleunigten Absorption aus dem subkutanen Gewebe könnten hierbei eine Kompromisslösung sein. Durch eine Änderung in der Formulierung des Insulins steht uns mit FiAsp® eine erstes dieser besonders schnellaus dem subkutanen Raum absorbierbaren Insuline im klinischen Alltag zur Verfügung.
Durch Zusatz von Nikotinamid und Arginin in dieser Formulierung wird dieses Insulin besonders rasch nach subkutaner Applikation in die Blutbahn aufgenommen. Insbesondere in der Insulinpumpentherapie kann dies zu einer weiteren Optimierung der Glukosekontrolle eingesetzt werden (Abbildung 2) (3).
Weitere schnell absorbierbare Insuline befinden sich derzeit in der klinischen Entwicklung und werden wohl in naher Zukunft unser Insulinportfolio ergänzen (4). Auch diese schnell absorbierbaren Insulinanaloga können mit hoher Wahrscheinlichkeit die Glukosekontrolle in Verbindung mit einer kontinuierlichen Glukosemessung und automatisierten Insulinpumpensystemen weiter verbessern (5).
Glukoseabhängige Absorption von Insulin
Ein weiterer Ansatz zur Glukose adaptierten Insulintherapie besteht in der Entwicklung von subkutanen Insulinformulierungen, welche in Abhängigkeit von der interstitiellen Glukosekonzentration Insulin freisetzen und somit glukoseabhängig wirken. Das Grundprinzip verschiedener molekularer Technologien besteht grundsätzlich ist einer Kopplung des Insulins an verschiedene Trägersubstanzen aus denen das Insulin in Anhängigkeit von der umgebenden Glukosekonzentration freigesetzt wird (Abbildung 3).
Derzeit werden im Wesentlichen drei molekulare Technologien verfolgt, um dieses Ziel zu erreichen (6, 7):
1. Enzymatisch gesteuerte Insulinfreisetzung
Hierbei findet das Enzym Glukoseoxidase als Trigger für die Insulinfreisetzung Verwendung. Bei ansteigenden Glukosewerten führt eine vermehrte Glukoseoxidation zu einer Absenkung des pH-Wertes was mit einer Freisetzung des Insulin von speziellen Trägermedien gekoppelt werden kann. Limitierend ist hierbei eine relativ geringe Geschwindigkeit der Insulinfreisetzung. Sowie mögliche Störeinflüsse durch Schwankungen in der Gewebstemperatur oder der Sauerstoffsättigung.
2. Molekulare Detektion mittels alphatischer Phenylboronsäure Konjugate (PBA)
Bei dieser Technologie wird Insulin über eine Albuminbindung an Phenylboronsäure-Konjugate gekoppelt, welche hierbei als Glukosededektoren agieren. Steigt die Glukosekonzentration in der interstitiellen Flüssigkeit an, wird Insulin aus der Albuminbindung freigesetzt (8).
Durch Verwendung verschiedener Phenylboronsäure-Konjugate (PBA-F; PBA-N, PBA-A, PBA-S) können Insuline mit unterschiedlichen Glukoseschwellen zur Freisetzung des Insulins geschaffen werden (Abbildung 4). Als Nachteil dieser Technologie muss die fehlende Spezifität für Glukose erwähnt werden. So führt bei dieser Technologie auch ein Fruktose Anstieg zu einer Freisetzung des Insulins aus der Albuminbindung.
3. Protein/Polymer gebundenes Insulin
Insulin wird bei diesem Ansatz an spezielle Trägerproteine, wie beispielsweise an Con A (Lektin) gebunden. Ansteigende Glukosekonzentrationen bedingen eine Dissoziation des Insulins aus der Trägerbindung mit anschließender Absorption des Insulin in die Blutbahn nach sich. Vorteil dieser Methode ist die hohe Spezifität für Glukose sowie eine sehr schnelle Freisetzung des Insulins bei Anstieg der Glukosekonzentration (9).
Neue nanomolekulare Technologien können hierbei möglicherweise erhebliche neue Aspekte in der glukoseabhängigen, subkutanen Insulinapplikation eröffnen (9). Neben der subkutanen Installation solcher glukoseabhängigen Insulinformulierungen befinden sich mit Mikronadeln versehene Pflastersysteme zur glukoseabhängigen transdermalen Insulinabgabe in der klinischen Entwicklung und konnten tierexperimentell vielversprechende Ergebnisse erbringen (10, 11).
Hepato-präferentielle Insulinapplikation
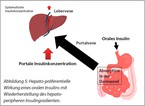
Wie oben dargestellt bewirkt endogen in die Pfortader freigesetztes Insulin zunächst eine Hemmung der endogenen Glukosefreisetzung in der Leber, bevor es in deutlich geringerer Konzentration in der systemischen Zirkulation erscheint und die periphere Insulinaufnahme in Muskelzellen triggert. Neue modifizierte Basalinsuline können möglicherweise in Zukunft eine hepato-präferenzielle Wirkung entfalten (12). Erste klinischen Studien deuten auf eine Senkung des Hypoglykämie Risikos und eine geringere Gewichtszunahme unter hepato-präferentiellen Insulinen im Vergleich zu herkömmlichen Basalinsulinen hin (13, 14).
Seit Jahrzehnten wird an Insulinen geforscht, die über alternative Zugangswege appliziert werden können. So wurden Insuline für orale, pulmonale, transdermale, intranasale, okulare, vaginale und rektale Zugangsrouten entwickelt (1, 15). Neben der komfortableren Applikation eröffnet die orale Insulinzufuhr mit der damit verbundenen gastrointestinalen Aufnahme in das Pfortadersystem Vorteile einer hepato-präferentiellen Wirkung dieser Insulinformulierungen (Abbildung 5).
Als wesentliche Herausforderungen in der oralen gastrointestinalen Insulinapplikation können drei Barrieren angesehen werden:- Niedriger pH im Magen
- Proteasen des Magen-Darmtraktes
- Erschwerte Absorption über die Darmmukosa
Optimierte Formulierungen wie spezielle Einkapselungen, Nanocarrier, Protease-Inhibitoren und Insulinstabilisatoren sollen Insulin vor der Degradation im Magen-Darmtrakt schützen. Darüber hinaus werden Absorptionsverstärker, Liposomen, Mizellen, Microspheren und Nanopartikel verwendet um die Absorption des Insulins zu verbessern (16, 17). Erste klinische Untersuchungen mit Diabetespatienten bestätigen grundsätzlich die Machbarkeit einer oralen Substitution mit Insulin, wobei jedoch die eine sehr geringe Bioverfügbarkeit nach wie vor die größte Hürde für den Einsatz oraler Insuline darstellt.
Zusammenfassend werden für die nächsten Jahre zahlreiche Neuentwicklungen in der Insulintherapie erwartet. Eine Annäherung der Kinetik der exogenen Insulinsubstitution an physiologische Sekretions- und Verteilungsmuster im Körper lassen auf eine weitere Optimierung der Blutzuckereinstellung hoffen. Inwieweit alternative Applikationswege in Zukunft die subkutane Applikation ersetzen ist derzeit aber noch kritisch zu hinterfragen.
Erklärung zum Interessenskonflikt:
Prof. Dr. Thomas Forst hat Berater- und Vortragshonorare für wissenschaftliche Veranstaltungen von Lilly, Sanofi, Berlin Chemie, MSD, Astra Zeneca und Novo Nordisk erhalten.
Erschienen in: Diabetes-Forum, 2019; 31 (1/2) Seite 28-32