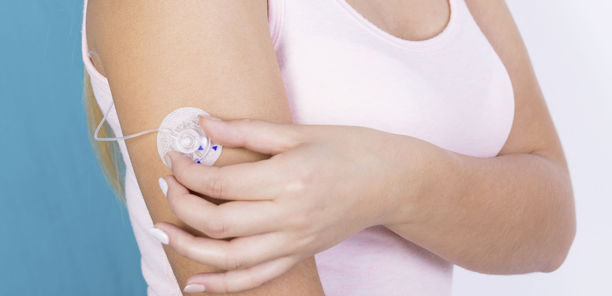
Diabetologen und Diabetesberater beobachteten bisher eine eher begrenzte Anzahl von Hautreaktionen in der täglichen Praxis auf die Klebepflaster von Medizinprodukten; es gibt nur wenige aktuelle wissenschaftliche Publikationen zu Hautreaktionen auf Pflaster im Diabetesbereich (1, 2).
Einleitung
Medizinprodukte für die Diabetestherapie, wie Systeme zum kontinuierlichen Glukosemonitoring (CGM) oder Insulinpumpen, unterliegen hohen regulatorischen Anforderungen. Der Fokus der Herstellerunternehmen und der behandelnden Diabetologen liegt bei der Nutzung solcher Systeme in erster Linie auf dem klinischen Einsatz und deren Sicherheit, also auf der Vermeidung von Hypoglykämien und Geräteausfällen.
Im Alltag beschäftigen Patienten jedoch andere Aspekte, dazu gehören u. a. schlecht klebende Pflaster (die benötigt werden, um die Medizinprodukte auf der Haut zu fixieren), Schmerzen beim Ablösen der Pflaster oder Hautreaktionen wie Juckreiz und Rötung auf die Pflaster. Dabei sind die Anforderungen für einen Klebstoff, mit dem Medizinprodukte, wie Insulininfusionssets (IIS), auf der Haut fixiert werden, hoch: Das Produkt soll fest auf der Haut haften, ohne vor Ende seiner Nutzungsdauer abzufallen, und soll keine unangenehmen Hautreaktionen während seiner Verwendung bzw. nach dessen Entfernung verursachen. Die intendierte Nutzungsdauer (Patienten nutzen solche Systeme in der Praxis, wenn möglich, häufig länger) für die Systeme ist recht unterschiedlich: Patch-Pumpen, die direkt auf die Haut aufgeklebt werden, wie auch die IIS von herkömmlichen Insulinpumpen, werden üblicherweise alle zwei bis drei Tage gewechselt. Dagegen bleiben CGM-Systeme, die Messergebnisse unmittelbar anzeigen (Real-Time-CGM, rtCGM), für sechs bis sieben Tage an einer Hautstelle, das "Flash-Glukose-Monitoring-System" (intermittent scanning CGM, iscCGM) sogar für 14 Tage.
Diabetologen und Diabetesberater beobachteten bisher eine eher begrenzte Anzahl von Hautreaktionen in der täglichen Praxis auf die Klebepflaster von Medizinprodukten; es gibt nur wenige aktuelle wissenschaftliche Publikationen zu Hautreaktionen auf Pflaster im Diabetesbereich (1, 2). In deutlichem Kontrast dazu gibt es allerdings diverse Internetportale, in denen sich Patienten zu Hautreaktionen austauschen und Vorschläge zum Umgang mit diesen suchen. Patienten versuchen, sich selbst zu helfen, indem sie z. B. versuchen, das Pflaster von den IIS zu lösen und die Kanüle anders zu fixieren, oder verschiedene Pflastervarianten diskutieren oder welche Hautschutzsprays und Kortisoncremes helfen könnten.
Die Intensität der Kommunikation spricht für eine Zunahme der Häufigkeit, mit der Hautreaktionen auftreten. So berichtete vor kurzem eine "Statistik" in einem Patientenjournal ("Insuliner") (3), dass von 169 Patienten, die iscCGM verwenden, nur 83 keine Hautreaktionen angaben. Alle anderen Patienten berichten über ein gewisses Maß an Hautreaktionen, 5 Patienten gaben an, iscCGM nicht mehr verwenden zu können wegen der Hautreaktionen. In der Wunschliste der Patienten am Ende des Artikels wurde eine Änderung des Klebstoffs als häufigster Wunsch genannt. In klinischen Studien mit iscCGM, die vor kurzem präsentiert und auch schon teilweise publiziert wurden (REPLACE und IMPACT), wurden auch Hautreaktionen berichtet, allerdings in einem geringen Ausmaß (4, 5). Dabei müssen Patienten, die an solchen Studien teilnehmen, bestimmte Ein- und Ausschlusskriterien erfüllen und nutzen iscCGM maximal für einige Monate, nicht für längere Zeiträume. In der Praxis scheinen Hautreaktionen vor allem bei Patienten aufzutreten, die iscCGM über einen längeren Zeitraum verwenden; darauf deuten Hinweise von Diabetologen, Diabetesberatern und Betroffenen in Deutschland hin.
Im Folgenden werden verschiedene Aspekte diskutiert, die im Zusammenhang mit Hautreaktionen auf Pflasterklebstoffe von Relevanz sind.
Wie hoch ist die Häufigkeit von Hautreaktionen?
Die Unterschiede in der Häufigkeit, mit der Hautreaktionen auf der Nutzerebene "wahrgenommen" werden, im Vergleich zu Berichten auf der Behandler-/akademischen Ebene, beruhen vermutlich auf mehreren Gründen:
- Klinische Studien mit neuen Medizinprodukten, in denen Hautreaktionen als Nebenwirkungen (unerwünschte Ereignisse) erfasst werden, werden üblicherweise mit einer relativ kleinen Anzahl von selektierten Patienten durchgeführt. Solche Patienten haben keine oder wenige andere Erkrankungen, entstammen einer bestimmten Altersgruppe, nehmen keine oder weniger andere Medikamente etc. Die Güte, mit der Nebenwirkungen bei solchen Studien erkannt, dokumentiert und berichtet werden, ist unklar.
- Diese Studien haben nur eine begrenzte Studiendauer: Während es zu Hautreaktionen wie Irritationsdermatitis, toxischer Dermatitis usw. bereits nach kürzester Zeit kommen kann, bedarf die Entwicklung einer Kontaktallergie, z. B. auf einen Klebstoff, in der Regel eines längeren Gebrauchs mit wiederholten Anwendungen. Es kann Wochen bis Jahre dauern, bis eine Kontaktallergie entsteht. Wenn die Patienten aber eine Kontaktallergie gegen z. B. Klebstoffe entwickelt haben, dann reagieren sie innerhalb einer kurzen Zeit, d. h. in wenigen Stunden, darauf. Liegt eine Kontaktallergie einmal vor, dann bleibt sie lebenslang!
- Wenn es bei der Verwendung eines zugelassenen Medizinprodukts zu einer Hautreaktion kommt, wird sie dann im Behandlungsalltag erkannt und offiziell dokumentiert? In der Praxis wird der Patient diese seinem behandelnden Diabetologen und Diabetesberater berichten. Diese werden ihn beraten und Therapieempfehlungen geben, aber sie werden die Hautreaktion vermutlich eher nicht systematisch dokumentieren und melden. Eine solche Meldung an eine entsprechende offizielle Stelle, die notwendig ist, um solche Nebenwirkungen zu erfassen, ist mit einem relevanten Zeit- und Arbeitsaufwand verbunden. Es gilt nicht nur, die eigentliche Nebenwirkung adäquat zu beschreiben und zu dokumentieren, es gilt auch, Informationen zur medizinischen Geschichte des Patienten, inklusive Verwendung anderer Medikamente, zu beschreiben und Rückfragen zu beantworten. Der Arzt erhält für diesen Aufwand keine Honorierung noch hat er einen unmittelbaren anderen Vorteil davon.
- Um das konkrete Problem zu lösen, wird zu einem Wechsel zu einem anderen Medizinprodukt geraten. Wenn Patienten z. B. ein rtCGM-System haben, wechseln sie wieder zur herkömmlichen Blutzuckermessung zurück oder nutzen ein anderes System. Dabei stehen nicht für alle Einsatzbereiche Alternativprodukte zur Verfügung bzw. haben diese andere Eigenschaften. Es fehlt allerdings ein klarer Leitfaden für die Praxis, nach dem sich Behandler und Patienten in solchen Situationen richten können.
- In Einzelfällen werden der Patient und/oder der Arzt/das Diabetesteam eine Hautreaktion als unerwünschtes Ereignis melden wollen.
Der Patient kann dies tun, indem er bei dem Hersteller anruft und die Hautreaktion bei der Service-Hotline meldet. Dort wird die Beschwerde dokumentiert und bewertet. Wie die Verantwortlichen beim Herstellerunternehmen damit umgehen und welche Schlüsse sie daraus ziehen, ist unklar. Sie müssen solche Berichte den Regulierungsbehörden melden und diese Berichte werden in Datenbanken gesammelt. Während die MAUDE (Manufacturer and User Facility Device Experience)-Datenbank der amerikanischen Gesundheitsbehörde (Food and Drug Administration, FDA) für solche Meldungen öffentlich zugänglich ist (6), ist die Eudamed (European Database on Medical Devices)-Datenbank in Europa nicht öffentlich zugänglich (7). Wenn es zu einer hohen Anzahl von gleichlautenden Meldungen kommt (wobei unklar ist, was dies konkret bedeutet), wird dieses "Signal" erkannt (von wem konkret?) und die Hersteller und/oder Behörden reagieren. Wie die Fragen andeuten, ist dies ein intransparenter Prozess.
Wenn der Arzt eine Hautreaktion bei den Behörden meldet, sollte er zeitnah ein adäquates Feedback seitens des Herstellerunternehmens erhalten. Dabei gibt es keine Informationen darüber, ob und wie dies in der Praxis erfolgt. Hinweise in der Literatur lassen vermuten, dass unerwünschte Nebenwirkungen bei Medizinprodukten in der Realität massiv unterdokumentiert werden (8, 9).
Kontaktallergien
Wenn Medizinprodukte immer länger an einer Stelle getragen oder wiederholt an dem gleichen Hautareal fixiert werden, dann bedeutet dies für die Patienten zunächst mehr Lebensqualität, sie müssen sich weniger darum kümmern, haben weniger Aufwand. Deutschland war eines der ersten Länder, in denen das iscCGM-System auf den Markt gekommen ist und von einer erheblichen Anzahl von Patienten genutzt wird. Die damit mögliche vergleichsweise lange Nutzungsdauer dieses Systems kann dazu führen, dass bei mehr Patienten Hautreaktionen auftreten. Es kommt zu Hautirritationen durch die lange Okklusion und das Schwitzen unter dem Pflaster, es kann zu kleinen Verletzungen der Haut beim Abnehmen des Pflasters kommen. Solche Irritationen sind unangenehm für die Patienten, aber sie treten nicht immer und nicht zu jeder Jahreszeit auf bzw. sind nicht immer gleich stark.
Ernsthafter und folgenreicher ist eine Kontaktallergie. Üblicherweise beginnt diese mit einem Juckreiz im Bereich des Pflasters. Die Symptome sind im Verlauf meist so stark, dass der Patient nach ein bis zwei Tagen das Medizinprodukt förmlich "abreißen" will. Im Bereich des Pflasters findet sich dann eine Rötung mit oft kleinster Bläschenbildung. Eine bakterielle Superinfektion kann komplizierend hinzukommen. Versuchen die Patienten, den stärksten Juckreiz durchzuhalten, und verwenden das Produkt weiter (weil sie von dessen Eigenschaften erheblich profitieren), kann es zu einer hämatogenen Streureaktion über den ganzen Körper kommen. Nach Entfernung des Pflasters heilt die Hautreaktion mithilfe kortisonhaltiger Cremes, die der Arzt verschreibt, üblicherweise innerhalb von wenigen Tagen ab. Zurück bleibt eine gewisse Verzweiflung und Enttäuschung, denn die Betroffenen wollen auf die Vorteile des Medizinprodukts eigentlich nicht verzichten. Wenn sie aber versuchen, nach einer mehr oder weniger langen Pause das Produkt wieder zu nutzen, treten die Symptome praktisch unmittelbar wieder auf. Dabei sind diese im Vergleich zu einer rein irritativen Dermatitis meist deutlich stärker ausgeprägt, treten bei jeder Anwendung auf und unabhängig davon, an welcher Hautstelle das Produkt angebracht wird.
Es ist bekannt, dass Patienten, die aufgrund verschiedener Erkrankungen einen längeren Kontakt mit Pflasterklebstoffen benötigen, wie beispielsweise Patienten mit einem künstlichen Darmausgang (Stoma) oder Patienten mit längerem postoperativem Verschluss, häufiger Pflasterallergien entwickeln (10, 11). Bei einem Patienten, der ein rtCGM-System nutzte, wurde eine solche Kontaktallergie beschrieben (12). In älteren Berichten wurden auch allergische Reaktionen auf die Pflaster von IIS berichtet (13, 14).
Gründe für die Entwicklung von Kontaktallergien
Zu Kontaktallergien kommt es nur, wenn es zu immer wiederkehrendem Kontakt zu einer bestimmten Substanz kommt. Dabei haben nicht alle Substanzen in unserer Umwelt die gleiche allergisierende Potenz; handelt es sich um eine Substanz, die stark sensibilisierend wirkt, dann ist das Risiko deutlich erhöht. In der stummen Sensibilisierungsphase werden in den Lymphknoten spezifische T-Zellen aktiviert, diese vermehren sich daraufhin und treten bei erneutem Allergenkontakt rasch in Aktion. Bringt der Patient aus seiner Vorgeschichte eine Allergie auf einen der Inhaltsstoffe des Pflasters mit, kann unter Umständen schon nach 24 bis 48 Stunden beim ersten Tragen einer Insulinpumpe oder eines rtCGM-/iscCGM-Systems eine solche Reaktion auftreten. Ansonsten dauert die Sensibilisierungsphase oft monatelang, in der der Anwender das Medizinprodukt ohne Probleme in dem hier genannten Sinne nutzen kann. Neben der sensibilisierenden Potenz des Inhaltsstoffs sind es die Menge und die Expositionszeit, die hierbei von Bedeutung sind. Weiterhin gibt es andere Faktoren, die für die Entwicklung einer Typ-4-Allergie prädisponieren, insbesondere spielen individuelle Aspekte eines Patienten eine entscheidende Rolle. Eine nichtintakte Hautbarriere scheint von Bedeutung zu sein. So sind Patienten mit Neurodermitis besonders anfällig für die Entwicklung einer Kontaktallergie (15). Darüber hinaus reagierten Kinder empfindlicher als Erwachsene, was auf ihre sensiblere Haut und noch flexiblere Reagibilität ihres Immunsystems zurückzuführen sein kann (16). Bisher gibt es nur wenige Untersuchungen dazu, ob Patienten mit Typ-1-Diabetes, vor allem Kinder mit dieser Erkrankung, ein erhöhtes Risiko aufweisen, eine Kontaktallergie auszubilden, als Menschen ohne diese Autoimmunerkrankung. In einer großen, retrospektiven Studie gab es eine inverse Beziehung zwischen allergischer Kontaktdermatitis und Typ-1-Diabetes, d. h. diese trat seltener auf (17). Dies passt zu den Ergebnissen einer anderen Studie, in der gezeigt wurde, dass bei Kindern mit Typ-1-Diabetes eine geringere Prävalenz von Atopiesymptomen vorliegt (18).
Kontaktallergien sind deshalb so fatal, weil eine solche Allergie lebenslang bestehen bleibt, bei wiederkehrendem Kontakt meist heftigere Reaktionen auftreten und es Kreuzreaktionen auf verwandte Stoffe gibt bzw. sie sich entwickeln können. Eine Kreuzreaktion entsteht vielfach im Verlauf der Anwendung und bedeutet konkret, dass ein Patient, der auf einen Inhaltsstoff in einem Pflaster allergisch reagiert, nach einiger Zeit auch ein Pflaster mit anderen verwandten Substanzen nicht mehr vertragen kann. Für die Patienten mit Diabetes kann dies konkret bedeuten, dass sie – bedingt durch die Kreuzreaktion – nicht nur mit einer Kontaktallergie auf das Pflaster eines bestimmten Medizinprodukts reagieren, sondern auch auf Pflaster anderer Medizinprodukte. Sie können dann z. B. IIS oder Patch-Pumpen generell nicht mehr verwenden, weil sie auch auf die Klebematerialien dieser Produkte allergisch reagieren! Für die betroffenen Patienten kann dies bedeuten, dass die Durchführung ihrer Diabetestherapie in der bisherigen Form unmöglich wird, weil die Nutzung von vielen Medizinprodukten nicht mehr möglich ist. Solche Patienten können auch von zukünftigen Entwicklungen, wie Systemen zur künstlichen Bauchspeicheldrüse, nicht mehr profitieren, zumindest so lang, wie diese die bisher üblichen Pflaster verwenden.
Acrylate in Pflasterklebstoffen
Die meisten Pflasterhersteller deklarieren die Bestandteile der Pflaster auf der Verpackung oder stellen diese Information auf ihren Internetseiten zur Verfügung. Diese Transparenz ist deshalb wichtig, weil Betroffene dann herausfinden können, welche Produkte sie meiden sollten. Durch solche Informationen und aus der medizinischen Literatur ist bekannt, dass heutzutage meistens Acrylatpolymere als Klebstoffe in den Pflastern verarbeitet werden. Eine Sensibilisierung auf Acrylate bei Kunststoff-IIS sowie auf Pflaster von Insulinpumpen wurden beschrieben (14). In einem aktuellen Fallbericht wurde Cyanacrylat in dem Klebepflaster eines rtCGM-Systems als Auslöser einer Kontaktallergie getestet (12).
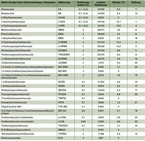
Ein Acrylatpolymer in Pflastern besteht meist aus drei unterschiedlichen Acrylaten. Bei der Polymerisation verschiedener Acrylate entstehen bzw. verbleiben immer Monomere, die bekannterweise hochallergen sind (19). Außerdem ist bekannt, dass manche Acrylate unterschiedlich stark allergisierend wirken (20). Der Hautarzt und Allergologe Dr. Roland Irion klassifiziert die sensibilisierende Potenz mit einem Ranking von 1 bis 10, mit 2-Hydroxyethylacrylat als Stufe 1 mit einer Sensibilisierung von 12,3 % (Tabelle 1) (21).
Ob unterschiedliche Herstellungsverfahren der Polymerisate bzw. die unterschiedliche Mischung der meist drei verschiedenen Acrylate die sensibilisierende Potenz veränderen, ist möglich, aber bisher nicht bekannt. Während Acrylate früher vielfach als hypoallergen bezeichnet wurden, wurden Acrylate selbst im Jahr 2012 von der American Contact Dermatitis Society (22) als "Contact Allergen of the Year" (Kontaktallergen des Jahres) bezeichnet. Insbesondere kritisch ist die Bereitschaft von Acrylaten, untereinander Kreuzallergien auszubilden (23) – wie oben erwähnt. Wie ausgeführt, bleibt eine Allergie auf Acrylate – wie jede Kontaktallergie – ebenfalls lebenslang bestehen und kann Konsequenzen für diverse andere Lebensbereiche haben, denn viele alltägliche Dinge beinhalten Acrylate, so z. B. Waschmittel und Sonnenschutzcremes.
Allergie auf die Klebstoffe im Pflaster oder am Medizinprodukt selbst?
Eine interessante Frage ist, ob die Reaktionen auf die Substanzen auftreten, mit denen das Pflaster auf der Haut klebt, oder auf die Substanzen, mit denen das Medizinprodukt auf dem Pflaster fixiert wird – diese können verschieden sein! Es gibt Hinweise darauf, dass nichtallergische Reaktionen auf Pflaster wesentlich häufiger (1 000-fach?) auftreten als wirkliche allergische Reaktionen und dass es notwendig ist, diese beiden Arten von Reaktionen klar zu differenzieren; dabei ist dies in der Praxis nicht trivial (24). Als Hinweis darauf, dass es die Befestigung des Medizinprodukts selbst auf dem Pflaster ist, welches allergische Reaktionen auslöst, können Beobachtungen gewertet werden, dass es nur im Bereich, wo die Patch-Pumpe (mylife OmniPod®) auf dem Pflaster aufsitzt, zu einer Reaktion kam und nicht im Randbereich des Pflasters. Ein anderer Patient berichtete, dass er das Pflaster entfernt hat vor der Nutzung eines Medizinprodukts, um ein anderes zu verwenden, und trotzdem nach einer kurzen Zeit eine allergische Reaktion zeigte, was als ein Durchdringen dieses Pflasters von Substanzen in dem Klebstoff an dem Medizinprodukt interpretiert werden kann. Dies würde bedeuten, dass es zu differenzieren gilt zwischen reinen Pflasterallergien, Allergien auf den Klebstoff zwischen Gerät und Pflaster und einer Irritationsdermatitis ("non-allergic"-Reaktion). Dabei können alle Reaktionen parallel zueinander vorkommen und es kann sein, dass die Klebstoffe zur Fixierung des Medizinprodukts auf dem Pflaster zunächst die allergische Reaktion auslösen und dann die Patienten im zweiten Schritt eine Allergie auf das Pflaster entwickeln, mit dem das Produkt auf der Haut fixiert wird. Wenn ein potentielles Antigen auf eine schon irritierte Haut aufgebracht wird, steigt die Wahrscheinlichkeit von allergischen Reaktionen auf dieses Antigen drastisch an (24).
Konkretes Vorgehen und Testung bei einem Verdacht auf eine Kontaktallergie
Wenn ein Patient eine Hautreaktion seinem Diabetologen/Diabetesberater zeigt, sollte dieser den Vertreiber/Hersteller des Medizinprodukts darüber informieren sowie die Behörden. Nur, wenn solche Meldungen erfolgen, kann das Ausmaß des Problems erkannt werden. Anfragen bei den Herstellern führen bisher zu der Standardaussage: "Nach unseren Daten treten keine oder nur wenige Hautreaktionen auf." Erst wenn die Tragweite des Problems für sie evident wird, werden die Hersteller Änderungen bei der Zusammensetzung des Klebepflasters angehen. Für die Hersteller sind solche Änderungen problematisch, da diese aus regulatorischer Sicht eine Neuzulassung bedingen können, wenn weitgehende Änderungen bei dem Medizinprodukt dadurch notwendig sind (z. B. bei der Tragedauer).
Zum Abklären einer Kontaktallergie sollten aus praktischer Sicht die Patienten bei einem Hautarzt, der allergologisch tätig ist, zum Durchführen eines Epikutantests vorgestellt werden (25, 26). Dadurch kann versucht werden, abzuklären, auf welche speziellen Substanzen die Patienten reagieren. Dabei sollte die Hautarztpraxis den speziellen Testblock "Kunststoffe/Klebstoffe gemäß der Deutschen Kontaktallergiegesellschaft" zur Verfügung haben, denn ein normaler Standardtest ist nicht aussagekräftig genug. Grundsätzlich kann jede Praxis einen solchen Testblock bestellen. Alternativ kann man sich direkt an das Allergiezentrum einer naheliegenden Hautklinik wenden. Einzelne Kliniken verwenden bei betroffenen Patienten einen "Zahnblock", da Zahnärzte häufig mit Acrylaten arbeiten und Kontaktallergien in diesem Zusammenhang nicht selten auftreten.
Ein negatives Ergebnis bei solch einer Testung schließt eine Allergie gegen Acrylate allerdings nicht aus, da in diesen Testblöcken nicht alle Acrylate enthalten sind. Deshalb sollte vorher versucht werden, Informationen über die in dem Pflaster enthaltenen Acrylate beim Herstellerunternehmen zu bekommen. Allerdings liegen den Herstellerunternehmen der Medizinprodukte Informationen zu den Einzelsubstanzen der Pflaster (die sie von einem anderen Hersteller beziehen) wohl häufig nicht vor. In diesem Fall kann es notwendig sein, direkt das zuliefernde Pflasterunternehmen zu kontaktieren; nach unseren eigenen Erfahrungen waren diese bisher ausgesprochen hilfsbereit.
Es gilt, vor "prophetischen" Testungen zu warnen! Eine Testung sollte nie ohne eine eindeutige Symptomatik gemacht werden, also nur, wenn ein dringender Verdacht auf eine Kontaktallergie vorliegt. Zum einen schließt ein (anfänglich) negatives Ergebnis nicht aus, dass z. B. das Pumpenpflaster in einem Jahr nicht mehr vertragen wird, zum anderen kann durch die Epikutantestung selbst eine Sensibilisierung induziert werden! Daher werden bei Kindern im Allgemeinen solche Tests nicht durchgeführt. Dabei gibt es keine festgelegte Altersbeschränkung, aber ob eine Testung sinnvoll ist – dies muss im Einzelfall mit dem Hautarzt/Allergologen besprochen und individuell entschieden werden.
Trotz dieser limitierenden Faktoren sollte bei Verdacht auf eine Kontaktallergie eine Testung durchgeführt werden, denn dann ist – falls der Stoff in dem Testblock enthalten ist – ein falsch negatives Ergebnis nahezu ausgeschlossen. Idealerweise würden in Zukunft in ausgewiesenen Allergiezentren Daten zu solchen Fällen zentral gesammelt, um Auslöser von Kontaktallergien besser und rascher identifizieren zu können.
Therapie bzw. Vermeiden von Hautreaktionen
Derzeit gibt es leider nur eingeschränkte Optionen, die verschiedenen Medizinprodukte für die Diabetestherapie weiterzunutzen, wenn eine Kontaktallergie sich entwickelt hat. Eine vielfach empfohlene Option sind Hautschutzsprays, die vor Anbringen des Klebepflasters auf die Haut gesprüht werden. Allerdings handelt es sich bei den meisten Sprays um einen Acrylatfilm, so dass in Einzelfällen eine Kontaktallergie darauf schon besteht bzw. sich bildet. Außerdem kommt es in relativ kurzer Zeit hier zu einer Penetration der Kontaktallergene durch diesen Film (s. o.). Es kann aber sein, dass dadurch eine irritative Dermatitis verhindert wird.
Viele betroffene Patienten (und Hinweise im Internet) berichten über ihre diversen Versuche, durch Kombination mit anderen Pflastern unter dem des Medizinprodukts eine Hautreaktion zu vermeiden. Einige Patienten raten dazu, die Desinfektion vor dem Anbringen wegzulassen. Aus medizinischer Sicht darf dazu nicht geraten werden. Eine Hautirritation kann dadurch möglicherweise positiv beeinflusst werden, eine bereits vorhandene Kontaktallergie aber nicht aufgehalten werden. Weiter werden z. B. Kinesiotapes, Tegaderm®, Blasenpflaster und viele andere Produkte empfohlen. Meistens enthalten diese "Unterpflaster" jedoch auch Acrylate, so dass es wiederum zu einer Allergie bzw. Kreuzallergie kommen kann. Ein Schutzpflaster, das unter dem jeweiligen Pflaster angebracht wird, sollte noch weitere Anforderungen erfüllen: Je nachdem, ob es die Diffusion eines Allergens 3 oder 14 Tage abhalten muss, muss es eine gewisse Dicke haben und darf nicht permeabel für das Kontaktallergen sein. Gute Erfolge werden mit Stomapflastern berichtet (z. B. Stomahesive® Hautschutzplatte des Unternehmens ConvaTec). Diese Idee entwickelten eine Krankenschwester, die u. a. Patienten mit Stoma versorgt, und der Leiter der Diabetologie aus dem Klinikum Leverkusen: Die Patienten stanzen z. B. für das iscCGM-System hierfür mittig ein Loch durch dieses Pflaster, durch welches dann der Messfühler geht. Es gilt zu beachten, dass der Messsensor wegen der Dicke der Unterplatte nicht so tief in die Haut eindringt, wie er eigentlich sollte, um eine zuverlässige Messung zu gewährleisten. Sowohl die Unterplatte als auch das Pflaster des Messsystems "kleben" in dieser Sandwichmethode gut. Es empfiehlt sich aber das Tragen einer Armbinde oder eines Schweißbands über dieser Konstruktion, um eine ausreichende mechanische Stabilität zu erreichen. Andere Empfehlungen sind Silikonpflaster (z. B. Biatain® Silikonpflaster des Unternehmens Coloplast). Dabei gilt es, solche Lösungen als Notlösungen zu betrachten, da diese nicht systematisch in klinischen Studien getestet wurden.
Zusammenfassung
Das Interesse von Patienten und Diabetologen/Diabetesteams an der Nutzung von technischen Systemen ist ausgesprochen hoch und wird aller Voraussicht nach in Zukunft deutlich weiter ansteigen. Bedingt durch die steigende Nutzungsdauer und -intensität solcher Medizinprodukte (dabei werden vielfach mehrere Produkte parallel genutzt) kommt es vermutlich zu einem häufigeren Auftreten von Kontaktallergien sowie von Kreuzallergien. Perspektivisch ist deshalb das Thema Hautreaktionen von hoher Relevanz. Bedingt durch die damit verbundenen erheblichen Schwierigkeiten bei der praktischen Durchführung der Diabetestherapie bedarf dieses Thema dringend mehr Aufmerksamkeit, sowohl hinsichtlich des Bedarfs an belastbaren Informationen darüber, in welchem Ausmaß diese Problematik in Wirklichkeit auftritt, als auch an Möglichkeiten, solche Probleme zu vermeiden. So gibt es acrylatfreie Klebstoffe, z. B. auf Silikonbasis, oder andere Befestigungsmöglichkeiten.
Interessenkonflikte: Stefanie Kamann hat eine Praxis für Dermatologie und Allergologie in Feldafing, Deutschland. Sie ist dermatologische Fachberaterin für Heine Optotechniques.
Lutz Heinemann ist am Profil Institut für Stoffwechselforschung, Neuss, und dem Profil Institute für Clinical Research, San Diego, USA, beteiligt. Er ist Berater für eine Reihe von Unternehmen, die für die Behandlung von Diabetes neue diagnostische und therapeutische Optionen entwickeln.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2016; 26 (6) Seite 368-373