Eine internationale Forschungskooperation unter Beteiligung des Leibniz-Forschungsinstituts für Molekulare Pharmakologie (FMP) in Berlin hat neuartige fluoreszierende Marker entwickelt, die erstmals präzise nachzeichnen, wie moderne Wirkstoffe wie Tirzepatid durch Körper und Gehirn wandern. Mit dieser Methode lassen sich spezifische Zielzellen identifizieren, die an Insulinfreisetzung und Sättigungsregulation beteiligt sind. Der Ansatz eröffnet neue Perspektiven für die Weiterentwicklung von Therapien gegen Diabetes und Adipositas.
Substanzen wie Semaglutid (Ozempic/Wegovy) und Tirzepatid (Mounjaro/Zepbound) gehören inzwischen zum festen Bestandteil der Behandlung von Diabetes und schwerer Adipositas. Besonders Tirzepatid wirkt als dualer Agonist gleichzeitig auf zwei Rezeptoren: den GLP-1-Rezeptor (Glucagon-Like Peptide-1) und den GIP-Rezeptor (Glucose-dependent Insulinotropic Polypeptide).
Ein Team um Johannes Broichhagen (Leibniz-FMP), David Hodson (University of Oxford) und Anne de Bray (University of Birmingham) hat nun erstmals sichtbar gemacht, wie Tirzepatid seine Zielstrukturen erreicht. Die in Nature Metabolism veröffentlichten Ergebnisse erlauben neue Rückschlüsse auf die Mechanismen der Wirkstoffe. „Durch die Beschreibung der Zielzellen für duale Agonisten können wir besser verstehen, wie sie ihre Wirkung entfalten“, erklärt Hodson.
daLUXendins als neuartige Schlüsseltechnologie
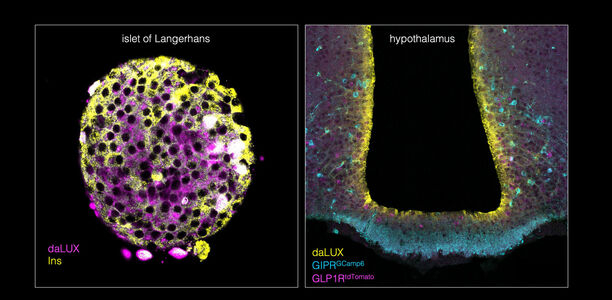
Die Arbeitsgruppe entwickelte spezielle fluoreszierende Marker, sogenannte dual agonist LUXendins (daLUXendins). Diese kombinieren Fluorophore so, dass GLP-1R- und GIPR-Rezeptoren gleichzeitig in lebenden Zellen und Geweben sichtbar werden. Damit lassen sich bislang unbeantwortete Fragen zur Wirkweise adressieren.
Bisherige Verfahren wie Antikörperfärbungen stoßen an Grenzen: Sie sind oft unzureichend validiert oder nicht gegen spezifische Proteine verfügbar. Vor allem geben sie keine Hinweise auf die Dynamik der Medikamente. „Uns interessiert vor allem die Dynamik der Peptide“, betont Broichhagen.
Mit den neuen Markern konnten die Forschenden zeigen, dass Tirzepatid vor allem Betazellen der Bauchspeicheldrüse erreicht, daneben aber auch Alpha- und Deltazellen. Zudem gelang der Nachweis, dass der Wirkstoff in zentrale Hirnregionen vordringt, die Appetit und Stoffwechsel steuern. Eine besondere Entdeckung war die Markierung von Tanyzyten – spezialisierten Zellen, die den Stoffwechsel überwachen und Signale an essrelevante Hirnzentren weiterleiten.
Mittels superauflösender Mikroskopie wurde zudem sichtbar, dass daLUXendin660 GLP-1R- und GIPR-Cluster in Inselzellen markiert. Diese Nanodomänen deuten darauf hin, dass Synergien nicht allein über summierte Signalwege entstehen, sondern durch räumlich organisierte Rezeptorstrukturen.
Grenzen der Studie und Ausblick auf zukünftige Forschung
Die Autor:innen verweisen auf Einschränkungen: Marker und Tirzepatid sind unterschiedliche Moleküle, zudem basieren viele Experimente noch auf Mausmodellen. Künftige Studien müssen daher klären, wie übertragbar die Ergebnisse auf den Menschen sind. Auch die Farbpalette der Marker soll erweitert werden, um komplexere Interaktionen sichtbar zu machen.
Die Studie liefert einen wichtigen Baustein für das Verständnis, warum duale Agonisten so erfolgreich wirken – und öffnet zugleich neue Fragen: Welche Effekte ließen sich erzielen, wenn der Zugang ins Gehirn gezielt verbessert würde? Und wie könnten neuartige triple Agonisten, die zusätzlich auf den Glukagon-Rezeptor wirken, das Therapiespektrum erweitern?
Redaktion diabetologie-online
mit Materialien des Leibniz-Forschungsinstituts für Molekulare Pharmakologie (FMP)