Eine angeborene Störung des Fettstoffwechsels kann augenscheinlich zu einer chronischen Überreaktion des Immunsystems führen. Zu diesem Schluss kommen Forscher der Universität Bonn in einer neuen Studie.
Bei manchen Menschen sorgt ein Gendefekt dafür, dass ihre Zellen eine ungewöhnliche Form von Fetten bilden. Die Folgen dieser sehr seltenen Störung sind schwerwiegend. So sterben bei manchen der Betroffenen mit der Zeit die Nervenzellen ab, die für die Weiterleitung von Schmerzen zuständig sind; andere verlieren ihr Gehör oder werden frühzeitig dement. Eine häufige Begleiterscheinung sind zudem Hautdefekte, die nur sehr schwer heilen oder sogar chronisch verlaufen.
Falscher Baustein sorgt für kristallähnliche Klümpchen
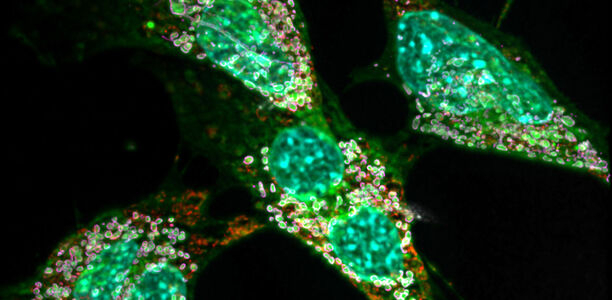
Seit einigen Jahren ist bekannt, dass die zugrundeliegenden Mutationen ein wichtiges Enzym im Fettstoffwechsel verändern. Das Enzym stellt normalerweise eine bestimmte Sorte von Fetten her. Aufgrund der Mutationen nutzt es dazu nun aber einen falschen Baustein. Dadurch entstehen in den Körperzellen große Mengen so genannter Deoxysphingolipide – rund zehnmal mehr als normal. „Diese exotischen Moleküle haben den Nachteil, dass sie nur sehr langsam abgebaut werden können“, erklärt Dr. Lars Kürschner vom LIMES („Life and Medical Sciences)-Institut der Universität Bonn. „In hoher Konzentration bilden sie zudem in den betroffenen Zellen kristallähnliche Klümpchen.“
Die Folgen sind für die Zellen alles andere als schön, wie der Privatdozent zusammen mit Kollegen bereits 2017 feststellte: Die Fettkristalle stören nämlich massiv die Funktion der Mitochondrien. Gerade Zelltypen mit einem hohen Energiebedarf können darunter so sehr leiden, dass sie zugrunde gehen. „Das betrifft vor allem die Nervenzellen“, sagt Kürschner. „Das ist auch der Grund für die gestörte Schmerzweiterleitung und die anderen neurologischen Symptome.“ In der aktuellen Arbeit konnten die Forscher solche Mitochondrien-Defekte auch in Bindegewebszellen von Mäusen nachweisen.
Dass sie zudem noch einem weiteren Effekt auf die Spur kamen, verdanken sie unter anderem einer Vorarbeit von Bonner Kollegen: Der Immunologe Prof. Dr. Eicke Latz vom Universitätsklinikum Bonn hatte vor einiger Zeit gezeigt, dass Cholesterinkristalle entzündliche Reaktionen hervorrufen können. „Wir haben uns daher gefragt, ob auch die Deoxysphingolipidkristalle Wirkungen auf das Immunsystem entfalten“, erklärt Kürschner.
Doppelte Dosis Fettkristalle resultiert in Aktivierung des Inflammasoms
Dazu untersuchten die Wissenschaftler die Makrophagen der Maus. Im Zuge der Krankheit produzieren Makrophagen – wie Nerven- oder Bindegewebszellen auch – große Mengen Deoxysphingolipide. Gleichzeitig nehmen sie in ihrer Funktion als körpereigene Müllfahrzeuge zusätzlich noch die abnormen Fette gestorbener Zellen auf. Sie erhalten also gewissermaßen die doppelte Dosis Fettkristalle.
Dieser Prozess stört in ihnen (wie auch in Neuronen und anderen Zellen) massiv die Funktion verschiedener Zellbestandteile, etwa die der Mitochondrien. Sie reagieren darauf, indem sie die geschädigten Kraftwerke abbauen, um aus deren Bestandteilen neue Mitochondrien herzustellen – ein Mechanismus, der als Autophagie bezeichnet wird. „Nervenzellen und Bindegewebszellen machen das zwar ebenfalls“, sagt der Erstautor der Studie Mario Lauterbach. „Makrophagen sind aber Immunzellen; sie verfügen daher über weitere Möglichkeiten, Schäden wahrzunehmen und auf sie zu reagieren. Eine davon ist, dass sie bei der Autophagie einen Molekülkomplex aktivieren, der Entzündungen befördert – das Inflammasom.“
Erkenntnisse möglicherweise auch für Diabetespatienten relevant
Das aktivierte Inflammasom sorgt seinerseits dafür, dass die Makrophage Entzündungsbotenstoffe ausschüttet. Dadurch werden weitere Immunzellen zur Hilfe gerufen, darunter andere Makrophagen, die diesen Effekt noch verstärken. „Eine Folge der Anhäufung dieser krankhaften Fette ist also eine sich manifestierende Entzündung“, erklärt Lauterbach. Möglicherweise sei diese für die schlecht heilenden Wunden verantwortlich, die man bei vielen Patienten beobachte. Die Wissenschaftler hoffen nun, dass sich diese Symptome durch Wirkstoffe behandeln lassen, welche die Autophagie hemmen. „Es gibt bereits einige Kandidaten, die momentan getestet werden“, betont Lars Kürschner.
Die Ergebnisse könnten zudem auch ein neues Licht auf ein weit häufigeres Leiden werfen: Bei Diabetes-Patienten ist die Deoxysphingolipid-Produktion in manchen Zellen ebenfalls erhöht; warum, ist noch weitgehend unbekannt. Und auch bei Diabetes beobachten Mediziner regelmäßig starke chronische Entzündungen, die zu den gravierenden Folgen der Erkrankung beitragen.
Beispiel für gute Zusammenarbeit
Der Erfolg der Studie sei auch auf die hervorragende Kooperation zwischen dem LIMES-Institut und dem Institut für angeborene Immunität auf dem Venusberg unter Leitung von Prof. Latz zurückzuführen, betont Kürschner. Beide Gruppen arbeiten unter anderem im Transregio-Sonderforschungsbereich 83 und im Exzellenzcluster ImmunoSensation der Universität Bonn seit Jahren intensiv zusammen. Ein weiterer Faktor sei die herausragende Ausstattung mit modernsten Mikroskopen und Analyse-Geräten, die sich durch den Erfolg in der Exzellenz-Initiative noch einmal verbessert habe und die in der universitären Landschaft ihres Gleichen suche.
Quelle: Pressemitteilung der Rheinischen Friedrich-Wilhelms-Universität Bonn