Die Ergebnisse der Phase-III-Studie VERTIS CV liegen nun vor: Der SGLT2- Hemmer Ertugliflozin (STEGLUJAN®), der in Deutschland als einzige fixe Kombination mit dem DPP4-Hemmer Sitagliptin verfügbar ist, erreichte den primären Endpunkt. Ertugliflozin zeigte sich bei Patienten mit Diabetes mellitus Typ 2 und atherosklerotisch bedingter kardiovaskulärer Erkrankung in der Wirkung auf schwere kardiovaskuläre Ereignisse (kardiovaskulären Tod, nichttödlichen Herzinfarkt oder nichttödlichen Schlaganfall) im Vergleich zu Placebo als nichtunterlegen.
In der VERTIS-CV-Studie waren mehr als 8.200 Patienten in 531 Zentren in 34 Ländern eingeschlossen worden. Die Ergebnisse der Studie wurden am 16. Juni 2020 auf der Jahrestagung der American Diabetes Association (ADA) virtuell präsentiert.
„Die VERTIS-CV-Ergebnisse ergänzen die zunehmende Evidenz bezüglich des klinischen Profils von Ertugliflozin einschließlich der Sicherheit bei Patienten mit einer kardiovaskulären Erkrankung in der Vorgeschichte“, sagte Studienleiter Prof. Dr. Christopher P. Cannon vom Brigham and Women’s Hospital, Harvard Medical School, Boston. „Die Ergebnisse weisen auf das Potenzial von Ertugliflozin zur Reduktion des Risikos einer Hospitalisierung wegen Herzinsuffizienz bei Patienten mit Diabetes mellitus Typ 2 und einer kardiovaskulären Erkrankung hin, wenngleich dies nicht Teil der hierarchischen Testsequenz war“, so der Kardiologe weiter.
„Wichtige Ergänzung zur Gesamtevidenz des kardiovaskulären Sicherheitsprofils“
Insgesamt trat der primäre Endpunkt schweres kardiovaskuläres Ereignis (MACE - Kombination aus kardiovaskulärem Tod, nichttödlichem Herzinfarkt oder nichttödlichem Schlaganfall) bei 11,9% (n=653) Patienten unter Ertugliflozin (5 mg und 15 mg/Tag) und bei 11,9% (n=327) der Patienten unter Placebo auf (Hazard-Ratio 0,97, 95,6%-Konfidenzintervall 0,85-1,11, p<0,001 für Nichtunterlegenheit).
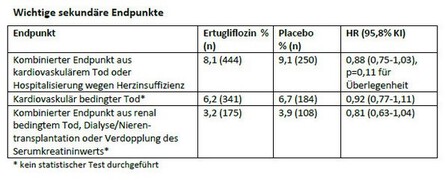
Die wichtigen sekundären Endpunkte, in denen eine Überlegenheit von Ertugliflozin im Vergleich zu Placebo gezeigt werden sollte, wurden nicht erreicht. Hierzu gehörten die Zeit bis zu
- einem ersten Ereignis von entweder kardiovaskulär bedingtem Tod oder Hospitalisierung wegen Herzinsuffizienz,
- kardiovaskulär bedingtem Tod allein,
- einem ersten Ereignis von entweder renal bedingtem Tod, Dialyse/Nierentransplantation oder Verdopplung des Serumkreatininwerts im Vergleich zum Ausgangswert.
Der vordefinierte Endpunkt Hospitalisierung wegen Herzinsuffizienz war zwar kein Bestandteil der hierarchischen Testsequenz, das Risiko hierfür wurde durch Ertugliflozin jedoch im Vergleich zu Placebo um 30% gesenkt (2,5% versus 3,6%, HR = 0,70, 95%-KI 0,54 – 0,90).
„Die Ergebnisse der VERTIS-CV-Studie sind eine bedeutende und wichtige Ergänzung zur Gesamtevidenz des kardiovaskulären Sicherheitsprofils von Ertugliflozin“, sagte Dr. Sam Engel, Vizepräsident Klinische Forschung Diabetes und Endokrinologie von MSD.
Die VERTIS-CV-Studie im Detail
VERTIS CV (NCT01986881) ist eine multizentrische prospektive, randomisierte, endpunkt-gesteuerte Placebo-kontrollierte Studie bei Patienten mit Diabetes mellitus Typ 2 und atherosklerotischer kardiovaskulärer Erkrankung. Primärer Endpunkt der Studie war es, die Nichtunterlegenheit von Ertugliflozin im Vergleich zu Placebo bezüglich der Zeit bis zum ersten MACE, definiert als kardiovaskulär bedingter Tod, nichttödlicher Herzinfarkt oder nichttödlicher Schlaganfall, zu zeigen.
Die Studie war zur Bewertung der kardiovaskulären Sicherheit (Nichtunterlegenheit) geplant worden, um die Vorgaben der amerikanischen Zulassungsbehörde Food and Drug Administration (FDA) bezüglich der Demonstration der kardiovaskulären Sicherheit neuer antihyperglykämisch wirkenden Substanzen vor und nach der Zulassung zu erfüllen. Vordefiniert war, dass die beiden Dosierungen von Ertugliflozin zur Bewertung der kardiovaskulären und renalen Outcomes gepoolt werden.
In die VERTIS CV wurden 8.246 erwachsene Patienten (mindestens 40 Jahre alt) mit Diabetes mellitus Typ 2 und atherosklerotischer kardiovaskulärer Erkrankung aufgenommen. Eingeschlossen wurden auch Patienten, die 65 Jahre und älter waren sowie Patienten mit Nierenfunktionsstörungen und Herzinsuffizienz. Mehr als 99% der Patienten hatten eine kardiovaskuläre Erkrankung, eine koronare Herzkrankheit lag bei 75,9%, eine zerebrovaskuläre Erkrankung bei 22,9%, eine periphere arterielle Erkrankung bei 18,7% und eine Herzinsuffizienz bei 23,7% der Patienten vor. In 531 Zentren in 34 Ländern erhielten die Patienten randomisiert Ertugliflozin 5 mg (n=2.752), Ertugliflozin 15 mg (n=2.747) oder Placebo (n=2.747) einmal täglich zusätzlich zu ihrer Standardtherapie. Sie wurden im Durchschnitt 3,5 Jahre nachbeobachtet und im Mittel 2,9 Jahre mit Ertugliflozin und 2,8 Jahre mit Placebo behandelt.
Wichtige Endpunkte
Zu den wichtigen sekundären Endpunkten gehörte die Überlegenheit von Ertugliflozin im Vergleich zu Placebo bzgl. der Zeit bis zu einem ersten Ereignis von entweder kardiovaskulär bedingtem Tod oder Hospitalisierung wegen Herzinsuffizienz, bis zu einem kardiovaskulär bedingten Tod allein und bzgl. der Zeit bis zu einem ersten Ereignis von entweder renal bedingtem Tod, Dialyse/Nierentransplantation oder Verdopplung des Serumkreatininwerts im Vergleich zum Ausgangswert. Um die Hypothesen des primären und der sekundären Endpunkte zu testen, wurde eine hierarchische Testsequenz für die gepoolten Daten der Ertugliflozin-Gruppen und die Daten der Placebo-Gruppe eingesetzt.
Zu den weiteren sekundären Endpunkten, die in der hierarchischen Testsequenz nicht berücksichtigt wurden, die jedoch im Protokoll vordefiniert waren, gehörten die Zeit bis zum ersten Auftreten eines MACE plus (MACE oder Hospitalisierung wegen instabiler Angina) tödlicher oder nichttödlicher Herzinfarkt, tödlicher oder nichttödlicher Schlaganfall, Hospitalisierung wegen Herzinsuffizienz, Einzelkomponenten der MACE und Gesamtsterblichkeit.
Keine neuen und bislang unbekannte unerwünschten Ereignisse
Die Gesamtinzidenz schwerer unerwünschter Ereignisse war ähnlich für Ertugliflozin 5 mg (34,9%), Ertugliflozin 15 mg (34,1%) und Placebo (36,1%). Zu Harnwegsinfektionen kam es bei 12,2% bzw. 12,0% der Patienten in den Ertugliflozin-5-mg- bzw. -15-mg-Gruppen und bei 10,2% der Patienten der Placebo-Gruppe (p < 0,05 im Vergleich mit Placebo). Eine Amputation war bei 2,1% bzw. 2,0% der Patienten in den Ertugliflozin-5-mg- bzw. -15-mg-Gruppen und bei 1,6% in der Placebo-Gruppe erforderlich. Eine diabetische Ketoazidose trat bei 0,3% bzw. 0,4% bei den Patienten der Ertugliflozin-5-mg- bzw. -15-mg-Gruppe und bei 0,1% der Placebo-Gruppe auf. Es wurde in keiner der drei Gruppen ein Fall einer Fournier-Gangrän beobachtet. Es zeigten sich auch keine Unterschiede in der Häufigkeit eines akuten Nierenversagens, von Hypovolämie, Frakturen oder symptomatischer Hypoglykämie.
Quelle: Pressemitteilung von MSD

