Basensupplementation kann die Gewichtsreduktion bei kohlenhydratreduzierter, proteinreicher Diät steigern.
Zusammenfassung
Einleitung: Mit kalorienreduzierter Ersatzkost kann Gewicht reduziert werden. Häufig verlangsamt sich jedoch die Gewichtsabnahme oder stagniert trotz fortgesetzter Kalorienreduktion. Ursächlich könnte ein Ungleichgewicht im Säure-Basen-Haushalt sein. In einer randomisierten, kontrollierten Studie wurde der Effekt von Basensupplementation auf die Gewichtsreduktion überprüft.
Einleitung
Die Ernährungsweise der Industrieländer, d. h. reich an Kohlenhydraterzeugnissen und tierischen Produkten, geht mit einer steigenden Prävalenz an Übergewicht und Adipositas einher. Tatsächlich sind in Deutschland mehr als die Hälfte aller Erwachsenen über 40 Jahre übergewichtig oder adipös (1). Daher sind Strategien zur effizienten Gewichtsreduktion notwendig. Aktuelle wissenschaftliche Studien weisen darauf hin, dass Low-Carb-Strategien am erfolgversprechendsten sind – je nach Form kann der Kohlenhydratanteil dabei theoretisch auch bis auf null reduziert sein (ketogene Diät) –, die die Normalisierung der erhöhten Insulinspiegel im Fokus haben (2). Kohlenhydrate werden in Glukose bzw. andere Einfachzucker aufgespalten, die die Ausschüttung von Insulin anregen. Insulin wiederum vermittelt die Glukoseaufnahme in den Muskel, wo durch die Versorgung der Muskelzellen mit Glukose der Proteinabbau gehemmt wird. Überschüssige Energie wird in Form von Triglyzeriden in Fettzellen gespeichert. Umgekehrt bedeutet dies, dass die Anwesenheit von Insulin die Lipolyse hemmt (3). Werden bei einer Ernährungsintervention die Kohlenhydrate minimiert, normalisieren sich nicht nur innerhalb weniger Tage die erhöhten Blutglukosespiegel; es sinken auch die Insulinspiegel ab und bei Patienten mit Typ-2-Diabetes kann es zu einer Remission der Erkrankung kommen (4). Gleichzeitig kann die Lipolyse starten, so dass es zu einer effektiven Gewichtsreduktion kommt.
Beim Fettabbau entstehen jedoch Ketosäuren, die eine Verschiebung ins Saure bewirken. Im Körper gibt es streng regulierte Puffersysteme, die z. B. den pH-Wert im Blut konstant bei 7,35 bis 7,45 halten und so vor "Übersäuerung" schützen. Ein Überschuss an sauren Stoffwechselprodukten wird u. a. über die Ausscheidung von Protonen über den Urin reguliert (5, 6). Dadurch wird der Urin saurer, der pH-Wert im Urin sinkt. Bis zu 70 % der Variabilität des Urin-pH-Werts werden durch die Nettosäureausscheidung über die Niere bedingt (5) und diese wird unmittelbar durch die Art der Nahrung beeinflusst. Je nach Zusammensetzung und Art ihrer Verstoffwechselung werden Lebensmittel als Säurebildner, neutral oder als Basenbildner gesehen. Grundsätzlich wäre anzunehmen, dass Lebensmittel mit einem höheren Chlorid-, Phosphat- und Schwefelgehalt eher säurebildend und solche mit höherem Natrium-, Kalium-, Magnesium- und Kalziumgehalt eher basisch wirken. Da die Absorptionsraten der einzelnen Nahrungsmittel und Ionen sich jedoch stark unterscheiden, ist die Einteilung komplexer (5). Zu den säurebildenden Lebensmitteln gehören u. a. Getreideprodukte, Teigwaren, Milch, Milchprodukte, Eier, Fisch, Fleisch und Wurstwaren. Neutral verhalten sich Fette und Öle sowie Getränke mit geringem Alkaligehalt. Basisch wirken hingegen z. B. Gemüse, Salate, Pilze, Obst, Kräuter und phosphatarme, mineralreiche Getränke (5).
In einer vorangegangenen Studie konnte gezeigt werden, dass durch den Einsatz einer kalorienreduzierten, kohlenhydratarmen, proteinreichen Ersatzkost (15 % Fett, 30 % Kohlenhydrate und 55 % Protein) im Rahmen einer Lebensstiländerung innerhalb von 26 Wochen eine signifikante Gewichtsreduktion von 6,7 ± 6,1 kg erreicht werden konnte (7). Interessanterweise verlangsamte sich jedoch die Gewichtsabnahme nach anfänglich schnellen Erfolgen (-6,2 ± 4,6 kg nach 12 Wochen) oder stoppte sogar ganz, obwohl die Kalorienreduktion weiter fortgesetzt wurde. Wir postulieren, dass ein Ungleichgewicht im Säure-Basen-Haushalt dabei eine ursächliche Rolle spielt, so dass zum Schutz der Zellen eine weitere Freisetzung von Ketosäuren verhindert wird und der Fettabbau stoppt. Bereits 1982 konnte gezeigt werden, dass bei einem 7-tägigen Fasten eine Basensupplementation (in Form von Natriumhydrogencarbonat) die Ketosäureproduktion und -ausscheidung stimuliert, während eine Säuresupplementation (in Form von Ammoniumchlorid) sie hemmt (8). Nach unserem Kenntnisstand sind derzeit keine Studien verfügbar, die den Einfluss von Basensupplementation auf die Gewichtsabnahme bei kohlenhydratreduzierter, proteinreicher Kost untersucht haben. In einer randomisierten, kontrollierten Studie mit übergewichtigen Erwachsenen wurde daher die Hypothese geprüft, ob eine Basensupplementation die Gewichtsreduktion während einer kalorienreduzierten, kohlenhydratarmen Diät verstärkt.
Material und Methoden
Studiendesign
Es handelt sich um eine einfach verblindete, kontrollierte Interventionsstudie mit zwei parallelen Gruppen. Der erste Teilnehmer wurde am 10.01.2015 rekrutiert, der letzte Teilnehmer beendete die Intervention am 01.02.2016. Die Studie wurde am Westdeutschen Diabetes- und Gesundheitszentrum (WDGZ) in Düsseldorf und entsprechend den Prinzipien der Deklaration von Helsinki (1964) sowie den Richtlinien für "Good Clinical Practice" durchgeführt. Das Studienprotokoll wurde von der Ärztekammer Nordrhein (Nr. 2014244) genehmigt und alle Teilnehmer gaben ihr schriftliches Einverständnis, bevor sie in die Studie aufgenommen wurden.
Studienpopulation
32 übergewichtige Erwachsene wurden durch das WDGZ rekrutiert. Einschlusskriterien waren ein Alter von 21 bis 65 Jahren und ein Body-Mass-Index (BMI) > 27 kg/m²; Ausschlusskriterien waren akute oder chronische Erkrankungen, eine Rauchentwöhnung in den letzten 3 Monaten oder geplant während der Studie, die Einnahme gewichtsbeeinflussender Medikamente, eine Schwangerschaft oder Stillen eines Kindes und bekannte Unverträglichkeiten gegen Bestandteile der Ersatzkost.
Randomisierung und Verblindung
Jeder Teilnehmer erhielt eine Studiennummer und für jede Studiennummer gab es, generiert durch den Studienkoordinator mit Hilfe einer elektronischen Zufallssortierung, in einem verschlossenen Umschlag (ausgehändigt durch die Studienschwester) die zufällige Zuteilung in Kontroll- oder Interventionsgruppe. Die Reihenfolge der Gruppenzuteilung war den Teilnehmern, der Studienschwester und den Studienärzten nicht bekannt. Die Daten wurden (bis auf die separat ausgewerteten Urin-pH-Werte) verblindet analysiert.
Interventionen
Beide Gruppen erhielten schriftliche Informationen zur Lebensstiländerung (Tipps für mehr Bewegung im Alltag, Informationen zu kohlenhydratarmer, proteinreicher Ernährung, Vorlagen zur Verlaufskontrolle der eigenen Werte), eine elektronische Waage und einen Schrittzähler (smartLab®, HMM Holding AG, Dossenheim) sowie kalorienreduzierte Ersatzkost (Almased® Vitalkost, Almased Wellness GmbH, Bienenbüttel). Die Teilnehmer wurden dazu angehalten, täglich ihr Gewicht und ihre Schrittzahl zu messen. Diese Werte wurden automatisch in ein personalisiertes Onlineportal transferiert, das nur vom Teilnehmer selbst und vom Studienzentrum einsehbar war. Die Teilnehmer ersetzten in der einen Woche alle drei Hauptmahlzeiten durch 1 g Ersatzkost pro kg Normalgewicht (Normalgewicht = Körpergröße in cm - 100) in 250 ml Wasser und nahmen täglich zusätzlich 45 g Öl (reich an ungesättigten und Omega-3-Fettsäuren) und 750 ml Gemüsesaft zu sich. Zwischenmahlzeiten waren nicht erlaubt. In den folgenden 3 Wochen wurden dann 2 Hauptmahlzeiten und bis zum Ende der 6-monatigen Interventionsphase 1 Hauptmahlzeit ersetzt. Die Teilnehmer der Interventionsgruppe nahmen zusätzlich 2 x täglich 4,1 g Basensupplement (BasenCitrate Pur®, Madena GmbH & Co. KG, Köln), aufgelöst in 250 ml Mineralwasser, zu sich und bestimmten morgens, nachmittags und abends mit Hilfe von pH-Teststreifen (BasenCitrate Pur® Urin-pH-Teststreifen, Madena GmbH & Co. KG, Köln) den Urin-pH-Wert.
Parameter
Alter, Geschlecht und Größe wurden bei Studienbeginn erfasst. Alle weiteren Werte wurden bei Studienbeginn, nach 4, 12 und 26 Wochen (Ende der Interventionsphase) sowie nach einem Jahr bestimmt. Mit Hilfe einer geeichten Körperanalysewaage (seca mBCA 515, seca GmbH & Co. KG, Hamburg) wurden Gewicht, Fettmasse, fettfreie Körpermasse, Muskelmasse, Ruheenergiebedarf und BMI ermittelt. Der Taillenumfang wurde an der breitesten Stelle und der Hüftumfang an der schmalsten Stelle gemessen. Die Blutdruckmessung erfolgte nach 5 Minuten Sitzen am rechten und linken Arm und der Mittelwert der beiden Messungen wurde berechnet. Zur Bestimmung von Triglyzeriden, Gesamt-, HDL (high density lipoprotein)- und LDL (low density lipoprotein)-Cholesterin, Nüchternglukose, Hämoglobin A1c (HbA1c) und Harnsäure wurde nach einer Nüchternphase von 10 bis 16 Stunden venöses Blut aus einer Unterarmvene entnommen.
Statistik
Der primäre Endpunkt war die "Estimated Treatment Difference" der Gewichtsreduktion (Interventionsgruppe vs. Kontrollgruppe) nach 26 Wochen. Zusätzlich und für die sekundären Endpunkte wurden innerhalb jeder Gruppe die Änderung über die Zeit (Differenz zum Wert bei Studienbeginn) mittels Friedman-Tests inklusive des "Dunn’s Multiple Comparison Tests" bestimmt und Unterschiede zwischen den Gruppen mittels Mann-Whitney-Tests analysiert. Dichotome Variablen wurden mittels "Fisher’s Exact Tests" verglichen. Für multiples Testen wurde nach Bonferroni korrigiert. In die Analysen wurden alle verfügbaren Werte der Teilnehmer (n = 32) eingeschlossen. Das Signifikanzlevel (α) lag bei 0,05. Die Daten wurden mittels GraphPad Prism Version 6.04 (GraphPad Software, San Diego, CA, USA) analysiert.
Ergebnisse
Signifikant stärkere Gewichtsreduktion in der Interventionsgruppe
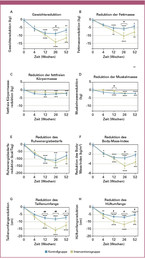
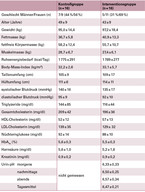
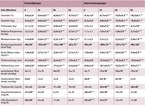
Bei Studienbeginn gab es zwischen den beiden Gruppen keine signifikanten Unterschiede hinsichtlich aller erhobener Parameter (Tabelle 1). Beide Gruppen konnten während der Interventionsphase signifikant Gewicht reduzieren (Trend je p < 0,0001) (Tabelle 2). In der Kontrollgruppe kam es jedoch nach der 12. Woche zu einer Stagnation, während die Teilnehmer der Interventionsgruppe weiter Gewicht reduzierten (Abbildung 1A), so dass am Ende der 6-monatigen Interventionsphase die Interventionsgruppe eine signifikant stärkere Reduktion des Gewichts (-13,5 ± 8,1 kg vs. -8,3 ± 4,8 kg; p = 0,038) erreicht hatte. Die Estimated Treatment Difference (95-%-Konfidenzintervall) lag bei 5,2 kg (0,5 – 9,9). In der 6-monatigen Nachbeobachtungsphase nahmen beide Gruppen wieder leicht an Gewicht zu, blieben jedoch signifikant unter Ausgangsniveau.
Effekte auf die Körperkomposition
Parallel zur Gewichtsreduktion kam es in beiden Gruppen während der Interventionsphase zu einer signifikanten Reduktion der Fettmasse, der fettfreien Körpermasse, der Muskelmasse, des Ruheenergiebedarfs, des BMIs sowie des Taillen- und Hüftumfangs (Tabelle 2). Die Interventionsgruppe hatte nach 26 Wochen signifikant stärker Fettmasse, Ruheenergiebedarf sowie BMI reduziert, während die Teilnehmer der Kontrollgruppe mehr Muskelmasse abgebaut hatten (p = 0,02 zum Zeitpunkt 12 Wochen) (Abbildung 1). Die Verringerung des Taillen- und Hüftumfangs war bereits nach 12 Wochen in der Interventionsgruppe signifikant stärker im Vergleich zur Kontrollgruppe und diese Unterschiede blieben bis zum Ende der 6-monatigen Nachbeobachtungsphase bestehen. Zusätzlich war in der Interventionsgruppe nach 12 Wochen eine signifikante Reduktion der Triglyzeride, des Gesamt- und des HDL-Cholesterins zu beobachten und nach 26 Wochen eine signifikante Reduktion des Blutdrucks. Diese Verbesserungen waren jedoch nicht statistisch signifikant unterschiedlich zu denen der Kontrollgruppe (Tabelle 2). Bei allen weiteren untersuchten Parametern trat keine statistisch signifikante Veränderung auf.
Einfluss auf Säure-Basen-Haushalt: Harnsäure, Kreatinin, Urin-pH
In der Kontrollgruppe blieben die Harnsäurespiegel im Serum über den gesamten Beobachtungszeitraum hinweg weitestgehend konstant (Abbildung 2A). In der Interventionsgruppe hingegen konnte zu Beginn der Intervention ein Anstieg der Harnsäurespiegel auf das Niveau der Kontrollgruppe beobachtet werden (von 5,2 ± 1,6 auf 5,6 ± 1,7 mg/dl). Nach der 4. Woche sanken die Harnsäurespiegel jedoch deutlich ab auf 4,9 ± 1,3 mg/dl nach 12 und 26 Wochen (p = 0,003 im Trend) und lagen am Ende der Nachbeobachtungszeit signifikant niedriger im Vergleich zur Kontrollgruppe (4,7 ± 1,1 mg/dl vs. 5,5 ± 0,9 mg/dl; p = 0,036). Während es keine statistisch signifikante Veränderung in der Kontrollgruppe gab, waren ab der 12. Woche die Kreatininspiegel im Serum in der Interventionsgruppe signifikant reduziert (von 0,9 ± 0,2 auf 0,8 ± 0,2 mg/dl; p = 0,001) (Abbildung 2B). Parallel dazu veränderte sich der im Urin gemessene pH-Wert (Abbildung 2C). Nach einem leichten pH-Anstieg zu Beginn der Interventionsphase (von 6,33 ± 0,33 auf 6,45 ± 0,35) nahm der pH-Wert im Morgenurin deutlich bis auf 6,25 ± 0,28 nach 26 Wochen ab (p = 0,009 im Trend), d. h. die Säurefreisetzung zu. Hingegen war in dem am Nachmittag gemessenen Urin ein signifikanter pH-Anstieg zu beobachten (von 6,50 ± 0,25 auf 6,70 ± 0,37 nach 26 Wochen; p = 0,04), während der abends im Urin gemessene pH-Wert relativ konstant blieb (nicht gezeigt). Im Tagesmittel war ein signifikanter pH-Anstieg nach 12 Wochen erkennbar (von 6,47 ± 0,21 auf 6,58 ± 0,30; p = 0,048). Insgesamt nahm die Variabilität des pH-Verlaufs im Laufe der Intervention signifikant zu, so dass sich die pH-Werte des Morgen- bzw. Nachmittagurins ab der 12. Woche signifikant unterschieden.
Diskussion
Dem Säure-Basen-Haushalt kommt bereits seit längerem stärkere Beachtung im Zusammenhang mit dem Entstehen von Übergewicht und metabolischen Erkrankungen zu. Nach unserem Kenntnisstand wurde bisher allerdings noch nicht der Umkehrschluss untersucht, nämlich dass eine Säurebelastung die Gewichtsabnahme hemmt. Die Beobachtung, dass trotz fortgeführter Kalorienreduktion die Gewichtsabnahme nach ca. 12 Wochen sich verlangsamt bzw. zum Stillstand kommt, lässt darauf schließen, dass möglicherweise die durch den Fettabbau entstehende Säurebelastung dabei eine ursächliche Rolle spielt. Die signifikant stärkere Gewichtsreduktion in der Interventionsgruppe bestätigt damit unsere Hypothese, dass Basensupplementation die Gewichtsreduktion bei kohlenhydratreduzierter, proteinreicher Kost verstärkt. Zwar stiegen nach dem Ende der Interventionsphase das Gewicht und weitere gewichtsbedingte Parameter tendenziell wieder an, dies ist jedoch dem Ende der Diätintervention geschuldet. Insgesamt blieben die Werte jedoch unter Ausgangsniveau. Bis auf die Visiten für die Kontrolluntersuchungen im Studienzentrum gab es keinen weiteren persönlichen Kontakt zu den Studienteilnehmern. Es scheint daher sinnvoll zu sein, die Teilnehmer auch über das Ende der Interventionsphase hinaus zu begleiten. In einer kürzlich publizierten Studie mit telemedizinischer Anschlussbegleitung konnten so die erzielten Erfolge langfristig aufrechterhalten werden (7).
Es ist beschrieben, dass bei länger andauernder "Übersäuerung" irgendwann die Mineralienvorräte im Körper so entleert sind, dass von dort keine zusätzlichen Mineralstoffe mehr abgegeben werden können. Die anfallenden Säuren können dann nicht mehr abgepuffert werden. Ist auch die Ausscheidekapazität der Niere erreicht, verbleiben die überschüssigen Säuren im Körper und es kommt zu Beeinträchtigungen im Stoffwechsel. Bereits bei Kindern führt ernährungsbedingte Säurebelastung zu einem Anstieg der Glukokortikoidspiegel (9), die ihrerseits mit erhöhten Blutglukosewerten assoziiert sind (10). Dies wäre eine mögliche Erklärung, wie die negativen Effekte der Säurebelastung physiologisch vermittelt werden. Eine leichte Azidose kann beispielsweise zu Insulinresistenz führen (11). In Studien wurde gezeigt, dass ein niedriger Urin-pH-Wert als Zeichen für ein Ungleichgewicht im Säure-Basen-Haushalt mit Insulinresistenz assoziiert ist (12). Entsprechend zeigte sich bei Untersuchungen an rund 1 500 Erwachsenen ohne Diabetes, dass Personen mit höherer Säurebelastung, aber niedrigem Mineralstoffgehalt auch höhere Insulinspiegel im Serum haben. Diese Korrelationen fielen bei Übergewichtigen besonders deutlich aus (13). In mehreren großen epidemiologischen Studien wurde gezeigt, dass niedrige Konzentrationen an Hydrogenkarbonat (14) bzw. Kalium (15) mit einem erhöhten Risiko für Typ-2-Diabetes einhergehen.
Ebenfalls bekannt ist, dass es bei kohlenhydratreduzierten, proteinreichen Diäten zwar zu einer signifikanten Gewichtsreduktion kommt, gleichzeitig aber das Problem besteht, dass vor allem tierische Proteinlieferanten eher säurebildend wirken. Um diese Säuren zu neutralisieren, bedient sich der Körper in der Regel zuerst an körpereigenen Reserven. Zur Konstanthaltung des Blut-pH-Werts werden Kalziumsalze aus dem Knochen gelöst. Im Blut gelöstes Hydrogenkarbonat reagiert mit Säure zu Kohlensäure, die sofort zu Wasser und Kohlendioxid zerfällt. Kohlendioxid wird abgeatmet; das frei gewordene Kalzium hingegen wird über den Urin ausgeschieden (11). An Tierversuchen mit Ratten wurde gezeigt, dass bei einer proteinreichen Ernährung ohne zusätzliche Mineralienzufuhr über 2 Monate u. a. der Urin saurer wurde und es zu Mineralienauslösung aus dem Knochen kam (16). Auch bei Menschen steigt bei einer kohlenhydratarmen, proteinreichen Diät die Säureausscheidung im Urin an, d. h. der pH-Wert und die Zitratkonzentration nahmen ab und es wurde mehr Kalzium ausgeschieden (17). Untersuchungen an rund 10 000 Erwachsenen zeigten, dass ein signifikanter Zusammenhang zwischen dem Hydrogenkarbonatgehalt im Blut und der Knochendichte besteht (17).
Der Nutzen und die Risiken von ketogenen Diäten, die eine starke Säurelast hervorrufen, werden derzeit wissenschaftlich kontrovers diskutiert (18). Es wäre daher ratsam, ketogene Diäten nur unter ärztlicher Aufsicht durchzuführen (dies gilt insbesondere für Personen mit eingeschränkter Nierenfunktion) oder wie in unserer Untersuchung auf Diäten mit einem reduzierten Kohlenhydratanteil zurückzugreifen. Im Rahmen unserer Studie kam es unter Basensupplementation ebenfalls zu Veränderungen im Urin-pH. Tatsächlich besteht unter normalen physiologischen Bedingungen eine große Variabilität im pH-Wert des Urins im Tagesverlauf: Am Morgen sollte die meiste Säure ausgeschieden werden, d. h. der Urin am sauersten sein (pH-Wert < 6,5), am Nachmittag basischer werden und gegen Abend wieder saurer (19). Dabei spiegelt der pH-Wert im Morgenurin den basalen Metabolismus wider, während der pH-Wert im Tagesverlauf die Säurelast unter Nahrungseinfluss abschätzt (20, 21). Dies wäre ein Hinweis darauf, dass die Basensupplementation zu verstärkter Säureausscheidung am Morgen und verminderter, ernährungsbedingter Säurelast am Nachmittag führt.
Unsere Daten zeigen, dass es in der Phase der intensiven Gewichtsreduktion in der Interventionsgruppe zu einer stärkeren Reduktion der Fettmasse, jedoch zu einem geringeren Muskelabbau kam. Diese Befunde werden durch Studien unterstützt, die gezeigt haben, dass bei Mineralstoffmangel es statt zu Fettreduktion nicht nur zu verstärktem Knochen-, sondern auch Muskelabbau kommt (11, 22), während durch Basensupplementation die Pufferkapazität des Bluts erhöht und der Körper vor Muskelabbau geschützt werden kann (23). Nach einem kurzzeitigen Anstiegstrend während der intensivsten Kalorienreduktion kam es in der Interventionsgruppe zu einer Reduktion der Harnsäure- und Kreatininspiegel. Eine plausible Erklärung liefern Hood und Tannen (6), die beschreiben, dass sich bei ketogener Diät für 2 Monate nach etwa 4 Wochen eine stabile Ketose entwickelt hat, in der der komplette Energiebedarf des Körpers über den Abbau der Fettreserven gedeckt wird, wodurch massiv Ketosäuren freigesetzt werden. Langfristig verringerten sich jedoch dort (6) wie auch in unserer Studie bei Basensupplementation die Harnsäurespiegel im Serum. Den gleichen Effekt konnten Saito et al. (24) durch die Gabe von Zitratpräparaten erreichen: Die Harnsäurespiegel im Serum bei Personen mit stark erhöhten Werten ≥ 7,0 mg/dl wurden signifikant gesenkt und die Nierenfunktion wurde verbessert.
Als Limitation unserer Daten ist die geringe Probandenzahl anzusehen. Mögliche Unterschiede zwischen den Gruppen wurden dadurch möglicherweise unterschätzt. Des Weiteren wurde in vielen Untersuchungen zum Urin-pH Sammelurin über 24 Stunden laborchemisch untersucht. Da der Nüchtern-Urin-pH-Wert signifikant mit dem 24-h-Sammelurin korreliert (21), haben in unserer Untersuchung nur die Probanden der Interventionsgruppe selbst morgens, nachmittags und abends den pH-Wert im Urin gemessen. Neben dem Ziel, den Teilnehmern die vermehrte Säureausscheidung am Morgen und die Neutralisierung des Urins am Nachmittag zu verdeutlichen, war dadurch jedoch eine differenzierte Betrachtung der Tagesschwankungen möglich. Die Probanden der Kontrollgruppe führten keine pH-Selbstmessung durch, da es ethisch nicht vertretbar war, bei nachgewiesenem Ungleichgewicht im Säure-Basen-Haushalt keine Basensupplementation vorzunehmen. Zusammenfassend lässt sich sagen, dass eine Basensupplementation signifikant die Gewichtsreduktion bei kohlenhydratreduzierter, proteinreicher Diät steigern kann.
Danksagung
Die Studie wurde gefördert durch die Gesellschaft von Freunden und Förderern der Heinrich-Heine-Universität Düsseldorf e. V.; die eingesetzten Materialien (Ersatzkost, Basensupplement, pH-Teststreifen und Mineralwasser) wurden freundlicherweise von der Post-Apotheke (Grevenbroich) kostenlos zur Verfügung gestellt.
- In der Kontrollgruppe stagnierte nach der 12. Woche die Gewichtsreduktion, die Teilnehmer der Interventionsgruppe reduzierten weiter Gewicht.
- Die Interventionsgruppe hatte nach 26 Wochen signifikant stärker Fettmasse, Ruheenergiebedarf sowie BMI reduziert, die Teilnehmer der Kontrollgruppe hatten mehr Muskelmasse abgebaut.
- In der Kontrollgruppe blieben die Harnsäurespiegel im Serum weitestgehend konstant. In der Interventionsgruppe stiegen zu Beginn die Harnsäurespiegel auf das Niveau der Kontrollgruppe, sanken nach der 4. Woche deutlich ab und lagen am Ende der Nachbeobachtungszeit signifikant niedriger.
- In der Interventionsgruppe war im Tagesmittel ein signifikanter pH-Anstieg nach 12 Wochen erkennbar, die pH-Werte des Morgen- bzw. Nachmittagurins unterschieden sich signifikant.
Manuskript eingegangen: 9. Mai 2017
Manuskript angenommen: 24. August 2017
Interessenkonflikte: Kerstin Kempf gibt an, dass sie Drittmittel/Projektunterstützungen des Unternehmens Almased Wellness erhalten hat.
Stephan Martin gibt an, dass er Angestellter ist beim Verbund katholischer Kliniken Düsseldorf und dass er Zuwendungen/Honorare und Drittmittel/Projektunterstützungen vom Unternehmen Almased erhalten hat.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2017; 26 (6) Seite 329-336