Bei der Herstellung eines neuen Medizinprodukts müssen neben der Nachfrage seitens der Patienten zahlreiche weitere Faktoren berücksichtigt werden. Der Hersteller muss sich mit Fragen der Designkontrolle, des Produktentwicklungsprozesses und des Fertigungsdesigns auseinandersetzen, von denen viele erst in einigen Jahren wichtig werden, wenn die Produktentwicklung bestimmte kritische Phasen auf dem Entwicklungsweg erreicht.
Aufgrund dieser zu berücksichtigenden Aspekte und zusätzlich zu den Präferenzen der Patienten sind wir der Meinung, dass der Hersteller bei der Herstellung eines neuen Medizinprodukts die letzten Dinge zuerst berücksichtigen muss.
Neue Medizinprodukte sind das Ergebnis der gemeinsamen Anstrengungen vieler verschiedener Menschen mit unterschiedlichen Fähigkeiten. In der Regel gebührt den Erfindern und Entwicklern die größte Anerkennung. Allerdings wird selbst die beste neue Technologie/das beste neue Konzept nicht auf den Markt kommen, wenn das Produkt nicht angemessen hergestellt werden kann.1,2 Die Frage ist, was "angemessen" bedeutet. In erster Linie geht es dabei um Kostenaspekte, die von vielen verschiedenen Faktoren wie dem gesamten adressierbaren Markt und den Zielmärkten, der Wettbewerbssituation, dem angestrebten Verkaufspreis, der erforderlichen Qualität und den Mengen beeinflusst werden. Aus einer allgemeineren Perspektive betrachtet scheint es, als würde die Herstellung als eine rein technische Aufgabe angesehen, die von begrenzter Bedeutung ist und einfach durchgeführt werden kann, sobald ein Produkt entwickelt wurde, was in der Regel mehrere Jahre dauert. Das "Scheitern" mehrerer Entwicklungen von Medizinprodukten in den letzten Jahren/Jahrzehnten zeigt jedoch die Mängel eines solchen Ansatzes auf. Wenn Aspekte der Herstellung nicht rechtzeitig bei der Konzeption und Entwicklung des Produkts berücksichtigt werden, kann dies Jahre vor dem Eintreten des Problems zum "Untergang" führen.
Dieser Leitartikel soll das Bewusstsein für die Bedeutung einer rechtzeitigen Berücksichtigung von Fertigungsaspekten in der frühen Produktentwicklungsphase eines Medizinprodukts schärfen. Interessanterweise ist dies nicht nur für Start-ups (die vielleicht als Erstes in den Sinn kommen) relevant, sondern auch für etablierte Medizinprodukteunternehmen. Diese könnten innovative Produkte von Start-ups übernehmen, ohne den Fertigungsaspekten ausreichend Beachtung zu schenken.
Designkontrolle
Aufsichtsbehörden wie beispielsweise die FDA legen großen Wert auf den Entwicklungsprozess von Medizinprodukten, um sicherzustellen, dass diese in einem kontrollierten Prozess entworfen und entwickelt werden und dass ihre Qualität und Verwendbarkeit ausreichend sind und kein Risiko für die Anwender darstellen. In den "FDA-Leitlinien zur Designkontrolle für Hersteller von Medizinprodukten" wird die wirksame Umsetzung von Designkontrollen ausführlich beschrieben.3 (Abbildung 1). Kurz gesagt werden Anforderungen von verschiedenen Interessengruppen entwickelt und ein Produkt wird so entworfen und entwickelt, dass es diese Anforderungen erfüllt. Das Design wird dann bewertet, in die Produktion übertragen und das Produkt wird hergestellt und vermarktet.
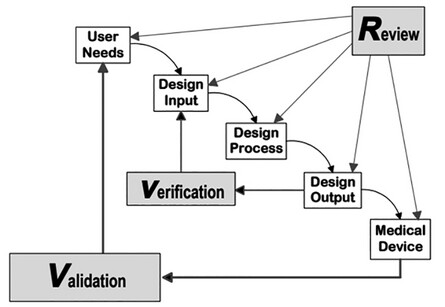
Abb. 1: FDA-Leitfaden zur Designkontrolle für Hersteller von Medizinprodukten [4].
Produktentwicklungsprozess
Hersteller von Medizinprodukten müssen die Anforderungen an die Designkontrolle in den Produktentwicklungsprozess implementieren, der Teil des Qualitätsmanagementsystems (QMS) der Organisation ist. Um die Produktzulassung zu erhalten, muss die Konformität durch objektive Nachweise belegt werden, dass diese Prozesse während der Produktentwicklung eingehalten wurden. Eine sehr schematische Übersicht über einen Produktentwicklungsprozess ist in Abbildung 2 dargestellt. Die Entwicklung und Verhandlung der Anforderungen der verschiedenen Interessengruppen ist eine wichtige Aktivität, die zu Beginn des Projekts stattfindet. Abbildung 2 Kundenanforderungen leiten sich aus unerfüllten Nutzerbedürfnissen ab und stellen sicher, dass das Produkt bei Kunden und Nutzern Anklang findet. Regulatorische Anforderungen bilden die Grundlage für die Konformität und damit für eine erfolgreiche spätere Produktzulassung. Geschäftliche Anforderungen stellen sicher, dass das Produkt während der routinemäßigen Produktion und Vermarktung rentabel ist. Die prognostizierten Mengen und Zielfertigungskosten sind wichtige Kennzahlen und bilden die Grundlage für die Fertigungsanforderungen. Um diese Zahlen zu schätzen, müssen Annahmen über wichtige Geschäftsziele wie Zielmarkt, Wettbewerbssituation, Verkaufspreis, erforderliche Qualität und Mengen für die Vermarktungsphase nach der Produkteinführung getroffen werden. Die prognostizierten Mengen und Herstellungskosten sind dann eine wichtige Grundlage für die Fertigungsanforderungen, die sicherstellen, dass das Design des Produkts einen Fertigungsprozess ermöglicht, der eine rentable Produktion zu den erforderlichen Kosten, Mengen und Qualitätsanforderungen erlaubt.
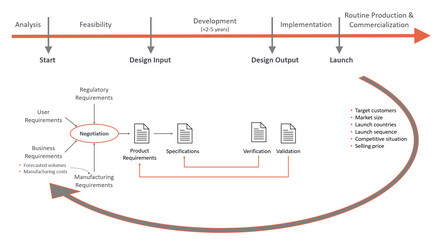
Abb. 2: Entwicklungsprozess eines Medizinproduktes.
Selbst wenn das Medizinprodukt mit inkrementellen, evolutionären agilen Methoden entwickelt wird, im Gegensatz zum traditionellen Wasserfallprozess in Abbildung 2, sind die Anforderungen an spätere Mengen und angestrebte Herstellungskosten bereits in den frühen Design-Sprints erforderlich. Eine Überarbeitung des Designs in späteren Sprints wäre zudem sehr kostspielig und zeitaufwendig.
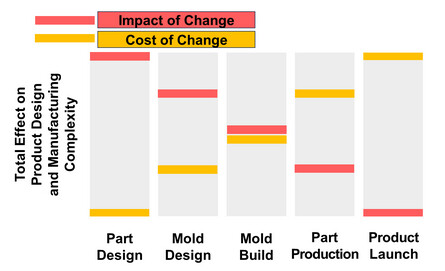
Abb. 3: Auswirkungen und Kosten von Änderungen auf das Produktdesign und die Komplexität der Fertigung in verschiedenen Phasen der Produktion und Markteinführung eines neuen Produkts. Abbildung adaptiert von David Klonoff [5].
Design für die Fertigung
Design für die Fertigung (Design for Manufacturing, DFM) ist die allgemeine technische Praxis, Geräte zu entwerfen, indem Produktdesign und die Entwicklung späterer Herstellprozesse in einer gemeinsamen Aktivität integriert werden, sodass sie leicht in der gewünschten Qualität und Menge und zu angemessenen Kosten hergestellt werden können. Andernfalls besteht das Risiko, dass das Produkt später für den Hersteller nicht rentabel ist. Das Produkt wird zu Beginn des Entwicklungsprozesses entworfen, nachdem sich alle Beteiligten auf die Produktanforderungen geeinigt haben. Mit anderen Worten: Zu Beginn der Produktentwicklung müssen Sie das Ende – die Routineproduktions- und Vermarktungsphase – im Blick haben, um die richtigen Designentscheidungen zu treffen. Dies ist besonders wichtig für große und kostensensible Märkte. Wenn dies nicht zum richtigen Zeitpunkt geschieht, kann ein perfekt funktionierendes Produkt, das den Kunden gefällt und von den Aufsichtsbehörden zugelassen wurde, möglicherweise nicht in den Mengen, der Qualität und zu den Kosten hergestellt werden, die erforderlich sind, um das Produkt rentabel zu machen – weil das Design des Produkts die erforderlichen Produktionsprozesse nicht unterstützt. Je später die Notwendigkeit einer Änderung des Produktdesigns im Produktentwicklungsprozess erkannt wird, desto teurer und zeitaufwändiger ist es, das Design des Produkts anzupassen. Änderungen in einer frühen Phase des Designs, die sogar große Auswirkungen haben können, verursachen in der Regel keine hohen Kosten und sind schnell umsetzbar. Die Beziehung zwischen den Auswirkungen und Kosten von Änderungen am Produktdesign und der Komplexität der Herstellung in verschiedenen Phasen der Produktion und Markteinführung eines neuen Produkts ist in Abbildung 3 dargestellt. Wenn zu viele kleine Änderungen oder eine wesentliche Änderung erforderlich sind, kann es sogar kostengünstiger sein, den Entwicklungsprozess von vorne zu beginnen.
Die Herausforderungen
Je nach Produkt kann die Entwicklungszeit zwischen zwei und fünf Jahren oder sogar länger betragen, und es ist nicht leicht vorherzusagen, wie sich der Markt und die Wettbewerbssituation in diesem Zeitraum entwickeln werden. Zumal sich auch der Markt für Diabetesversorgung immer schneller verändert. Es ist oft schwierig, bereits zu Beginn der Produktentwicklung die richtigen Annahmen über die prognostizierten Mengen und die angestrebten Herstellungskosten zu treffen. Darüber hinaus sind fundierte Fertigungserfahrungen erforderlich, um die richtigen Designentscheidungen zu treffen, und Produktions-Know-how gehört naturgemäß nicht zu den typischen Kompetenzen eines Start-ups. Die Komplexität der Fertigung kann je nach Produktionsvolumen eines bestimmten Geräts (geringe Stückzahlen vs. hohe Stückzahlen) und der Art des Geräts (Geräte zur kontinuierlichen Glukoseüberwachung, Insulinpumpen, Infusionssets, Patch-Pumpen, Insulinpens) unterschiedlich sein.
Start-ups konzentrieren sich oft auf die Herausforderungen der Gegenwart. Sie leisten hervorragende Arbeit bei der Ermittlung ungedeckter Nutzerbedürfnisse und der Suche nach innovativen technischen Lösungen, neigen jedoch dazu, die Herausforderungen der Zukunft, wie beispielsweise die spätere Herstellung des Produkts, aufzuschieben. Etablierte Hersteller von Medizinprodukten hingegen wissen aufgrund ihrer etablierten Prozesse zur Ermittlung und Verhandlung von Anforderungen, wie sie bestehende Geräte weiterentwickeln können. Allerdings tun sich diese großen Unternehmen mit innovativen Geräten schwer, da die Anforderungsexperten in organisatorischen Silos wie Vertrieb, Regulatory Affairs, Produktion, Qualität, Produktmanagement, Marketing und F&E isoliert sind und es manchmal schwierig ist, sie zusammenzubringen, um innovative Geräte zu verstehen und geeignete Anforderungen zu ermitteln und zu verhandeln.
Insulinpumpen und die GlucoWatch
In den letzten zehn Jahren haben mehrere Unternehmen versucht, Patch-Insulinpumpen zu entwickeln. Hierbei handelt es sich um technisch sehr komplexe Geräte mit hohen Anforderungen an Leistung und Sicherheit handelt. Miniaturisierung, Robustheit, geringe Toleranzen, Wasserdichtigkeit, Energieverwaltung, Insulinkompatibilität, Biokompatibilität, Sterilisation und mechanische Belastungen sind alles Aspekte, die berücksichtigt werden müssen. Die Anforderungen an eine Massenproduktion und niedrige Preise stellen zusätzliche Herausforderungen für das Produktdesign dar. Ein weiteres Beispiel ist die GlucoWatch. Dieses Gerät erfüllte zwar die allgemeinen Anforderungen an für die Entwicklung von Medizinprodukten und wurde im Hinblick auf unerfüllte Kundenwünsche entwickelt, wurde jedoch letzten Endes aufgrund von Design- und Performanceproblemen von den Patienten nur schlecht angenommen. Dies sind Beispiele für Start-ups, die innovative Lösungen für medizinische Geräte entwickelt haben, jedoch die Bedeutung des Produktdesigns für die Herstellbarkeit innerhalb eines realistischen Zeitraums nicht berücksichtigt haben. Wenn ein Start-up von einem etablierten Hersteller übernommen wird, ist eine notwendige, kostspielige und zeitaufwändige Neugestaltung für die Herstellbarkeit oft der Grund dafür, dass die angestrebten Markteinführungstermine verschoben werden müssen. Außerdem ist es häufig nicht zielführend, wenn zu viele Unternehmen an der Entwicklung eines Produktes beteiligt sind. Der Transfer von Know-how und Ausrüstung dauert immer länger, als man denkt. Außerdem machen unterschiedliche Kulturen, Denkweisen, Prozesse und Qualitätsmanagementsysteme den Transfer eines Produkts von einem Unternehmen zum anderen schwierig. Das "Not-invented-here"-Syndrom ist ein weiteres Hindernis für den Transfer eines Produkts von einem Unternehmen zum anderen.
Erschienen in: Diabetes-Forum, 2025; 37 (5) Seite 23-26


