Diabetes mellitus (DM) gilt unverändert als Treiber von Herz-Kreislauf-Erkrankungen, der die Prognose und Lebenszeit bestimmt. Bis zu drei Viertel der Patientinnen und Patienten sterben an Myokardinfarkt (MI) und Schlaganfall. Das Risiko von Menschen mit Typ-1- oder Typ-2-Diabetes (T1D/T2D) für kardiovaskuläre Erkrankungen ist zwei- bis vierfach erhöht, bei Frauen bis sechsfach. Menschen mit Diabetes und Herzerkrankung oder Schlaganfall haben eine schlechtere Prognose als Stoffwechselgesunde.
Eingeschränkte Leistungsfähigkeit – Strukturdefizite
Das Herz der Menschen mit Diabetes ist durch ein Missverhältnis von Energiebedarf und -angebot charakterisiert. Die Interaktion von gestörtem Stoffwechsel, Gefäßwand, Blutkomponenten und Myokard macht vulnerabel für stabile koronare Herzkrankheit (KHK), periphere arterielle Verschlusskrankheit (pAVK), Herzinsuffizienz (HF, Heart Failure), Vorhofflimmern (VHF) und plötzlichen Herztod (PHT). Vorhofflimmern gilt als besonders starker Risikofaktor für Schlaganfall. Herzinsuffizienz und plötzlicher Herztod können Gründe sein, warum die Mortalität bei Menschen mit Diabetes nach MI trotz besserer Therapien weiterhin hoch ist. Dies gilt sowohl für den Nicht-ST-Hebungsinfarkt (NSTEMI) als auch für den ST-Hebungsinfarkt (STEMI). Diabetes fördert eine Myokardfibrose. Durch den Umbau der Herzstruktur wird die hämodynamische Leistungsfähigkeit eingeschränkt. Die Ansammlung von Lipid- und Glukosestoffwechselprodukten verschlechtert zudem die Energiesituation des Herzens. Sie zieht auch direkte Veränderungen der myokardialen Binnenstruktur mit gleichzeitiger Leistungseinbuße nach sich. Die Akkumulation reaktiver Glukosemetabolite führt vor allem in frühen HF-Stadien durch Proteinveränderung und inflammatorische Prozesse mit zu Gewebeumbau und eingeschränkter Substratutilisation. Die kardiale autonome Neuropathie (CAN) als direkte Folge des Diabetes macht anfällig für Rhythmusstörungen und veränderte Symptomwahrnehmung, z. B. fehlenden Ischämieschmerz. Die Kombination der Atherosklerose großer Herzkranzgefäße mit chronischer Mikroangiopathie des Myokards erklärt die schlechte funktionelle Reserve ischämischer Myokardabschnitte. Generell wird die koronare Mikroangiopathie als eigenständige kardiale Manifestation diabetischer Spätkomplikation verstanden. Sie hat große prognostische Bedeutung für Patienten mit Herzinsuffizienz schon in frühen Stadien (HFpEF, NYHA I und II).
Koronare Herzkrankheit – Myokardinfarkt
Die Minderdurchblutung der Herzkranzgefäße resultiert aus dem Befall eines oder mehrerer Gefäße. Das 12-Kanal-EKG zählt zur Basisdiagnostik. Abhängig vom klinischen Beschwerdebild wird die Bestimmung laborchemischer Parameter (hs-Troponin, BNP, NT-proBNP) empfohlen. Bei KHK sollte die Indikation zur invasiven Koronarangiographie vom Vortestrisiko (Summe aus Klinik, Labor und nicht invasiven Untersuchungen wie Stressecho, Szintigraphie oder MRT) abhängig gemacht werden, um idealerweise die therapeutische Ausbeute durch gleichzeitige Intervention zu erhöhen. Dies kann durch Messung der fraktionellen Flussreserve und durch intravaskulären Ultraschall ergänzt werden. Mit neuen Verfahren (z. B. hochverstärkte Phonokardiographie, Koronarkalkbestimmung mit CT) sind Menschen mit Diabetes aufgrund ihrer Symptomarmut für eine "Rule-out"-Diagnostik geeignet. Bei akutem Myokardinfarkt wird im Regelfall invasiv vorgegangen. Beim stabil herzkranken Menschen mit Diabetes gibt es keine Präferenzen zwischen intensiv konservativem Vorgehen und perkutaner Koronarintervention (PCI) oder Koronar-Arterien-Bypass-Operation (CABG).
 Abb. 1: Diagnostischer Algorithmus Diabetes mellitus und Herz (ACS: akutes Koronarsyndrom; IGT: Impaired Glucose Tolerance (gestörte Glukosetoleranz); oGTT: oraler Glukosetoleranztest).
Abb. 1: Diagnostischer Algorithmus Diabetes mellitus und Herz (ACS: akutes Koronarsyndrom; IGT: Impaired Glucose Tolerance (gestörte Glukosetoleranz); oGTT: oraler Glukosetoleranztest).
Patienten beraten und Vorgehen gemeinsam abstimmen
Besonders bei herzkranken Menschen mit Diabetes mit ihrer unklaren klinischen Betroffenheitslage hat der behandelnde Arzt die Schlüsselrolle, seine Patientinnen und Patienten zu beraten und das weitere Vorgehen gemeinsam abzustimmen. Vor dem Hintergrund von ISCHEMIA sollte man sich bei Menschen mit Diabetes und einer wenig symptomatischen KHK nicht in therapeutischem Nihilismus verlieren. Die Therapie sollte eine Entscheidung sein, die das "Heart-Team" idealerweise gemeinsam mit Diabetologen trifft. Koronarverfahren wie Drug-Eluting-Stents (DES) sollten sich mit der Bypass-Chirurgie ergänzen. Vor allem während des Eingriffs und danach sollten normnahe Glukosewerte angestrebt werden. Hypoglykämien erhöhen das Risiko für perioperative Komplikationen!
Schlechte Prognose bei Herzinsuffizienz
Besonders schlecht ist die Prognose bei HF. Mit Diabetes ist die Sterblichkeit trotz normaler Koronarperfusion höher als ohne Diabetes. Die HF stellt auch ein Kardinalproblem bei Menschen mit T1D dar, die knapp dreimal häufiger davon betroffen sind als Menschen mit T2D. Erkrankungsdauer, metabolische Kontrolle und Komorbiditäten wie Niereninsuffizienz scheinen hier eine Rolle zu spielen. Generell muss davon ausgegangen werden, dass die Diagnose der Herzinsuffizienz bei DM viel zu selten gestellt und berücksichtigt wird. Der Zusammenhang von HF und DM lässt sich erklären durch die metabolische Gesamtstörung mit Hyperglykämie und Insulinresistenz, die Verstärkung des Wechselspiels zwischen Atherogenese und Thrombogenese sowie die veränderte myokardiale Binnenstruktur mit gleichzeitigem Verlust von metabolischer Flexibilität bei der Energiegewinnung im Herzen.
Klinisch meist unauffällig ist die diastolische Dysfunktion mit erhaltener linksventrikulärer Auswurfleistung (HFpEF: Heart Failure with preserved Ejection Fraction). Sie geht der systolischen Herzinsuffizienz (HFrEF: Heart Failure with reduced Ejection Fraction) oft voraus. Solche frühen Stadien können echokardiographisch nachgewiesen werden, ergänzt durch Bestimmung von NT-proBNP und invasive Hämodynamik-Messung.
Bessere Ergebnisse mit SGLT-2-Inhibitoren
Die HF sollte immer parallel zum Diabetes leitliniengerecht behandelt werden. Insbesondere ist darauf zu achten, dass der diuretische Effekt hoher Glukosegehalte unterhalb der Nierenschwelle mit Diuretika ausgeglichen wird. Aktuell werden SGLT-2-Inhibitoren als bevorzugte antidiabetische Strategie bei vorhandener Herzinsuffizienz empfohlen. Für HFrEF-Patienten verbessern sie Outcome und Symptomkontrolle, selbst ohne Diabetes (DAPA-HF-Studie und EMPEROR-Reduced-Studie). Die SGLT-2-Inhibitoren Dapagliflozin und Empagliflozin sind mittlerweile Bestandteile der Nationalen VersorgungsLeitlinie (NVL) Herzinsuffizienz.
Es besteht vorsichtiger Optimismus, dass sich das pharmakologische Prinzip auch bei diastolischer Dysfunktion mit erhaltener linksventrikulärer Auswurfleistung (HFpEF) als günstig erweist. Dies ist in der EMPEROR-Preserved-Studie für Empagliflozin prospektiv gezeigt und wurde in der DELIVER-Studie für Dapagliflozin bestätigt.
 Abb. 2: Vorgehen bei Herzinsuffizienz (mod. nach [7].
Abb. 2: Vorgehen bei Herzinsuffizienz (mod. nach [7].
Plötzlicher Herztod – kardiale autonome Neuropathie
Vielfach unterschätzt wird der PHT. Hinweise darauf gibt auch eine aktuelle Auswertung der Mortalitätsstatistik aus Dänemark. In ihr wurde der plötzliche Herztod als häufigste Todesursache bei Menschen mit T1D und T2D festgestellt. Bei Normierung der jährlichen Inzidenzraten der dänischen Daten ergibt sich ein Erkrankungsfaktor gegenüber Stoffwechselgesunden von 6 für T2D und knapp 10 für T1D mit einem signifikanten Altersgradienten.
Das Risiko für PHT bei Diabetes steigt vor allem mit reduzierter Ejektionsfraktion im linken Ventrikel (LVEF ≤ 35 %). Bei DM besteht auch eine höhere Inzidenz des Herztods trotz erhaltener LVEF. Dies könnte mit der Insulinresistenz bei Patienten zusammenhängen mit elektrischer Instabilität. Die kardiale autonome Neuropathie (CAN) gehört zu den beteiligten Mechanismen. Sie korreliert mit verminderter oder fehlender Durchblutung eines Herzmuskelbezirks (stille Ischämie) und ist assoziiert mit diastolischer Herzfunktionsstörung, verlängertem QT-Intervall, Blutdruck-"Non-Dipping" sowie linksventrikulärer Hypertrophie.
Asymptomatische kardiale Perfusionsstörungen und vor allem stumme Myokardinfarkte sind bei Menschen mit Diabetes signifikant häufiger. Zu frühen CAN-Anzeichen gehören eine verringerte Herzfrequenzvariabilität (HRV), eine in Ruhe erhöhte Herzfrequenz, Tachykardie, Belastungsintoleranz und orthostatische Hypotonie. Zudem fördert die Sympathikusaktivierung durch Hypoglykämien eine elektrische Instabilität und damit den Herztod.
Wichtig ist, dass bei Hochrisikopatienten auch an eine Myokardischämie gedacht wird. Die kardiale Medikation umfasst in der Regel ACE-Hemmer und Betablocker, ergänzend auch Ivabradin bei gleichzeitiger HF.
Vorhofflimmern rechtzeitig behandeln
VHF ist die häufigste Arrhythmie bei herzkranken Patienten mit T2D. Die Stoffwechselstörung, aber auch eine alleinige Insulinresistenz, gilt als unabhängiger Risikofaktor für VHF. Zwischen HbA1c und VHF-Risiko besteht eine lineare Beziehung. Mit VHF ist das Schlaganfallrisiko fünffach erhöht. Zu den wichtigsten Maßnahmen in der Behandlung gehört die Antikoagulation. Zum Abschätzen des Insultrisikos bei VHF dient der CHA2DS2-VASc-Score. Er gewichtet Schlaganfall, TIA, systemische Embolie, HF, DM, Hypertonie, hohes Alter und weibliches Geschlecht.
Therapeutisch dominieren inzwischen direkte orale Antikoagulanzien (DOAK). Vor allem die Rate der (oft tödlichen) intrazerebralen Massenblutungen lässt sich mit DOAK auf die Hälfte reduzieren. Vitamin-K-Antagonisten bleiben aber eine Option, wenn der INR-Wert erreicht wird. Auf das Blutungsrisiko muss geachtet werden. Bei VHF-Patienten mit symptomatischen Flimmerrezidiven unter der Therapie mit Antiarrhythmika ist die Katheterablation das Mittel der Wahl.
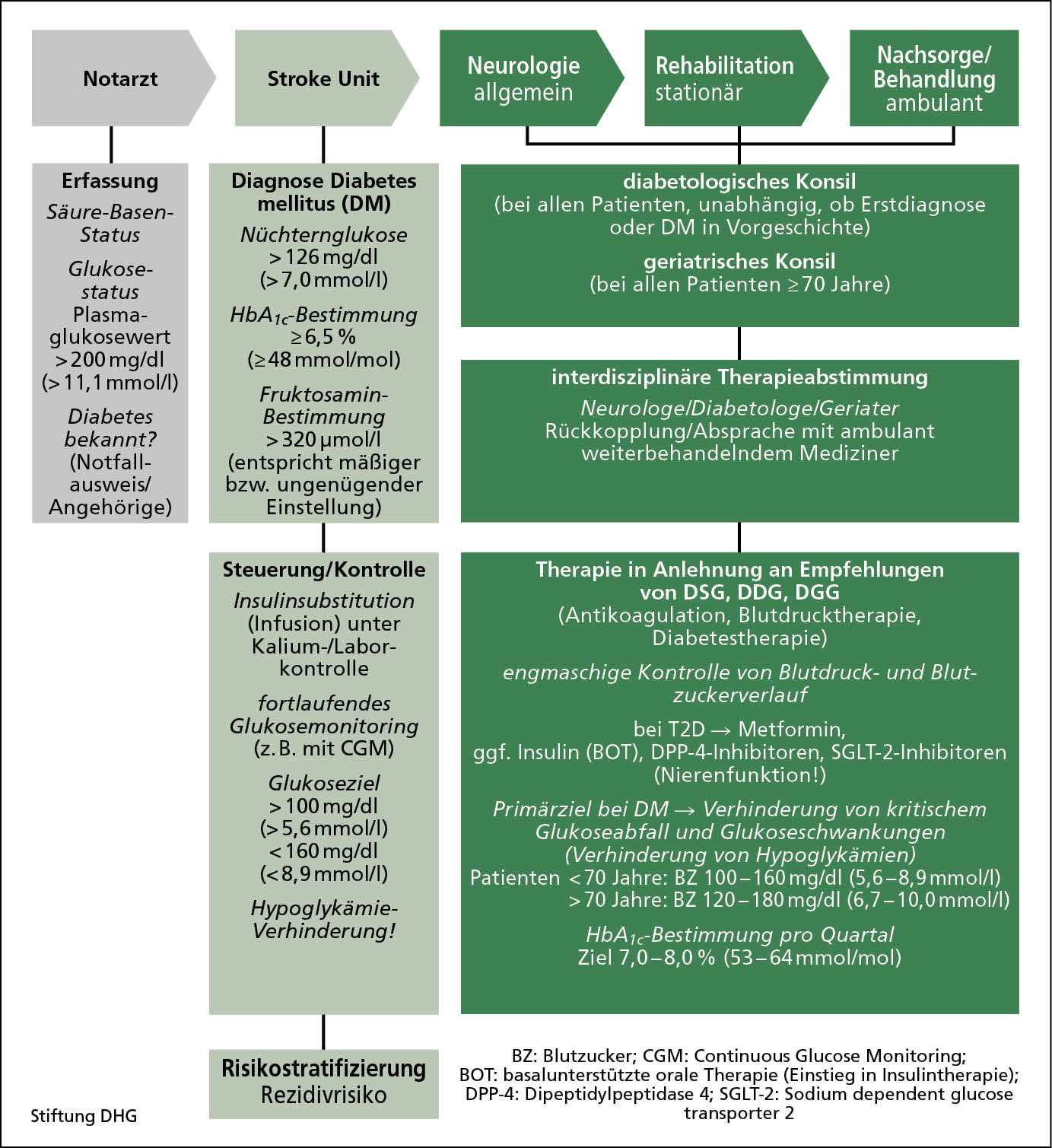 Abb. 3: Empfehlung für Versorgungsmanagement bei Diabetes mellitus und Schlaganfall.
Abb. 3: Empfehlung für Versorgungsmanagement bei Diabetes mellitus und Schlaganfall.
Demenz als Komplikationsdimension
Unter dem Begriff "emerging complications" wird zunehmend der Bereich der eingeschränkten psychomentalen Leistungsfähigkeit bei Menschen mit Diabetes verstanden ("Psychosom"). Es ist davon auszugehen, dass die hierunter zusammengefassten Diagnosen, insbesondere Demenz und kognitive Hirnleistungseinschränkungen, eine ähnliche Gewichtung haben. Damit beschleunigt DM den Verlauf der altersabhängigen Neurodegeneration. Umgekehrt kann von einer Berücksichtigung dieser Komplikationen und der Beeinflussbarkeit durch angemessenes metabolisches Management eine signifikante Prognoseverbesserung erwartet werden.
Diabetes erhöht Schlaganfallrisiko
Bis zu 25 % der Patienten mit Schlaganfall sind gleichzeitig von DM betroffen. Endotheliale Dysfunktion, Plaqueruptur, atherogene Dyslipidämie und Thrombophilie sind Mechanismen, die den Schlaganfall bei DM direkt und indirekt fördern. Hirnversorgende intra- und extrakranielle Arterien können betroffen sein. Die Makroangiopathie ist Ursache ischämischer Schlaganfälle, über die zerebrale Mikroangiopathie werden kognitive Störungen und senile Gangstörungen erklärbar. Ein kleiner lakunärer Infarkt an einer zentralen Stelle im Gehirn kann einen Insult mit großem Defizit auslösen. Kleinere Hirninfarkte schädigen vorwiegend die weiße Substanz, was Gang- und Gleichgewichtsstörungen und neurokognitive Einschränkungen verursacht.
Nach einem ischämischen Schlaganfall (einschließlich TIA) sollten Antihypertensiva, Statine, Thrombozytenaggregationshemmer und antidiabetische Medikation nicht abgesetzt werden, weil das prognostisch relevant ist. Bei den Antidiabetika scheinen nicht insulinotrope Wirkstoffe besonders günstig zu sein. Insgesamt ist die Datenlage zu antidiabetischer Therapie und Schlaganfallprognose heterogen. Mit Gliflozinen und Inkretinen konnte der Nutzen in Bezug auf kardiovaskulären Tod, nicht tödlichen Myokardinfarkt und nicht tödlichen Schlaganfall gezeigt werden. Die Daten zum Schlaganfall sind metaanalytisch für die Inkretinagonisten am besten.
Kardioprotektiver Effekt neuer Substanzen bei pAVK
Die pAVK bestimmt prognostisch das kardiovaskuläre Sterblichkeitsrisiko von Patienten mit DM. In der mittlerweile historischen UKPDS fand sich epidemiologisch in einem HbA1c-Bereich zwischen 5,5 und 10 % eine nahezu lineare Risikosteigerung (bis zu zehnfach) für den Endpunkt "Amputation oder Tod begründet durch pAVK". Hieraus wurde das Potenzial einer 43 %igen Risikoreduktion pro Prozentpunkt HbA1c-Absenkung errechnet.
Diese Kopplung von Hyperglykämie und pAVK-Endpunkten zeigte sich auch in der ARIC- und der EUCLID-Studie. Noch besteht allerdings Unsicherheit hinsichtlich der blutzuckersenkenden Strategie, da keine Studiendaten zu pAVK-bezogenen Endpunkten und Antidiabetika existieren. Diabetische Patientinnen und Patienten mit pAVK profitieren mit Blick auf ihre Gesamt-, kardiovaskuläre bzw. renale Prognose besonders von neuen antidiabetischen Substanzen, d. h. Inkretinmimetika und SGLT-2-Inhibitoren. Die neuen Substanzen sind aufgrund der Datenlage durchaus First-Line-Therapie neben Metformin geworden (vgl. LEADER-Trial, EMPA-REG-Outcome-Studie usw., ESC/EASD-Leitlinie 2019).
Es konnte gezeigt werden, dass der kardioprotektive Effekt auch für Patienten mit pAVK gilt – ein Therapiedurchbruch. Der kombinierte Endpunkt (3-Punkt-MACE) konnte in den Studienprogrammen zu beiden Substanzgruppen (SGLT-2-Inhibitoren: EMPA-REG Outcome, CANVAS, DECLARE; GLP-1-Rezeptoragonisten: LEADER, EXSCEL, HARMONY, REWIND, SUSTAIN-6, PIONEER) zwischen 10 und 26 % hochsignifikant reduziert werden. Ergänzend besserten sich renale Endpunkte (Canagliflozin: CREDENCE-Studie; Dapagliflozin: DAPA-CKD-Studie). SGLT-2-Hemmer haben das Potenzial, die Hospitalisierungsrate von Herzinsuffizienzpatienten zu reduzieren (DAPA-HF-Studie).
 Abb. 4: Signifikante Senkung kardiovaskulärer Ereignisse, definiert als kombinierter Endpunkt) in neuen Studien mit GLP-1-Rezeptoragonisten (ELIXA, EXSCEL, LEADER, SUSTAIN-6, PIONEER 6, HARMONY, REWIND) und SGLT-2-Inhibitoren (EMPA-REG, CANVAS, DECLARE) (mod. nach [27 – 29]).
Abb. 4: Signifikante Senkung kardiovaskulärer Ereignisse, definiert als kombinierter Endpunkt) in neuen Studien mit GLP-1-Rezeptoragonisten (ELIXA, EXSCEL, LEADER, SUSTAIN-6, PIONEER 6, HARMONY, REWIND) und SGLT-2-Inhibitoren (EMPA-REG, CANVAS, DECLARE) (mod. nach [27 – 29]).
Wichtig: konsequentes Management der Risikofaktoren
Es kommt vor allem auf ein stadiengerechtes Management der Risikofaktoren an, das in der Primärprävention (Gefäßbefall ohne Organschaden) beginnt und bis zur Tertiärprävention (Erhalt der Gefäßoffenheit durch Revaskularisation) reicht. Dabei wird ein zufriedenstellendes Ergebnis nicht durch eine einzelne Therapie erreicht. Alle Risikofaktoren (Diabetes, Hypertonie, Dyslipidämie, Adipositas, Rauchen, Alkohol, ungesunde Ernährung) müssen adressiert werden. Die verfügbaren bzw. zugelassenen Medikamente sollten unter Abwägung von Nutzen und Risiko berücksichtigt werden.
Die adaptive Blutzuckersenkung ist zentraler Bestandteil der Therapie. Nach einem Gefäßereignis sollten Menschen mit Diabetes aggressiver als Stoffwechselgesunde antithrombotisch versorgt werden. ADP-Rezeptorantagonisten, direkte Thrombin-Inhibitoren und Faktor-Xa-Hemmer sind im Allgemeinen wirkstärker und nebenwirkungsärmer. PCSK9-Inhibitoren können den LDL-Cholesterinwert um 50 bis 70 % senken. Mit ethylierter Eicosapentaensäure deutet sich ein weiteres antidyslipoproteinämisches Prinzip an, das eine hochsignifikante Endpunktreduktion mindestens in der Sekundärprävention auch für Menschen mit DM erwarten lässt. Bei Herzinfarkt gehört das Optimieren der myokardialen Substratflusssteuerung durch Normoglykämie zur Intensivbehandlung. Ähnliches gilt bei akutem Schlaganfall. Hypoglykämien sollten in jedem Fall verhindert werden.
Versorgung optimieren ist Herausforderung
Bei Patientinnen und Patienten mit DM besteht generell die Indikation, Medikamente mit organschützenden Eigenschaften früh einzusetzen. Mit einem konsequent individualisierten Behandlungsansatz kann die Prognose verbessert werden. Entscheidend ist vor allem, dass Patienten rechtzeitig diagnostiziert und angemessen behandelt werden. Noch immer werden Folgen am Herz- und Gefäßsystem zu spät entdeckt. Durch die verzögerte Diagnosestellung geht prognostisch wichtige Zeit verloren. Wenn bei fast 60 % der Koronarkranken und Insultpatienten Störungen im Glukosestoffwechsel vorhanden sind und oft schon ein manifester DM feststellbar ist, sollten Diabetologinnen und Diabetologen frühzeitig einbezogen werden. Die Forderung nach einer besseren Versorgung für Patientinnen und Patienten mit Diabetes und Gefäßproblematik durch alle beteiligten Fächer hat weiterhin Gültigkeit, ebenso, dass Prävention vor Intervention die leitende Strategie sein muss.
- Überlebensnachteil bei Menschen mit Diabetes – Gefäßereignisse laufen fulminanter ab.
- Bei invasiven Koronareingriffen Nutzen und Risiken abwägen – Entscheidung im "Heart-Team" mit Diabetologen treffen – Patienten einbeziehen.
- Hohe Sterblichkeit bei Herzinsuffizienz – je höher das HbA1c, desto schlechter die klinische Prognose.
- Risiko für plötzlichen Herztod nicht unterschätzen – bei hohem Risiko nach stummer Ischämie fahnden.
- Vorhofflimmern häufige Herzrhythmusstörung – Antikoagulation als Maßnahme der Schlaganfallprävention entscheidend!
- Periphere arterielle Verschlusskrankheit (pAVK) erhöht Sterblichkeitsrisiko – kardioprotektiver Effekt bei Inkretinmimetika und SGLT-2-Hemmern nachgewiesen.
- Alle prognostisch relevanten Risikofaktoren in Behandlung adressieren – Therapieziele individuell definieren.
- Mit Zusammenarbeit und Vernetzung von Spezialisten bessere Versorgung der Patientinnen und Patienten erreichen.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2024; 33 (3) Seite 140-145


