- was Insulin ist, woher es kommt und wie es im Körper wirkt,
- wie die postprandiale Freisetzung des Insulins beeinflusst wird,
- welche Probleme mit der subkutanen Insulintherapie verbunden sind,
- wie sich schnell wirkende Insulinanaloga von Normalinsulin unterscheiden,
- wie die Absorption von Insulin funktioniert,
- welche Besonderheiten es bei Basalinsulinen und Basalinsulinanaloga gibt und wann sie eingesetzt werden sollten.
Einleitung
Mit der Entdeckung des Insulins vor nunmehr fast 100 Jahren durch Banting und Best wurde erstmalig eine wirksame Therapie des Diabetes mellitus Typ 1 eingeführt und somit ein Überleben mit dieser Stoffwechselerkrankung ermöglicht. Neben Patienten mit einem Diabetes mellitus Typ 1 wurden im Lauf der Zeit auch zunehmend Patienten mit einem Diabetes mellitus Typ 2 auf eine Insulintherapie zur Blutzuckerkontrolle eingestellt. Auch wenn sich heute zahlreiche neue Medikamente zur Behandlung des Diabetes mellitus Typ 2 etabliert haben, bleibt die Insulintherapie auch für zahlreiche Patienten mit einem Diabetes mellitus Typ 2 ein zentraler Bestandteil ihrer pharmakologischen Therapie [Forst 2020]. Während Patienten mit einem Diabetes mellitus Typ 1 heute meist mit einer Basal-Bolus-Therapie oder einer Insulinpumpentherapie behandelt werden, basiert die Insulintherapie der Typ-2-Diabetiker primär meist auf einer Basalinsulintherapie in Kombination mit oralen Antidiabetika oder GLP-1-Rezeptoragonisten. Erst im weiteren Verlauf und bei Verlust der postprandialen Glukosekontrolle kommen dann komplexere Insulinregime durch Hinzunahme schnell wirksamer Insuline in Form von zusätzlichen prandialen Insulininjektionen oder der Verwendung von Mischinsulinen zum Einsatz.
Physiologische Insulinsekretion
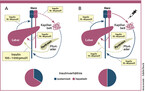
Unter physiologischen Bedingungen erfolgt die Insulinabgabe aus den Betazellen in Abhängigkeit von der aktuellen Glukosekonzentration. Die Aktivität des autonomen Nervensystems oder der Inkretine aus dem Darm können hierbei einen modulierenden Einfluss ausüben. Nach Exozytose des Insulins aus der Betazelle bewirkt es über parakrine Signale eine Suppression der Glukagonfreisetzung aus den benachbarten Alphazellen der Langerhans-Inseln. Der Anstieg der Insulinsekretion und der Abfall der Glukagonkonzentration bewirken einen Anstieg des Insulin/Glukagon-Quotienten im Pfortaderblut und damit eine Hemmung der hepatischen Glukosefreisetzung. Ein Großteil des Insulins wird bei der anschließenden Passage durch die Leber abgebaut und nur etwa 10 % des in der Pfortader anflutenden Insulins erreichen dann posthepatisch periphere Muskel- oder Fettzellen. Hierbei erfolgt ein Abfall der Insulinkonzentration aus dem interstitiellen Raum der Langerhans-Inseln über das Pfortaderblut in die periphere Zirkulation von etwa 100 : 10 : 1 [Unger 2012]. Dieser zentral-periphere oder hepato-periphere Insulinquotient hat eine entscheidende Bedeutung in der Regulation der Glukosehomöostase (Abb. 1). So führt eine Verdopplung der Insulinfreisetzung aus der Betazelle zu einer 80%igen Hemmung der Glukosefreisetzung aus der Leber, während die periphere Glukoseutilisation nur um ca. 20 % gesteigert wird [Matteucci 2015].
Subkutane Insulinsubstitution
Bis zum heutigen Tag basiert die Insulintherapie aus technischen Gründen weitestgehend auf einer subkutanen Insulingabe. Hierbei folgt die Aufnahme des Insulins aus dem subkutanen Depot in die Blutbahn nicht der aktuellen Glukosekonzentration, sondern unterliegt ausschließlich der Absorptionskinetik der jeweiligen Insulinformulierung. Hierbei entspricht die pharmakodynamische Wirkung des subkutan applizierten Insulins häufig nicht dem tatsächlichen Bedarf mit der Folge von hyper- oder hypoglykämischen Entgleisungen. Neben der glukoseunabhängigen Wirkung ist die gleichmäßige Verteilung des Insulins unter Verlust des zentral-peripheren Insulinquotienten als eine unphysiologische Limitation der subkutanen Insulintherapie zu betrachten (Abb. 1). Während eine unzureichende Suppression der Glukagonfreisetzung und eine zu geringe Suppression der hepatischen Glukosefreisetzung Hyperglykämien bedingen können, bedeuten zu hohe periphere Insulinspiegel eine Erhöhung des Hypoglykämierisikos insbesondere in der Nacht. Der Segen der Entdeckung der Insulintherapie für Patienten mit einem Diabetes mellitus vor nunmehr 100 Jahren wird daher leider bis zum heutigen Tag durch pharmakokinetische Grenzen einer subkutanen Insulinzufuhr limitiert.
- BIF – Basal Insulin Fc
- DEVOTE – Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events
- GIP – glukose-dependent insulinotropic polypeptide
- GLP – glucagon-like peptide
- HbA1c – Hämoglobin A1c
- KDH – Equilibrium-Konstanten zwischen Dimeren und Hexameren
- KMD Equilibrium-Konstanten zwischen Monomeren und Dimeren
- LADA – late autoimmune diabetes in adults
- NPH – Neutrales Protamin Hagedorn
- ORIGIN – Outcome Reduction with Initial Glargine Intervention
- SGLT – sodium-dependent glucose cotransporter
- U100/U300 – 100 bzw. 300 Einheiten pro Milliliter (E/ml)
Während die Insulinfreisetzung unter physiologischen Bedingungen streng in Abhängigkeit von der Glukosekonzentration erfolgt, besteht die Herausforderung in der subkutanen Insulinsubstitution darin, die Insulindosis prospektiv für die nächsten Stunden möglichst akkurat abzuschätzen und dann ins subkutane Gewebe in Form eines Depots zu applizieren. Einmal im subkutanen Gewebe deponiert, folgt die Wirkung des Insulins im Wesentlichen in Abhängigkeit von der gewählten Dosis und der für das jeweilige Insulinpräparat charakteristischen Pharmakokinetik. Hierbei kann die Absorptionskinetik des Insulins aus dem subkutanen Gewebe durch einen Wechsel der Injektionsstelle oder Schwankungen der lokalen Durchblutung im subkutanen Gewebe erheblich variieren und somit eine Ursache für massive Blutzuckerschwankungen von Tag zu Tag darstellen. Darüber hinaus kann der Insulinbedarf von Tag zu Tag durch Veränderungen der Insulinsensibilität durch körperliche Aktivität oder durch akute Erkrankungen erheblichen Schwankungen unterworfen sein. Eine unterschiedliche Absorption der intestinalen Glukoseaufnahme kann eine weitere Herausforderung bei der Wahl der korrekten Insulindosis darstellen. Aus dieser Vielzahl von potenziellen Einflussgrößen wird ersichtlich, dass es sich bei der subkutanen Insulintherapie um eine sehr komplexe Therapie handelt und eine dauerhaft normoglykämische Glukoseeinstellung mit den derzeitigen Möglichkeiten nur selten erreicht werden kann.
Insulinentwicklung seit 1922
Das Ziel in der Entwicklung neuer Insuline seit 1922 war es daher, die pharmakokinetischen Eigenschaften der subkutan verwendeten Insuline möglichst nahe an die Kinetik einer physiologischen Insulinsekretion unter Nüchtern- und postprandialen Bedingungen anzupassen. Grundsätzlich muss ein basaler Insulinbedarf zur Kontrolle der endogenen Glukosefreisetzung aus der Leber von einem prandialen Insulinbedarf zum Abdecken der intestinalen Glukoseaufnahme nach einer Mahlzeit abgegrenzt werden. Es wurden daher langsam wirkende Insuline mit einer möglichst flachen und langen Absorptionskinetik zum Abdecken des basalen Insulinbedarfs und schnell absorbierbare Insuline zur schnellen und zeitlich begrenzten Insulinabdeckung für die intestinale Glukoseaufnahme nach einer Mahlzeit angestrebt.
Während zunächst mit tierischen Insulinen, die aus Bauchspeicheldrüsen geschlachteter Tiere gewonnen wurden, die subkutane Insulintherapie durchgeführt wurde, gelang mit Einführung der gentechnischen Herstellung von Insulin in den 1980er-Jahren die Herstellung von Humaninsulin. Die gentechnische Herstellung von Insulin erlaubte auch die gezielte Modifikation der Aminosäuresequenz mit dem Ziel, die physiko-chemischen Eigenschaften der Insuline so zu modulieren, dass die pharmakokinetischen Profile nach der subkutanen Applikation dem physiologischen Insulinbedarf möglichst nahe kommen. Das Ziel war hierbei, Basalinsulinformulierungen mit langen und flachen Wirkprofilen sowie prandiale Insulinformulierungen mit einer beschleunigten Insulinabsorption aus dem subkutanen Gewebe zu entwickeln. So stehen heute zahlreiche unterschiedliche Insulinformulierungen zur basalen und prandialen Insulinsubstitution zur Verfügung.
Basalinsuline/Verzögerungsinsuline
Neben der Entwicklung über Zink- und NPH (neutrales Protamin Hagedorn)-Insuline wurden in den letzten Jahren mehrere Basalinsulinanaloga mit einer veränderten Aminosäuresequenz und einer dadurch bedingten verzögerten Absorption aus dem subkutanen Gewebe in die Therapie des Diabetes mellitus eingeführt. Einen Überblick über die derzeit in Europa zugelassenen Basalinsuline gibt Tabelle 1.
NPH-Insuline
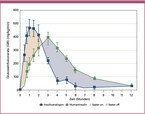
Als ältester Vertreter der Verzögerungsinsuline wird bei NPH-Insulinen (Protaphane®, Insuman Basal®, Huminsulin Basal®, Berlinsulin H Basal®) durch die Bindung des Insulins an das Eiweiß Protamin eine verzögerte Absorption aus dem subkutanen Fettgewebe erreicht. NPH-Insuline weisen eine Halbwertszeit von ca. 5 bis 10 Stunden und ein Wirkmaximum nach 5 bis 7 Stunden auf. Dieses Wirkmaximum und die relativ kurze Wirkdauer können mit Hypoglykämien in der Nacht und mit Insulinlücken am frühen Morgen und späten Nachmittag bei zweimal täglicher Injektion in Verbindung gebracht werden (Abb. 2). NPH-Insuline liegen in einer Suspension vor und müssen vor ihrer Anwendung sehr sorgfältig durchmischt werden. Selbst bei vorschriftsmäßiger Durchmischung der NPH-Insuline durch 20-faches Schwenken der Ampulle können NPH-Insuline eine erhebliche intraindividuelle pharmakokinetische Variabilität von bis zu 50 % aufweisen [Heise 2004].
Basalinsulinanaloga
Neben einer Reduktion der Insulininjektionen von zwei täglichen Injektionen auf eine tägliche Injektion sind bei diesen Insulinen das flachere Wirkprofil und eine Reduktion der pharmakokinetischen und pharmakodynamischen Variabilität im Vergleich zu NPH-Insulinen als wesentlicher Vorteil hervorzuheben. Moderne Basalinsulinanaloga machen ein Durchmischen der Insuline vor der Injektion überflüssig und erlauben eine deutlich reproduzierbarere Insulinwirkung mit einer verbesserten Glukosekontrolle und einer Reduktion des Hypoglykämierisikos im Vergleich zu NPH-Insulinen. Moderne Basalinsulinanaloga ermöglichen eine bessere Abdeckung des Insulinbedarfs über 24 Stunden mit einer Reduktion der Glukosevariabilität von Tag zu Tag.
Insulin glargin U 100
Als erstes lang wirkendes Insulinanalogon mit einer modifizierten Aminosäuresequenz hat Insulin glargin U 100 (Lantus®, Abasaglar®) über viele Jahre den Standard der Basalinsulintherapie für Patienten mit einem Diabetes mellitus Typ 1 und Typ 2 neu gesetzt. Insulin glargin ist charakterisiert durch die Kopplung zweier zusätzlicher Arginine am C-terminalen Ende der B-Kette des Humaninsulins sowie einen Austausch von Asparagin durch Glyzin in Position 21 der A-Kette. Insulin glargin liegt in einer sauren Lösung zur Injektion vor. Nach Injektion des Insulins in das subkutane Gewebe kommt es durch einen pH-Anstieg zur Ausbildung amorpher Präzipitate im subkutanen Gewebe mit der Folge einer verzögerten Aufnahme einzelner Insulinmoleküle in die Blutbahn.
Mit Insulin glargin wurde erstmalig ein Insulin mit einer Wirkung über 24 Stunden in die Therapie des Diabetes mellitus eingeführt. Neben einer Reduktion der Insulininjektionen von zwei täglichen Injektionen auf eine tägliche Injektion sind bei diesen Insulinen das flachere Wirkprofil und eine Reduktion der Variabilität in der Wirkung von Tag zu Tag als wesentliche Vorteile hervorzuheben. Insulin glargin U 100 zeichnet sich nicht nur durch eine verlängerte Wirkdauer und eine bessere Abdeckung des Insulinbedarfs über 24 Stunden aus, sondern auch durch eine stringentere Blutzuckerkontrolle insbesondere über die Nacht ohne einen Anstieg des Hypoglykämierisikos im Vergleich zu NPH-Insulinen.
Insulin detemir
Durch Austausch der Aminosäure Threonin in Position B30 und Ankopplung einer langkettigen Fettsäure in Position B29 wird bei Insulin detemir (Levemir®) eine gesteigerte Bindung an das Eiweiß Albumin erreicht. Hierdurch kommt es zu einer Bindung des Insulins an Albumin im subkutanen Gewebe und in der Blutzirkulation, aus der es verzögert freigesetzt wird. Aufgrund der intermediären Wirkdauer dieses Verzögerungsinsulins ist häufig eine ein- bis zweimalige tägliche Injektion erforderlich. Klinisch konnte unter Insulin detemir eine im Vergleich zu NPH-Insulin vergleichbare Wirkung bei geringerer Gewichtszunahme demonstriert werden [Rosenstock 2020].
Insulin glargin U 300
Insulin glargin steht auch in einer höher konzentrierten Formulierung mit 300 Einheiten/ml (U 300; Toujeo®) mit einer im Vergleich zu Insulin glargin U 100 veränderten Pharmakokinetik zur Verfügung. Die dreifach höhere Konzentration des Insulin glargin U 300 führt im Vergleich zu Insulin glargin U 100 zu einer Reduktion des Injektionsvolumens. Auch Insulin glargin U 300 liegt in saurer Lösung vor und präzipitiert aufgrund des pH-Anstiegs nach subkutaner Injektion. Aufgrund des niedrigeren Volumens und einer Verkleinerung der Absorptionsoberfläche des amorphen Präzipitats im subkutanen Gewebe erfolgt eine langsamere Absorption des höher konzentrierten Insulin glargin U 300 in die Blutbahn. Dies führt zu einer im Vergleich zu Insulin glargin U 100 nochmals stärker verzögerten Insulinwirkung und zu einer weiteren Reduktion der Absorptionsvariabilität. In verschiedenen klinischen Studien konnten eine Reduktion nächtlicher Hypoglykämien und eine verminderte Gewichtszunahme unter Insulin glargin U 300 im Vergleich zu Insulin glargin U 100 bei Patienten mit Typ-1- oder Typ-2-Diabetes dargestellt werden. Darüber hinaus erlaubt diese Insulinformulierung ein weiteres Flexibilisieren des Zeitpunkts der Insulininjektion. So zeigt ein Flexibilisieren des Injektionszeitpunkts um ± 3 Stunden unter Insulin glargin U 300 keinen Einfluss auf die Stoffwechselkontrolle [Riddle 2015]. Übereinstimmend zeigt sich in den Studien mit Insulin glargin U 300 ein um 10 bis 15 % erhöhter Basalinsulinbedarf im Vergleich zu Insulin glargin U 100, der auf einen vermehrten subkutanen Insulinabbau bei der verlängerten Verweildauer des Insulins im subkutanen Gewebe zurückgeführt wird.
Insulin degludec
Ähnlich wie Insulin detemir basiert Insulin degludec (Tresiba®) auf einem gering veränderten Humaninsulinmolekül, dem eine langkettige Fettsäure (Hexadecandioyl) in Position B29 angehängt wurde. Nach Injektion in das Unterhautfettgewebe bilden sich lange Multihexamerketten, aus denen einzelne Insulinmonomere an den Enden der Ketten langsam freigesetzt werden. Auch Insulin degludec bindet im subkutanen Gewebe und in der Blutbahn an Albumin, welches zur protrahierten Wirkung von Insulin degludec mit einer Halbwertszeit von über zwei Tagen beiträgt [Heise 2012]. Neben der langen Halbwertszeit und der geringen Absorptionsvariabilität wird die intravasale Bindung des Insulins an Albumin auch für die unter Insulin degludec darstellbare geringe Glukosevariabilität von Tag zu Tag verantwortlich gemacht. In klinischen Studien konnten mit Insulin degludec eine Reduktion des Nüchternblutzuckerwerts und/oder eine Verminderung nächtlicher und schwerer Hypoglykämien im Vergleich zu Insulin glargin U 100 bestätigt werden [Heller 2012, Marso 2017]. Ähnlich wie bei Insulin glargin U 300 ergibt sich auch bei Insulin degludec durch die verlängerte Wirkdauer eine stärkere Flexibilität im Injektionszeitpunkt. So zeigte sich unter Variation der Injektionszeit innerhalb von 8 bis 40 Stunden kein Einfluss auf die Qualität der Blutzuckerkontrolle [Mathieu 2013].
Sicherheit unter einer Therapie mit Basalinsulinen
Während bei Patienten mit einem Diabetes mellitus Typ 1 eine Therapie mit Insulin ohne Alternative ist, wurde die Sicherheit einer Therapie mit Insulin bei Patienten mit einem Diabetes mellitus Typ 2 immer wieder kontrovers diskutiert. Die Datenlage zur Sicherheit einer Therapie mit Insulin bei Patienten mit einem Diabetes mellitus Typ 2 ist begrenzt und beschränkt sich derzeit im Wesentlichen auf zwei randomisierte, kontrollierte Studien. In der Studie ORIGIN (Outcome Reduction with Initial Glargine Intervention) wurde eine frühzeitige Therapie mit Insulin glargin U 100 im Vergleich zu einer Standardtherapie überwiegend aus Sulfonylharnstoffen und Metformin bei prädiabetischen Patienten und bei Patienten mit relativ frisch manifestem Diabetes mellitus untersucht. Nach einer durchschnittlichen Beobachtungsdauer von 6,2 Jahren zeigte sich unter der Therapie mit Insulin glargin U 100 kein Unterschied im Hinblick auf das Risiko für einen gemeinsamen Endpunkt aus kardiovaskulärem Tod, nicht tödlichem Myokardinfarkt oder nicht tödlichem Schlaganfall im Vergleich zur Standardtherapie [Gerstein 2012]. In der Studie DEVOTE (Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events) wurde die Sicherheit einer Therapie mit Insulin degludec im Vergleich zu Insulin glargin U 100 untersucht [Marso 2017]. Bezüglich des primären Endpunkts, bestehend aus kardiovaskulärem Tod, nicht tödlichem Myokardinfarkt und nicht tödlichem Schlaganfall, zeigte sich kein Unterschied zwischen den beiden Behandlungsgruppen. Bei vergleichbarer Senkung des HbA1c-Werts war die Nüchternglukosekonzentration unter Insulin degludec im Vergleich zur mit Insulin glargin U 100 behandelten Gruppe signifikant niedriger. Das Risiko für nächtliche und schwere Hypoglykämien war unter Insulin degludec signifikant niedriger als unter Insulin glargin U 100. Die Therapie mit Insulin glargin und Insulin degludec kann daher insgesamt als sicher eingestuft werden. Ein direkter Vergleich einer Therapie mit Basalinsulinen mit einer Therapie mit GLP (glucagon-like peptide)-1-Rezeptoragonisten und SGLT (sodium-dependent glucose cotransporter)-2-Hemmern im Hinblick auf kardiovaskuläre Endpunkte liegt bisher nicht vor. Aufgrund der positiven Datenlage für kardiorenale Endpunkte für die SGLT-2-Hemmer und GLP-1-Rezeptoragonisten wird daher von vielen Fachgesellschaften der Einsatz dieser Substanzen vor dem Beginn einer Basalinsulintherapie für Patienten mit einem Diabetes mellitus Typ 2 gefordert. Bei Patienten mit einem Diabetes mellitus Typ 2 und schnell fortschreitendem Verlust der Betazellfunktion, Patienten mit einem LADA (late autoimmune diabetes in adults), Patienten mit katabol-ketoner Stoffwechsellage oder Patienten mit Kontraindikationen oder Nebenwirkungen unter SGLT-2-Hemmern oder GLP-1-Rezeptoragonisten bleibt eine Insulintherapie jedoch ersatzlos.
Schnell wirksame Bolus-/Mahlzeiteninsuline
Während bei Basalinsulinen eine möglichst langsame und konstante Absorption aus dem subkutanen Gewebe angestrebt wird, sollen Mahlzeiteninsuline nach der Injektion einen möglichst raschen Wirkeintritt aufweisen, um so exzessive Glukoseanstiege nach einer Mahlzeit zu verhindern. Insuline liegen in ihrer Formulierung in einem Equilibrium aus Hexameren, Dimeren und Monomeren vor. Während Insulinmonomere und Insulindimere relativ schnell über die Gefäßwand absorbiert werden, können Insulinhexamere die Gefäßwand sehr schlecht penetrieren und werden sehr langsam über die Lymphbahnen absorbiert. Bei den schnell wirkenden Insulinanaloga wurden durch geringfügige Modifikation in der Aminosäuresequenz die Equilibrium-Konstanten zwischen Dimeren und Hexameren (KDH) und zwischen Monomeren und Dimeren (KMD) modifiziert, sodass die Insulinmoleküle im subkutanen Depot sehr schnell in Insulindimere und Insulinmonomere zerfallen und somit rasch in die Blutbahn aufgenommen werden können. Wie in Abbildung 3 dargestellt, bedingt dies ein schnelleres Anfluten (faster on) und Abfluten (faster off) des Insulins, was wiederum mit einem geringeren Glukoseanstieg nach einer Mahlzeit und einem reduzierten Hypoglykämierisiko in den Nüchternphasen zwischen den Mahlzeiten einhergeht.
Drei schnell wirkende Insulinanaloga (Insulin lispro, Insulin aspart und Insulin glulisin) stehen derzeit zur subkutanen Applikation zur Verfügung. Diese unterscheiden sich durch geringfügige Modifikationen der Aminosäuresequenz (Tab. 2). Die pharmakokinetischen und pharmakodynamischen Eigenschaften dieser schnell wirkenden Insulinanaloga zeigen jedoch nur marginale Unterschiede. In Clamp-Untersuchungen konnte eine geringfügig schnellere Absorption von Insulin glulisin dargestellt werden, was auf das Fehlen von Zn2+ in der Formulierung zurückgeführt wird [Arnolds 2010].
Durch die schnelle Dissoziation der Insulinhexamere im subkutanen Gewebe wird mit diesen schnell wirkenden Insulinanaloga ein schneller Wirkbeginn innerhalb von 10 bis 20 Minuten im Vergleich zu Normalinsulin (kurz wirkendes Humaninsulin) mit 30 bis 60 Minuten und eine verkürzte Wirkdauer von 2 bis 5 Stunden im Vergleich zu Normalinsulin mit 5 bis 8 Stunden erreicht. Die maximale Wirkung entfalten schnell wirkende Insulinanaloga nach 1 bis 1,5 Stunden, während dies bei Normalinsulin nach 1,5 bis 3 Stunden der Fall ist. In zahlreichen Studien konnten mit den schnell wirkenden Insulinanaloga eine bessere postprandiale Glukosekontrolle und eine Reduktion des Hypoglykämierisikos zwischen den Mahlzeiten im Vergleich zu Normalinsulin dargestellt werden [Home 2012].
Auch wenn mit der Einführung der schnell wirkenden Insulinanaloga eine weitere Annäherung an ein physiologisches Insulinprofil nach einer Mahlzeit erreicht werden konnte, bleibt die Kinetik auch dieser schnell wirkenden Insulinanaloga noch hinter der Kinetik einer prandialen Insulinfreisetzung aus den Betazellen zurück. Das Ziel in der weiteren Entwicklung von Mahlzeiteninsulinen war es daher, Insuline mit einem noch schnelleren Wirkeintritt nach der subkutanen Injektion zu entwickeln. Da weitere Modifikationen der Aminosäuresequenz keine zusätzliche Absorptionsbeschleunigung ergaben, wurde durch Zusatz von Hilfsstoffen in der Formulierung der Insuline eine verbesserte Absorption angestrebt. So wurden der Formulierung von Insulin aspart Niacinamid (Vitamin B3) und L-Arginin zugesetzt (Faster Insulin aspart, Fiasp®). Hierbei bewirkt Niacinamid eine weitere Verschiebung des Equilibriums von Insulinhexameren hin zu Dimeren und Monomeren und damit eine weitere Beschleunigung der Insulinabsorption aus dem subkutanen Gewebe. Der Zusatz von L-Arginin wurde erforderlich, um die Stabilität der Insulinformulierung in Lösung aufrechtzuerhalten. Durch diese Modifikation in der Formulierung von Fiasp® konnte ein doppelt so schnelles Anfluten im Blut, eine 2-fache Insulinexposition und eine 50 % höhere Insulinwirkung im Vergleich zum herkömmlichen Insulin aspart in den ersten 30 Minuten nach der Injektion dargestellt werden [Heise 2015]. In einer neuen Formulierung des schnell wirkenden Insulinanalogons Insulin lispro (Lyumjev®) wurden Citrat zum Steigern der Gefäßpermeabilität und Treprostinil zum Verstärken der lokalen Durchblutung am Injektionsort zugesetzt. Im Vergleich zur bisherigen Insulin-lispro-Formulierung konnte durch diese Modifikation der Formulierung ein um ca. 12 Minuten schnellerer Wirkeintritt und eine mehr als 3-fach höhere Insulinwirkung innerhalb der ersten 30 Minuten nach subkutaner Applikation im Vergleich zur klassischen Insulin-lispro-Formulierung dargestellt werden [Linnebjerg 2020]. In der späten postprandialen Phase mehr als 4 Stunden nach der Injektion war die Wirkung der neuen Insulin-lispro-Formulierung um ca. 50 % geringer als unter der klassischen Formulierung. Diese optimierte prandiale Pharmakokinetik schlägt sich in den klinischen Studien als verbesserte postprandiale Glukosekontrolle und eine Reduktion später postprandialer Hypoglykämien im Vergleich zur klassischen Formulierung nieder [Bue-Valleskey 2021, Klaff 2020]. In einer Studie mit Insulin lispro in der Insulinpumpe konnte mit der schnelleren Insulin-lispro-Formulierung (Lyumjev®) eine signifikant bessere postprandiale Glukosekontrolle und eine Reduktion der Gesamthypoglykämien und der Hypoglykämien im Tagesverlauf im Vergleich zur Insulinpumpentherapie mit der klassischen Insulin-lispro-Formulierung (Humalog®) dargestellt werden [Warren 2020].
Auch im Hinblick auf potenzielle selbstregulierende Insulinpumpensysteme (Closed Loop, artifizielles Pankreas) verspricht man sich durch die beschleunigte Absorption dieser ultraschnell wirkenden Insulinformulierungen erhebliche Vorteile in der Glukosekontrolle.
Ausblick in der Insulintherapie
Die derzeit am meisten verwendeten Basalinsulinanaloga weisen eine Halbwertszeit von 20 bis 25 Stunden und ausreichend stabile pharmakokinetische Profile mit einer relativ geringen Absorptionsvariabilität auf und werden in der Regel einmal täglich appliziert. In Entwicklung befindliche Insuline mit noch längeren Halbwertszeiten lassen in Zukunft eine einmal wöchentliche Basalinsulininjektion möglich erscheinen. In einer vom Unternehmen Lilly entwickelten lang wirksamen Insulinformulierung (Basal Insulin Fc, BIF) werden zwei Insulinmoleküle an ein Fragment einer humanen IgG-FC-Domain gekoppelt. In einer pharmakokinetischen und pharmakodynamischen Untersuchung konnte nach einmaliger Applikation dieses Basalinsulins eine stabile glukosesenkende Wirkung über 10 Tage nachgewiesen werden. Bei einem weiteren einmal wöchentlich zu injizierenden Insulin, Insulin Icodec vom Hersteller Novo Nordisk, handelt es sich um ein an drei Stellen der Aminosäuresequenz modifiziertes Insulinanalogon, an das eine C20-Icosan-Fettsäure gekoppelt wurde. Dieses Insulin weist eine starke Bindung an Albumin im subkutanen Gewebe, im Blut und im interstitiellen Raum auf, aus der es nur stark verzögert wieder freigesetzt wird. Da sich nach Therapiebeginn mit diesem Insulin erst eine Sättigung in der Bindung an Albumin einstellen muss, kommt eine Steady-State-Kinetik erst nach 3 bis 4 Wochen zustande. In einer Studie über 26 Wochen zeigte eine einmal wöchentliche Applikation von Insulin Icodec im Vergleich zu einer einmal täglichen Applikation von Insulin glargin U 100 eine vergleichbare Glukosekontrolle bei guter Verträglichkeit [Rosenstock 2020].
Wie bereits dargestellt, wird physiologisch die Freisetzung des Insulins aus den Betazellen über den aktuellen Glukosespiegel reguliert, wobei gastrointestinale Hormone wie GLP-1 oder GIP (glukose-dependent insulinotropic polypeptide), aber auch das autonome Nervensystem bereits vor einem Anstieg der Glukosekonzentration einen konditionierenden Effekt auf die Betazellen ausüben können. Während bei Menschen ohne Diabetes mellitus die Insulinfreisetzung aus der Betazelle ständig an die aktuelle Glukosekonzentration adaptiert wird, muss die Insulindosis für die subkutane Therapie prospektiv abgeschätzt werden. Eine dauerhaft stabile Blutzuckereinstellung innerhalb physiologischer Glukosekonzentrationen wird hierdurch oft nahezu unmöglich. Neue Möglichkeiten der kontinuierlichen Glukosemessung in Verbindung mit Insulinpumpen könnten insbesondere in Verbindung mit schnell wirkenden Insulinformulierungen diese Lücke weiter schließen und eine an die aktuelle Glukosekonzentration angepasste Insulinzufuhr erlauben. Darüber hinaus könnten neue Technologien, die eine glukoseabhängige Absorption des Insulins aus dem subkutanen Gewebe ermöglichen, den aktuell tatsächlich benötigten Insulinbedarf besser abdecken. Hierbei werden Insulinmoleküle an Trägerstoffe gekoppelt, die dann in Abhängigkeit von der umgebenden Glukosekonzentration das Insulin im subkutanen Gewebe freigeben und damit eine glukoseabhängige Wirkung des subkutan applizierten Insulins ermöglichen.
Hepato-präferenzielle Insuline könnten den hepato-peripheren Insulingradienten wiederherstellen und somit eine optimierte Hemmung der hepatischen Glukosefreisetzung bei geringerem Hypoglykämierisiko durch übermäßige periphere Insulinwirkung an der Muskelzelle erlauben. Alternative Applikationswege wie die enterale Aufnahme von Insulin mit einer Absorption in den Pfortaderkreislauf könnten ebenfalls eine hepato-präferenzielle Insulinwirkung mit einer stärkeren Suppression der hepatischen Glukosefreisetzung bei geringerer peripherer Insulinwirkung mit einer verbesserten nächtlichen Glukosekontrolle bei geringem Hypoglykämierisiko ermöglichen.
Manuskript eingegangen: 2. März 2021
Manuskript angenommen: 1. April 2021
Interessenkonflikt: Thomas Forst gibt an, dass er Angestellter bei Clinical Research Services ist und Mitglied in Beratungsgremien der Unternehmen AstraZeneca, Bayer, Cipla, Eli Lilly, Eyesense, Fortbildungskolleg, Novo Nordisk, Pfizer, Sanofi, Bayer und Roche und dass er Referentenhonorare von den Unternehmen Abbott, AstraZeneca, Boehringer Ingelheim, Berlin-Chemie, Cipla, Eli Lilly, Fortbildungskolleg, MSD, Novartis, Novo Nordisk und Sanofi erhalten hat.
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 12.08.2021 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2021; 30 (4) Seite 272-278