Zwischen einem Diabetes mellitus Typ 2 und einer Herzinsuffizienz gibt es einen bidirektionalen Zusammenhang. Einen Überblick darüber, welche Pathomechanismen, z. B. metabolische, dem zugrunde liegen und welche Auswirkungen das auf therapeutische Entscheidungen hat, gibt diese Fortbildung.
Einleitung
Epidemiologische Daten belegen einen engen, bidirektionalen Zusammenhang zwischen Diabetes mellitus und Herzinsuffizienz. Der metabolischen Komponente kommt in der Krankheitsentwicklung und Prognose eine zentrale Bedeutung zu. Liegen beide Erkrankungen in Kombination vor, ist die Prognose deutlich verschlechtert. Daher erscheint es therapeutisch sinnvoll, neben der Stoffwechseloptimierung nicht nur auf klassische kardiovaskuläre Ereignisse und Mortalität zu fokussieren, sondern die Herzinsuffizienz als klinisch relevanten und die Lebensqualität beeinflussenden Endpunkt diagnostisch zu erfassen und frühzeitig zu behandeln. Nur so kann das rasche Voranschreiten der Erkrankung mit extrem schlechter 3-Jahres-Prognose auf Dauer günstig beeinflusst werden. Die vorliegende Arbeit gibt einen Überblick über Epidemiologie, Pathophysiologie und Prognose von Diabetes und Herzinsuffizienz. Aktuelle Aspekte der Herzinsuffizienz-Therapie bei Diabetes sowie der Diabetes-Therapie bei Herzinsuffizienz werden diskutiert.
Epidemiologische Aspekte
Neben dem akuten Gefäßereignis ist das Vorliegen einer Herzinsuffizienz bedeutend für die kardiovaskuläre Morbidität und Mortalität bei Patienten mit Diabetes mellitus Typ 2. Bei diesen Patienten wird die Diagnose Herzinsuffizienz bis zu 5-mal häufiger gestellt als bei Patienten ohne Diabetes. Das Krankheitsbild ist bereits seit 1881 bekannt, als Mayer postulierte, dass die Herzinsuffizienz eine "häufige und bemerkenswerte Komplikation des Diabetes mellitus" sei, die "auf eine Abnormalität im Metabolismus" zurückgeführt werden kann (1). Rubler et al. bezeichneten dieses Krankheitsbild später als "diabetische Kardiomyopathie" und konnten anhand von Post-mortem-Analysen zeigen, dass sich diese Form der Herzinsuffizienz unabhängig von koronarer Herzkrankheit (KHK), Klappenerkrankung und Bluthochdruck entwickelt (2). Im Jahr 2013 definierten die American Heart Association (AHA) und die European Society of Cardiology (ESC) zusammen mit der European Association for the Study of Diabetes (EASD) schließlich die diabetische Kardiomyopathie als eine klinische Situation, in der ventrikuläre Dysfunktion in Abwesenheit von Bluthochdruck und Koronarsklerose bei Diabetespatienten zu beobachten sei (3).
Die echokardiographische Untersuchung des Herzens, die u. a. Aussagen über Wanddicke und linksventrikuläre Auswurfleistung erlaubt, ist eine wesentliche Untersuchungsmethode zum Erfassen der reduzierten Herzleistung. Dabei wurde bis vor kurzem zwischen Herzinsuffizienz mit erhaltener (heart failure with preserved ejection fraction, HFpEF) und Herzinsuffizienz mit eingeschränkter linksventrikulärer Funktion (heart failure with reduced ejection fraction, HFrEF) unterschieden. Die neuen Leitlinien der ESC führten aktuell zusätzlich den Begriff der HFmrEF (heart failure with midrange ejection fraction) ein, um so Patienten mit Herzinsuffizienz und einer Ejektionsfraktion zwischen 40 und 49 % zu beschreiben (4).
Metabolische Aspekte
Schon das Vorhandensein einer gestörten Nüchternglukose (Prädiabetes) prädestiniert für ein erhöhtes Wahrscheinlichkeitsrisiko (1,2- bis 1,7-fach erhöhtes Risiko) zur Entwicklung einer Herzinsuffizienz auch nach Korrektur für klassische Risikofaktoren wie Alter. Die Multi-Ethnic Study of Atherosclerosis (MESA), die 6 814 Patienten mit KHK einschloss und über 4 Jahre die Inzidenz der Herzinsuffizienz in Abhängigkeit vom Vorliegen eines Metabolischen Syndroms untersuchte, belegte die Assoziation von Komponenten des Metabolischen Syndroms mit einem erhöhten Risiko für eine Herzinsuffizienz. Zwei Drittel der Patienten entwickelten im Verlauf eine HFrEF, wobei das Risiko für die Entwicklung einer Herzinsuffizienz in den prädiabetischen Stadien niedriger war als bei Patienten mit diagnostiziertem, behandeltem Diabetes (5). Aus der Kaiser-Permanente-Northwest-Datenbank sind Verlaufsdaten über insgesamt 6 Jahre von über 8 000 Patienten mit Diabetes und ebenso vielen gematchten, nichtdiabetischen Individuen ohne Herzinsuffizienz bei Studienbeginn verfügbar. Herzinsuffizienz als neue Diagnose trat mit einer Häufigkeit von 30,6 auf 1 000 Personenjahre bei diabetischen Patienten und bei 12,4 pro 1 000 Patientenjahre bei nichtdiabetischen Studienteilnehmern auf (6). Eine vergleichbare Datenlage ergibt sich in der Heart and Soul Study, die im Ergebnis eine Verdopplung des Risikos einer Herzinsuffizienz bei Patienten mit Diabetes im Vergleich zu Nichtdiabetikern mit stabiler KHK belegen konnte (7). Die Posthoc-Analyse der Patienten im Präventionsarm der Studies of Left Ventricular Dysfunction (SOLVD-P-Studie), in der asymptomatische Patienten mit linksventrikulärer Ejektionsfraktion (LVEF) < 35 % eingeschlossen wurden, zeigt eine Verdopplung des Risikos für Herzinsuffizienz bei vorliegendem Diabetes mellitus (8). Diese Studien ergänzen Daten aus klassischen epidemiologischen Erhebungen wie The Framingham Study, UK Prospective Diabetes Study (UKPDS), Cardiovascular Health Study, Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) und Euro Heart Failure Surveys, die das gehäufte Auftreten von Herzinsuffizienz bei Diabetikern ebenfalls beschreiben (Übersicht bei [9]). Die UKPDS zeigt einen Anstieg von etwa 2,3 Herzinsuffizienz-assoziierten Ereignissen pro 100 Patientenjahre bei einem durchschnittlichen HbA1c von 6 %; bei HbA1c-Werten um 10 % beträgt die Ereignisrate sogar 11,9 pro 100 Patientenjahre. Mit jedem Prozentpunkt-Anstieg im HbA1c steigt die Rate der herzinsuffizienten Patienten um 8 %. Die Prävalenz der Herzinsuffizienz bei Diabetikern ist hoch, nimmt mit dem Alter weiter zu und ist zudem häufig mit einer KHK assoziiert. Betroffene haben mit einem medianen Überleben von 3,6 vs. 5,4 Jahren eine deutlich reduzierte Prognose (10, 11).
Werden umgekehrt die Daten aus Herzinsuffizienz-Studien und -Registern bezüglich des Glukosestoffwechsels analysiert, so zeigt sich eine deutliche Häufung einer wenigstens prädiabetischen Stoffwechsellage bei den herzinsuffizienten Patienten mit maßgeblichem Einfluss auf die Prognose. Daten aus verschiedenen Registerstudien beschreiben eine Prävalenz des Diabetes bei Herzinsuffizienz-Patienten zwischen 24 % (Olmsted County) und 38 % (Medicare Beneficiaries) (12, 13). Die Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure (PARADIGM HF)-Studie als neuere einflussreiche Studie zur Therapie der Herzinsuffizienz schloss Patienten ohne besondere Berücksichtigung des Diabetesstatus ein. In der genaueren Untersuchung der Patienten erwiesen sich 35 % als bereits bekannte Diabetiker, während weitere 38 % neu diagnostiziert wurden, entweder als manifeste Diabetiker oder Patienten mit Prädiabetes (14).
Pathobiochemische Aspekte
Die diabetische Kardiopathie stellt sich als Konglomerat verschiedener Schädigungseinflüsse dar. Neben funktionellen Einbußen wie endotheliale Dysfunktion als Vorstufe der Atherosklerose sowie Mikro- und Makroangiopathie spielen periphere Insulinresistenz, strukturelle Komponenten wie linksventrikuläre Hypertrophie, myokardiale Fibrose, beschleunigte Koronarsklerose, elektrophysiologische Defekte, Kalziumüberladung, Aktivierung des Renin-Angiotensin-Systems und Sympathikus-Aktivierung eine Rolle. Sowohl metabolische als auch strukturelle Gründe sind dafür von Relevanz. Eine subklinisch zu beobachtende Füllungsstörung im Sinne einer diastolischen Dysfunktion entwickelt sich dabei zur HFpEF, die in der weiteren Entwicklung eine systolische Füllungsstörung (systolische Dysfunktion) mit Ausbildung einer HFrEF zur Folge hat. Die Fixierung auf Fettsäuresubstrate und unzureichende Anpassung des sonst sehr dynamischen Substratflusses bei fehlender oder reduzierter Insulinsensitivität bewirkt in den Herzen der Patienten mit Diabetes mellitus eine unzureichende Stoffwechselanpassung an die Bedarfssituation. Zusätzlich ist in der mitochondrialen Atmungskette eine zunehmend ineffizientere ATP-Gewinnung zu beobachten, die im Wesentlichen auf der vermehrten Wärmegewinnung durch Entkopplung der Atmungskette (ox. Radikale und mitochondrialer Stress) beruht.
Die Akkumulation von Produkten aus dem Lipid- und Glukosestoffwechsel (Lipo- und Glukotoxizität, Bildung von Advanced Glycation Endproducts [AGEs]) verschlechtert die Energiesituation des Herzens. Sie trägt zudem direkt zu einem strukturellen Umbau des Herzens bei ("Steatosis cordis", beschleunigte Koronarsklerose). Diese Prozesse führen zur diabetischen Kardiomyopathie, die definitionsgemäß unabhängig von atherosklerotischen Veränderungen ist (9, 15). Reaktive Metabolite des Glukosestoffwechsels sind im Rahmen der diabetischen Kardiomyopathie vermehrt im Herzmuskel nachweisbar und tragen zur strukturellen sowie funktionellen Leistungseinbuße bei. Methylglyoxal als reaktives Dicarbonylprodukt kann in der Glykolyse durch nichtenzymatische Dephoshorylierung spontan entstehen und wird bei Diabetes nicht adäquat durch das Glyoxalase-System entgiftet. Direkte Proteinmodifikationen wie HSP27-Modifikation in den Glanzstreifen des Herzens sind so nachweisbar (16). Carboxymethyllysin als wichtiges AGE konnte in einer Untersuchung als starker Prädiktor für den kombinierten Endpunkt Tod, Herztransplantation, ischämisches kardiovaskuläres Ereignis und Hospitalisierung aufgrund von Herzinsuffizienz nach Adjustierung für die Risikofaktoren Alter, Geschlecht und anderen Herzinsuffizienz-assoziierten Risikofaktoren bestätigt werden (17).
Patientenrelevante Aspekte
Das Risiko für die klassischen Endpunkte Hospitalisierung wegen Herzinsuffizienz und Mortalität sind bei gleichzeitigem Vorliegen eines Diabetes mellitus signifikant erhöht. Daten dazu sind neben den bereits erwähnten Studien speziell aus der Danish Investigations of Arrhythmia and Mortality on Dofetilide in Congestive Heart Failure (DiaMonD-CHF)-Studie zugänglich, die bei fast 5 500 Patienten, die aufgrund von kongestiver Herzinsuffizienz hospitalisiert wurden, den Einfluss von Diabetes auf die Mortalität untersuchte. Die 1-Jahres-Mortalität betrug 31 %, nach 3 Jahren waren 50 % aller Patienten mit Diabetes mellitus verstorben; diese Zahlen liegen deutlich über der Mortalitätsprognose für Stoffwechselgesunde (10). Weitere große Studien wie die Candesartan in Heart failure – Assessment of Mortality and Morbidity (CHARM)-Studie bestätigen diese ernüchternden Zahlen, wobei insbesondere CHARM zeigt, dass die schlechtere Prognose (40 % kumulatives Risiko für Rehospitalisierung bzw. kardiovaskulären Tod) sowohl für HFpEF- als auch für HFrEF-Patienten gilt. Patienten mit Diabetes und eingeschränkter LVEF wiesen das höchste Risiko für beide Endpunkte auf, gefolgt von Patienten mit Diabetes und erhaltener LVEF: 58,6 auf 1 000 Patientenjahre für HFpEF vs. 119,1 auf 1 000 Patientenjahre für HFrEF für Mortalität und 116,6 auf 1 000 Patientenjahre bei HFpEF vs. 154,4 auf 1 000 Patientenjahre bei HFrEF für die erste Hospitalisierung aufgrund von Herzinsuffizienz. Das Risiko eines Diabetikers, einen dieser Endpunkte zu erleiden, lag etwa doppelt so hoch wie das eines Stoffwechselgesunden (18). Das Risiko für eine Hospitalisierung wegen Herzinsuffizienz oder kardiovaskulären Tod liegt diesen Daten zufolge zwischen 12 und 15 % innerhalb eines Jahres.
Die Diagnostik der diabetischen Herzinsuffizienz unterscheidet sich aufgrund der vergleichbaren Symptomatik nicht von der der klassischen Herzinsuffizienz-Diagnostik. Gemäß Leitlinien gehören Symptomerhebung, körperliche Untersuchung und Bestimmung natriuretischer Peptide (BNP, brain natriuretic peptide) ebenso zum Grundrepertoire wie EKG und Echokardiographie. Bei Vorliegen einer HFrEF können weitere Bildgebungsverfahren wie Koronarangiographie und Rechtsherzkatheteruntersuchung notwendig sein. In der Differentialdiagnostik muss an eine mögliche Myokarditis gedacht werden. Zur Charakterisierung und Diagnose einer HFpEF zählen gemäß Leitlinie eine sorgfältige Symptomerhebung, nach neuer Definition LVEF ≥ 50 % für HFpEF oder 40 bis 49 % für HFmrEF, BNP > 35 pg/ml und/oder NT-proBNP (N-terminales Propeptid BNP) > 125 pg/ml (bei gleichzeitigem Vorliegen von Vorhofflimmern entsprechend höhere Werte für NT-proBNP) sowie objektive Nachweise funktioneller oder struktureller Veränderungen (z. B. linksventrikuläre Hypertrophie, Vergrößerung des linken Vorhofs und zusätzliche echokardiographische Parameter wie ein linksatrialer Volumenindex oder linksventrikulärer Massenindex); Zeichen der diastolischen Dysfunktion (4).
Therapeutische Aspekte
Therapie der Herzinsuffizienz
Die Therapie der Herzinsuffizienz und damit die Prognose hat sich in den letzten Jahren deutlich verbessert (19). Die Behandlung unterscheidet sich nicht zwischen Diabetikern und Stoffwechselgesunden. Für Patienten mit HFpEF existieren keine festgelegten therapeutischen Konzepte, die eine Reduktion der Mortalität und der Morbidität gezeigt haben. Die Leitlinienempfehlung beschränkt sich hier auf symptomkontrollierende Maßnahmen und stellt die Behandlung der Komorbiditäten wie Hypertonie, chronische Nierenerkrankung oder chronisch-obstruktive Lungenerkrankung (COPD) in den Vordergrund. Eine Diurese-Therapie ist für symptomatische Patienten obligat (4).
Bei symptomatischen Herzinsuffizienz-Patienten in den NYHA (New York Heart Association)-Klassen II bis IV und eingeschränkter LVEF (< 40 %) wird die Gabe von ACE (Angiotensin-Converting Enzyme)-Hemmern (alternativ Sartane) und Betablockern mit Titration zur maximal tolerierten Dosis empfohlen. Besonders Patienten mit Diabetes profitieren hier stärker vom ACE-Inhibitor-Einsatz. Bei Patienten, die unter dieser Therapie noch Symptome und eine LVEF von 35 % oder weniger aufweisen, wird die zusätzliche Gabe von Mineralokortikoid-Rezeptor-Antagonisten empfohlen. Sollten die Patienten weiter symptomatisch sein, kann bei Patienten, die ACE-Hemmer oder Sartane tolerieren, ein Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI) als Ersatz für diese Substanzen zur Therapieeskalation eingesetzt werden. Bei Patienten im Sinusrhythmus und mit einer QRS-Dauer von mehr als 130 ms ist eine CRT (kardiale Resynchronisations-Therapie) zu erwägen. Für Patienten im Sinusrhythmus und mit einer Herzfrequenz von mindestens 70 Schlägen/min kann Ivabradin eingesetzt werden. Zusätzlich sollten alle Patienten mit Symptomen und Zeichen der Stauung eine Diuretika-Therapie erhalten. Gemäß aktueller Leitlinie sollte bei Patienten, die auch nach Optimierung der medikamentösen Therapie eine LVEF von 35 % oder weniger aufweisen, primärprophylaktisch der Einsatz eines implantierbaren Kardioverter-Defibrillators (ICD) erwogen werden (4).
Antidiabetische Therapie
Die alleinige Lebensstil-Intervention hat in der Action for Health in Diabetes (Look-AHEAD)-Studie bei über 5 000 übergewichtigen Patienten trotz Gewichtsverlusts, verbesserter physikalischer Fitness und gebesserten HbA1c-Werts keine signifikante Reduktion kardiovaskulärer Ereignisse oder von Herzinsuffizienz-Symptomen zur Folge gehabt (20). Erst ein Körpergewichtsverlust von mindestens 10 % Körpergewicht innerhalb des ersten Jahres hat das kardiovaskuläre Outcome positiv beeinflusst. Eine verbesserte physikalische Fitness von mehr als 2 metabolischen Äquivalenten hat zu einem positiven Effekt des die Herzinsuffizienz beinhaltenden sekundären Endpunkts, nicht aber des MACE-3 (Major Adverse Cardiac Events 3) geführt (21). Symptome einer metabolisch induzierten linksventrikulären Dysfunktion können durch erfolgreiche Lebensstilmodifikation-Intervention verbessert werden.
Die intensivierte glykämische Kontrolle und ihre Bedeutung für kardiovaskuläre Endpunkte war Ziel großer Studien wie UKPDS (22), Action to Control Cardiovascular Risk in Diabetes (ACCORD) (23), Action in Diabetes and Vascular Disease – Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) (24) und Veterans Affairs Diabetes Trial (VADT) (25). Zwar wurde das Herzinfarktrisiko gesenkt, nicht jedoch kardiovaskuläre Mortalität bzw. Herzinsuffizienz-Prävalenz. Die Therapieintensivierung hatte einen Anstieg der Rate Hypoglykämie-bedingter schwerwiegender Ereignisse zur Folge. Individualisierte und Risiko- bzw. Ereignis-adaptierte Therapieregimes sind zu bevorzugen. Verschiedenste Antidiabetika stehen dafür zur Verfügung, auf die im Folgenden eingegangen werden soll.
Metformin
Nach wie vor ist Metformin Erstlinien-Therapie in der Behandlung des Typ-2-Diabetes. Die Anwendungsbegrenzung für Patienten mit Herzinsuffizienz aufgrund einer möglichen Laktatazidose bei hämodynamischer Einschränkung hat sich als nicht zutreffend erwiesen, so dass Metformin bei Patienten mit Insulinresistenz und Herzinsuffizienz im Rahmen der prospektiven Effect of Metformin in Insulinresistant Patients with Heart Failure with educed Ejection Fraction (METRIS-HF-DZHK18)-Studie gezielt evaluiert wird. Auch die Anwendungsbegrenzung bei reduzierter Nierenfunktion wurde bis auf 45 ml/min gelockert, so dass dieses Medikament einer breiteren Anzahl von Patienten zur Verfügung steht.
Sulfonylharnstoffe/Insulin
Zum Einsatz von Sulfonylharnstoffen und Insulin bei Patienten mit Herzinsuffizienz existieren wenige, widersprüchliche Daten. In der UKPDS-33, die Sulfonylharnstoffe bzw. Insulin gegen eine Ernährungstherapie bei neudiagnostizierten Typ-2-Diabetikern verglich, wurde kein Unterschied in der Ereignisrate bzgl. Herzinsuffizienz festgestellt (26). Aus dem Vergleich von Gliptinen mit Sulfonylharnstoffen als Zusatztherapie zu Metformin ergab sich, dass Gliptine den Sulfonylharnstoffen in puncto MACE-3 und Tod jeglicher Ursache überlegen sind, im Endpunkt Hospitalisierung wegen Herzinsuffizienz waren beide Therapieformen gleichwertig (27). In einer retrospektiven Studie hingegen ergab sich ein klarer Nachteil der Sulfonylharnstoff-Therapie in Bezug auf Hospitalisierungsrate und kardiovaskuläre Ereignisrate (28, 29).
Der Thiazolidinediones Or Sulfonylureas Cardiovascular Accidents Intervention Trial (TOSCA.IT) kommt im direkten Vergleich zwischen Sulfonylharnstoff (Glibenclamid, Gliclazid oder Glimepirid) und Pioglitazon zu einem vergleichbaren Ergebnis hinsichtlich der Ereigniswahrscheinlichkeit kardiovaskulärer Endpunkte (30). Aufgrund der weniger günstigen Eigenschaften der Sulfonylharnstoffe in puncto Gewichtszunahme und Hypoglykämie-Induktion erscheint diese Substanzgruppe mit wenig Anwendungsbreite insbesondere bei kardiovaskulären Risikopatienten.
Die Effekte einer Insulintherapie (insulinotrop bzw. Insulin) versus Metformin- bzw. Glitazon-Therapie wurde in der Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI-2D)-Studie bei diabetischen KHK-Patienten evaluiert (31). Eine Untergruppe von Patienten wies bereits bei Studieneinschluss eine Herzinsuffizienz auf. Für MACE-3 und auch Hospitalisierungsrate wegen Herzinsuffizienz wurden keine Unterschiede zwischen den Therapieformen festgestellt. Bei älteren Patienten ergab sich in einer Subanalyse aber ein erhöhtes MACE-Risiko für insulinbehandelte Patienten. Auch andere retrospektive Studien finden eine vermehrte Assoziation von Herzinsuffizienz-Ereignissen mit Insulintherapie, die sich aber in der UKPDS-33 und der Outcome Reduction with an Initial Glargine Intervention (ORIGIN)-Studie nicht bestätigen ließ (26, 32). Die frühe Behandlung von Typ-2-Diabetikern mit Insulin glargin resultierte hier in keinem signifikanten Ereigniswahrscheinlichkeitsvorteil. Insulin degludec konnte in der Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events (DEVOTE)-Studie dem Insulin glargin vergleichbare Effekte erreichen (33). Hohe Insulindosen von täglich über 100 Einheiten waren jedoch in einer Kohortenstudie an Metformin-monotherapierten Patienten im Vergleich zur niedrigen Dosierung von max. 25 Einheiten mit vermehrtem Auftreten kardiovaskulärer Ereignisse, jedoch nicht Herzinsuffizienz-Ereignissen verknüpft (34). Insulin ist insgesamt als kardiovaskulär neutrale Therapie zu bewerten, wobei bei Patienten mit Herzinsuffizienz die therapieassoziierte Natriumretention als ursächlich für Ödembildung gilt.
Thiazolidindione
Häufige Nebenwirkung der Glitazon-Therapie sind natrium- und wasserretentionsbedingte Ödembildung, die bei Rosiglitazon als Ursache für das vermehrte Auftreten von Herzinsuffizienz angesehen wurde und zum Zulassungsverlust führte (35). PROactive (PROspective pioglitAzone Clinical Trial In macroVascular Events) hatte für Pioglitazon eine Reduktion kardiovaskulärer Risikofaktoren gezeigt und auch zu einer 16%igen Reduktion des Endpunkts (MACE-3) geführt; gleichzeitig war jedoch die Hospitalisierungsrate, nicht aber die Mortalität, aufgrund von Herzinsuffizienz-Symptomen erhöht (36). Demzufolge wurde die Behandlung mit Pioglitazon auf Patienten mit NYHA I bis II begrenzt.
DPP-4-Inhibitoren
Daten zur Beeinflussung des therapeutisch relevanten Endpunkts Herzinsuffizienz für die DPP-4-Inhibitoren sind aus den großen Postmarketing-Studien verfügbar, die nach Bestimmungen der Food and Drug Administration (FDA) und der European Medicines Agency (EMA) obligat wurden, dem Glukose-Equipoise-Konzept folgten und somit HbA1c-unabhängige Effekte beschreiben. Daten aus drei großen DPP-4-Studien sind verfügbar: Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus – Thrombolysis in Myocardial Infarction (SAVOR-TIMI 53) (37), Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care (EXAMINE) (38) und Trial Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS) (39). In allen Studien konnte die kardiovaskuläre Sicherheit der Substanzen belegt werden, jedoch war die Rate von Hospitalisierungen aufgrund von Herzinsuffizienz in der SAVOR-TIMI-53-Studie signifikant altersunabhängig bei Patienten mit Herzinsuffizienz in der Anamnese, mit eGFR < 60 ml/min oder erhöhten Laborwerten für proNT-BNP bei Studieneinschluss erhöht (40). In EXAMINE war dies als nichtsignifikante Tendenz festzustellen, während sich in TECOS bezüglich dieses Endpunkts keine negative Assoziation fand, so dass von einem Einzelsubstanzeffekt auszugehen ist. Speziell Vildagliptin wurde im Effects of Vildagliptin on Ventricular Function in Patients With Type 2 Diabetes Mellitus and Heart Failure: A Randomized Placebo-Controlled Trial (VIVIDD-Studie) bezüglich des Endpunkts Herzinsuffizienz genauer untersucht. Es ergab sich für herzinsuffiziente Diabetiker kein therapeutischer Vorteil bezüglich der LVEF (41). Eine große retrospektive Datenanalyse von 375 000 neu mit Saxa- bzw. Sitagliptin behandelten Patienten belegt eine im Vergleich zu Pioglitazon, Sulfonylharnstoff bzw. Insulintherapie reduzierte kardiovaskuläre bzw. Gesamtmortalität (42). Weder DDP-4-Inhibitoren noch direkte GLP-1-Rezeptoragonisten sind einer großen retrospektiven Datenanalyse von fast 1,5 Mio. behandelten Patienten zufolge mit einer vermehrten Hospitalisierungsrate aufgrund von Herzinsuffizienz assoziiert (43).
GLP-1-Rezeptoragonisten (RAs)
Auch die großen GLP-1-RA-Studien folgen den Auflagen der FDA. Hier sind für die kurzwirkenden Substanzen Daten zu Lixisenatide aus der Evaluation of Lixisenatide in Acute Coronary Syndrome (ELIXA)-Studie bei Patienten mit akutem Koronarsyndrom (44), zu Liraglutide aus dem Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results Trial (LEADER-Studie) (45) verfügbar. Bei den einmal wöchentlich zu verabreichenden Präparaten sind für Semaglutide Daten aus dem Trial to Evaluate Cardiovascular and Other Long-Term Outcomes with Semaglutide in Subjects with Type 2 Diabetes (SUSTAIN-6) (46) und Exenatide einmal wöchentlich Ergebnisse aus der Effects of Once Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes (EXSCEL)-Studie zugänglich (47). Alle Substanzen zeigten ein wenigstens kardiovaskulär neutrales Sicherheitsprofil, im Fall von Liraglutide und Semaglutide sogar Überlegenheit, die sich aus der MACE-3-Berechnung ergab. In puncto Herzinsuffizienz ist keine der Substanzen einer Standardtherapie überlegen, zu Liraglutide liegen hier weitere Studien vor.
In der Functional Impact of GLP-1 for Heart Failure Treatment (FIGHT)-Studie hat Liraglutide zu keiner Verbesserung der kardialen Funktion bei Patienten mit fortgeschrittener Herzinsuffizienz (LVEF ≤ 40 %: 29 % NYHA II und 68 % NYHA III/IV; 60 % Diabetiker) über 180 Tage Therapiedauer geführt (48). In der Effect of Liraglutide on Left Ventricular Function in Chronic Heart Failure (LIVE)-Studie hat die Liraglutide-Therapie für 24 Wochen bei Patienten mit reduzierter LVEF (≤ 45 %; 31 % Diabetiker) zu keiner signifikanten Verbesserung der LVEF geführt (49). Auch Albiglutide als weiteres einmal wöchentlich zu verabreichendes Präparat hat bei NYHA-II/III-Patienten zu keiner Verbesserung der LVEF geführt (50). Weitere Ergebnisse für GLP-1-RAs sind zu erwarten aus der Major Cardiovascular Events in Patients With Type 2 Diabetes: Researching Cardiovascular Events With a Weekly INcretin in Diabetes (REWIND)-Studie für Dulaglutide und der Effect of Albiglutide, When Added to Standard Blood Glucose Lowering Therapies, on Major Cardiovascular Events in Subjects With Type 2 Diabetes Mellitus (HARMONY OUTCOMES)-Studie.
Nach bisheriger Datenlage ist die Therapie der herzinsuffizienten Diabetiker mit GLP-1-RAs also als sicher einzustufen, generiert aber keinen Vorteil bezüglich der LVEF.
SGLT-2-Inhibitoren/Gliflozine
Zu den SGLT-2-Inhibitoren sind bis heute zwei kardiovaskuläre Endpunktstudien publiziert worden, die beide eine Überlegenheit dieser Therapieform bezüglich MACE-3 belegen und auch den Endpunkt Herzinsuffizienz signifikant positiv beeinflussen konnten: der Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients – Removing Excess Glucose (EMPA-REG Outcome) (51), der 10 bzw. 25 mg Empagliflozin zusätzlich zur Standardtherapie bei kardiovaskulären Ereignispatienten testete und insgesamt deutlich zugunsten des Empagliflozins ausfiel, sowohl im Endpunkt MACE-3 (38 % Risikoreduktion) als auch im Endpunkt Hospitalisierung wegen Herzinsuffizienz (35 % Risikoreduktion). Ähnlich positiv sind die Ergebnisse des Programms CANagliflozin cardioVascular Assessment Study (CANVAS) und der CANagliflozin cardioVascular Assessment Study – Renal (CANVAS-R), deren positiver Gesamteffekt aber durch eine erhöhte Rate von Minoramputationen getrübt wird (52).
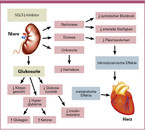
Zwei wesentliche Gründe werden für den therapeutischen Effekt der Gliflozine bezüglich Herzinsuffizienz diskutiert: 1) Verschiebung des kardialen Metabolismus hin zur vermehrten Verstoffwechselung von Ketonkörpern als "cardiac super fuel" sowie 2) hämodynamische Effekte durch die glukosebedingte verbesserte Flüssigkeitsbilanz. Weiter werden moderate Gewichtseffekte der SGLT-2-Inhibitoren, Blutdrucksenkung, Reduktion des oxidativen Stresses und der arteriellen Steifigkeit sowie Reduktion der Sympathikusnerv-Aktivierung diskutiert (Abbildung 1) (53).
Mit Spannung werden Ergebnisse aus dem Multicenter Trial to Evaluate the Effect of Dapagliflozin on the Incidence of Cardiovascular Events (DECLARE-TIMI 58) zu Dapagliflozin und der Cardiovascular Outcomes Following Ertugliflozin Treatment in Type 2 Diabetes Mellitus Participants With Vascular Disease (VERTIS CV)-Studie zu Ertugliflozin erwartet. Daten aus der realen Behandlungswelt (CVD-REAL-Register) lassen auf einen substanzunabhängigen Klasseneffekt schließen (54), die Rekrutierung für die Herzinsuffizienz-Studien mit Dapagliflozin und Empagliflozin, jeweils mit HFpEF- bzw. HFrEF-Patienten, läuft und wird diese spezifische Fragestellung beantworten können.
Schlussfolgerung
Herzinsuffizienz und Diabetes mellitus gelten als einander verstärkendes, tödliches Duo. Metabolische Effekte betreffen dabei nicht nur die Leistungsfähigkeit des Organs Herz, sondern sind strukturell und funktionell von Relevanz. Eine individuelle, intensivierte Therapie ist nötig, um die Patienten mit Diabetes vor der Entwicklung einer Herzinsuffizienz zu schützen. Die jüngst veröffentlichte Langzeitanalyse der Steno-2-Studie belegt eindrucksvoll, dass ein rechtzeitiges und intensives, multifaktorielles Risikofaktorenmanagement lebenszeitverlängernd für die Patienten mit Diabetes sein kann (55). Ebenso sind herzinsuffiziente Patienten nicht nur kardiologisch zu behandeln, sondern optimiert stoffwechselkontrolliert zu begleiten, da die Stoffwechselkomponente progressionstreibend ist.
Interessenkonflikte:
Bernd Stratmann gibt an, dass er Vortragshonorare von den Unternehmen AstraZeneca, Daiichi Sankyo und neoplas tools erhalten hat.
Young Hee Lee-Barkey gibt an, dass sie Vortragshonorare von den Unternehmen AstraZeneca, Amgen, Allergan, Boehringer Ingelheim, Bristol-Myers Squibb, Lilly, MSD, Novo Nordisk, Sanofi Aventis und Servier erhalten hat.
Diethelm Tschöpe gibt an, dass er Zuwendungen/Honorare von den Unternehmen Amgen, AstraZeneca, Berlin-Chemie, Boehringer Ingelheim, Lilly, MSD, Novo Nordisk, Novartis, Pfizer und Santen und Drittmittel/Projektunterstützungen (als Honorarverantwortlicher für klinische Studien) der Unternehmen AstraZeneca, Bayer, GWT-TUD, Eli Lilly, GSK und Novartis erhalten hat.
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 8.8.2018 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2018; 27 (4) Seite 205-212