Die Entwicklung des kontinuierlichen Glukosemonitorings (CGM) hat die Möglichkeiten des Therapiemanagements beim Diabetes mellitus für Ärzte, Diabetesteams und Patienten entscheidend erweitert: Messdaten rund um die Uhr bieten reichhaltige Informationen und somit eine fundierte Basis für Entscheidungen. Die Interpretation der CGM-Daten erscheint aufgrund der Fülle komplex – dem schafft das Ambulante Glukoseprofil (AGP) Abhilfe. Es kann zur strukturierten Auswertung von CGM-Daten genutzt werden und die Entscheidungsfindung im Praxisalltag erleichtern. (zertifizierter CME-Fortbildungsbeitrag)
CME-Fortbildung – holen Sie sich Ihre Punkte!
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 10. Oktober 2019 einen Fragebogen zu diesem Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Die klassische Blutzuckerselbstkontrolle liefert nur wenige Daten pro Tag und kann im Alltag als unangenehm und wenig diskret empfunden werden. Die Selbstkontrolle mit Blutzuckermessgeräten erfordert einen Stich in eine Fingerbeere, um einen Blutstropfen zu gewinnen. Verunreinigungen an den Fingern können zu fehlerhaften Werten führen. Bringt der Stich zu wenig Blut, muss erneut gestochen werden.
Bei Menschen mit Diabetes und einer intensivierten Insulintherapie (ICT), die täglich mindestens vier- bis fünfmal messen, ergeben sich so mindestens 1460 Stiche pro Jahr. Trotzdem erhalten sie damit täglich nur mehrere einzelne Werte; die Kontrolllücken dazwischen summieren sich also auf 24 Stunden minus etwa 5 Sekunden. Schwankungen der Glukosewerte, nächtliche und asymptomatische Hypoglykämien bleiben so oft unerkannt (1).
Bei kontinuierlichen Glukosemesssystemen können an nur einem Tag 1440 Glukosewerte erfasst werden (2, 3). Die Daten aus einem definierten Zeitraum können zur Mustererkennung im Glukoseverlauf genutzt werden. Für eine anschauliche Darstellung werden diese aktuell vermehrt mithilfe des AGPs visuell aufbereitet.
Der klassische HbA1c-Wert gilt als etablierter Standard. Er gibt den Durchschnitt der Glukosekonzentration der letzten 2 bis 3 Monate wieder und liefert eine Aussage über das Risiko des Menschen mit Diabetes für Spätkomplikationen (1). Ob, wann und in welchem Umfang aber Glukoseschwankungen auftraten, spiegelt sich im HbA1c-Wert nicht wider. Informationen auf täglicher Basis, wie Hypo- und postprandiale Hyperglykämien, werden nicht abgebildet.
Des Weiteren kann der HbA1c-Wert bei einer bestehenden Anämie, Niereninsuffizienz, Leberzirrhose etc. falsche Ergebnisse liefern. Immer wieder sehen wir in der Praxis Patienten, deren HbA1c-Werte nicht mit ihren CGM-Daten zusammenpassen. Ein Grund hierfür kann die inter- und intraindividuelle Erythrozytenüberlebenszeit sein. Auch dann bildet der HbA1c-Wert nicht die wahre Glukosestoffwechsellage ab und es kann zu unnötigen medikamentösen Korrekturen kommen (1, 4).
Vorteile des kontinuierlichen Glukosemonitorings
Bei Verwendung von CGM-Systemen können durch die Zunahme der Qualität der Information und deren Menge, z. B. Anzeige des aktuellen Glukosewerts, Trendanzeige und Alarme beim Erreichen voreingestellter Grenzwerte, Therapieziele wie Reduktion des HbA1c-Werts, der Glukosevariabilität, der Hypoglykämiefrequenz und -dauer und des Auftretens von schweren Hypoglykämien besser erreicht werden (5).
Nach dem im Dezember 2017 publizierten Konsens von Danne et al. sollten CGM-Daten genutzt werden, um unter anderem Hypoglykämien und Glukosevariabilität zu ermitteln (1). Indiziert ist der Einsatz von CGM-Systemen für die Beurteilung der Glykämie und für Therapieanpassungen bei allen Menschen mit Typ-1-Diabetes, bei Menschen mit Typ-2-Diabetes mit intensivierter Insulintherapie, bei insulinbehandeltem Diabetes mit Hypoglykämiewahrnehmungsstörung und in der Schwangerschaft mit vorbestehendem insulinbehandeltem Diabetes (5).
Bei kontinuierlichen Messsystemen wird die Glukose nicht im Blut gemessen, sondern in der interstitiellen Gewebsflüssigkeit. Die CGM-Sensoren messen zwischen 6 und 14 Tagen (Dexcom G5 und G6 von Dexcom, Enlite und Guardian 3 von Medtronic, FreeStyle Libre/FreeStyle Libre 2 von Abbott, S7 EasySense von Medtrum) im subkutanen Fettgewebe. Der Sensor Eversense XL (Roche Diabetes Care) misst bis zu 180 Tage; dafür wird er mittels Inzision der Haut im subkutanen Fettgewebe platziert.
Das CGM löst wichtige Limitationen von HbA1c und Blutzuckerselbstkontrolle (1), so kann es auch kurzzeitige Glukoseänderungen erfassen. Informationen darüber, ob sich der Glukosewert aktuell nach oben oder unten verändert, sowie eine Prognose der voraussichtlichen Geschwindigkeit der Änderung veranschaulichen CGM-Geräte durch die Ausrichtung und Zahl von Trendpfeilen und geben so die Veränderungsrate des Glukoseverlaufs wider (Beispiel: der schräg nach unten zeigende Trendpfeil bei FreeStyle Libre/FreeStyle Libre 2 bedeutet ein Sinken der Glukosekonzentration zwischen 1 und 2 mg/dl/min bzw. 0,06 und 0,1 mmol/l).
Zu beachten ist, dass die Trendpfeile die Entwicklung auf Basis der retrospektiven Daten darstellen und den voraussichtlichen Verlauf anzeigen. Dementsprechend orientieren sich viele Menschen mit Diabetes bei Therapieentscheidungen, etwa zur Berechnung des Mahlzeiteninsulins mit Korrektur, besonders an den Trendpfeilen auf dem Display ihres Lesegeräts (3). Programmierbare Alarme bieten Menschen mit Diabetes zudem bei den meisten CGM-Geräten heute die Möglichkeit, sich zum Beispiel beim Erreichen bestimmter oberer und unterer Grenzwerte warnen zu lassen. Das lässt viele beruhigter schlafen.
AGP erleichtert Auswerten der Daten
Für die Darstellung der kontinuierlich gemessenen Glukosewerte wird international die Nutzung des AGPs empfohlen (1). Die mit dem kontinuierlichen Glukosemonitoring erfasste Datenfülle kann mit dem AGP aufbereitet werden und ermöglicht eine standardisierte Auswertung. Die Daten aus dem gewählten Zeitraum werden in Form eines 24-Stunden-Standardtags dargestellt (2, 6) (Abb. 1).
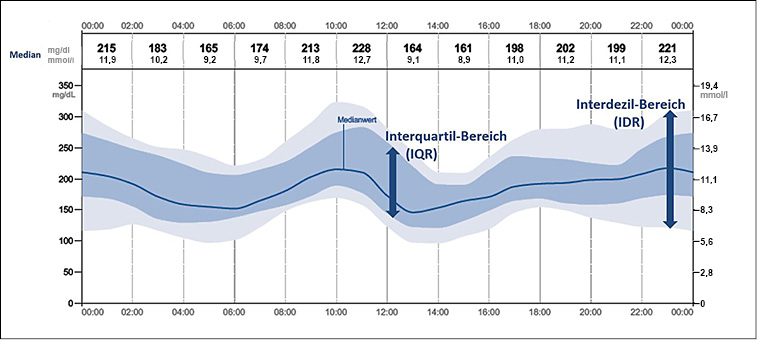 Abb. 1: Schematische Darstellung eines AGPs mit dem medianen Glukoseverlauf, dem Interquartil-Bereich (IQR; dunkelblau) und dem Interdezil-Bereich (IDR; hellblau) (jeweils aus mehreren Tagen) (6).
Abb. 1: Schematische Darstellung eines AGPs mit dem medianen Glukoseverlauf, dem Interquartil-Bereich (IQR; dunkelblau) und dem Interdezil-Bereich (IDR; hellblau) (jeweils aus mehreren Tagen) (6).
- Der dunkelblaue Bereich, der die Mediankurve umschließt, ist der Interquartil-Bereich (IQR). Darin liegen 50 Prozent aller gemessenen Glukosewerte.
- Der breitere, hier hellblau gefärbte Bereich ist der Interdezil-Bereich (IDR), der von der 10. und 90. Perzentile begrenzt wird. Darin liegen 80 Prozent der Messwerte.
Die Breite des IQR und des IDR zeigt, wie stark die Messwerte streuen – also die Glukosevariabilität (2, 6). Der Arzt und das Diabetesteam können also auf einen Blick den medianen Glukoseverlauf des Patienten über 24 Stunden und die Glukosevariabilität erkennen.
Darüber hinaus liefert das AGP Informationen zu weiteren wichtigen Parametern, wie dem mittleren Glukosewert und Bereichen mit hohen und niedrigen Glukosewerten. Aufgetretene Hypoglykämien können genau analysiert werden, da deren Anzahl, Dauer, Tiefe und Frequenz im ausgewählten Zeitraum mit den meisten der aktuellen Softwarelösungen bestimmt werden.
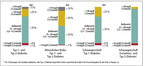
Wesentlich sind zudem die Zeit, die der Patient im Zielbereich verbracht hat (Time in Range, TIR). Laut internationaler und deutscher Empfehlung sollte dies für die meisten Menschen mit Diabetes auf 70 bis 180 mg/dl bzw. 3,9 bis 10,0 mmol/l eingestellt werden (Abb. 2) (1, 2). In einigen Softwareprogrammen kann die Glukosevariabilität zudem anhand des Parameters Variationskoeffizient beurteilt werden (2, 6).
 Abb. 2: Internationaler Konsens zu empfohlenen Zeitanteilen in unterschiedlichen Glukosebereichen (Richtwerte anhand von CGM-Daten) bei verschiedenen Patientengruppen (grüner Bereich: TIR) (mod. nach [8]).
Abb. 2: Internationaler Konsens zu empfohlenen Zeitanteilen in unterschiedlichen Glukosebereichen (Richtwerte anhand von CGM-Daten) bei verschiedenen Patientengruppen (grüner Bereich: TIR) (mod. nach [8]).
Die Grafiken können das Erkennen von Mustern und ihre Charakterisierung erleichtern. Auch der Mensch mit Diabetes erhält damit ein gut verständliches Bild seines Glukoseprofils. Es zeigt anschaulich, in welchen Bereichen die Therapie angepasst werden sollte bzw. noch Optimierungsbedarf besteht.
Strukturierte Analyse: die Vorgehensweise
Für die strukturierte Analyse des AGPs empfehlen Experten ein Vorgehen anhand der folgenden fünf Schritte, wobei die Reihenfolge eingehalten werden sollte (2, 6):
1. Wie sind Datenqualität und Datenquantität?
Qualität und Quantität der gewonnenen Daten sind eine wesentliche Basis für die Aussagekraft des AGPs. Optimal ist ein Auswertezeitraum über mindestens 14, aber höchstens 28 Tage. Das ist nötig, um eine relevante Aussage zu Mustern treffen zu können (7). Um Therapieentscheidungen ableiten zu können, sollte ein Zeitraum mit Standardbedingungen gewählt werden. Urlaub und Krankheit etwa sind Ausnahmen vom Alltag, in denen Glukosewerte trotz gleicher Insulindosis anders ausfallen können.
Das Nutzen des Messsensors über mehr als 70 Prozent der Auswertezeit gilt als ausreichend. Datenlücken können die Aussagekraft der Analyse schmälern. So entstehen zum Beispiel Lücken, wenn der Mensch mit Diabetes den Sensor zur selben Tageszeit zu selten scannt (z.B. aufgrund von Nachtruhe) oder wenn aus sonstigen Gründen keine Daten vorliegen (2).
Das Ambulante Glukoseprofil (AGP)
Das AGP wurde von Roger Mazze und David Rodbard (USA) entwickelt. Es wurde zunächst zur anschaulichen Darstellung von Glukoseselbstkontrollwerten entwickelt. Dies sollte die Mustererkennung im Glukoseprofil ermöglichen, um fundierte Therapieempfehlungen besser ableiten zu können. Sie testeten die Software bei 69 Diabetespatienten (Messgerätespeicher: 440 Werte mit Tag und Uhrzeit). Daraus erarbeitete die Software als typischen Tag der Patienten 24-Stunden-Grafiken zum medianen Glukosespiegel und zum Interquartil-Bereich – ein AGP. Die Ergebnisse wurden 1987 publiziert (18). Heute ist das AGP Standard zur Auswertung kontinuierlicher Glukosemessungen. Es liefert Daten, Analysen und Grafiken vom aktuellen Glukosewert über die glykämische Variabilität inklusive Variationskoeffizient bis zur Time in Range. Auch Hypoglykämien sind detailliert bewertbar. Diverse Diabetes-Datenmanagement-Lösungen sind auf dem Markt, z. B. Libre View (Abbott), Accu-Check Smartpix 3.0 (Roche), Dexcom Clarity (Dexcom), CareLink System (Medtronic), EasyView (Medtrum), Diabass (Mediaspects) und Diasend (Glooko). Neben Empfangsgeräten bieten die Hersteller der meisten Systeme Smartphone-Apps zur Visualisierung der Glukosedaten (z. B. Dexcom-G6-App [Dexcom], FreeStyle-LibreLink-App [Abbott], Guardian Connect [Medtronic], EasySense [Medtrum]). Bei einigen Systemen können z. B. Angehörige auf Wunsch ebenfalls die Daten auf ihr Smartphone gesendet bekommen und erhalten so Einsicht in die aktuellen Glukosewerte des Menschen mit Diabetes, z. B. mit der Dexcom-App, der Eversense-Now-App, der EasyFollow-App oder der LibreLinkUp-App.
2. Wie sind der Zielbereich und die Zeit im Zielbereich?
Für die Analyse im AGP wird der Glukose-Zielbereich des Patienten festgelegt und beurteilt. Nach internationalem Konsens und deutscher Expertenempfehlung sollte ein Zielbereich von 70 bis 180 mg/dl bzw. 3,9 bis 10,0 mmol/l festgelegt werden (1, 2). Ausnahmen hierfür gelten z. B. für die Schwangerschaft und geriatrische Patienten. Der Zielbereich umfasst präprandiale und postprandiale Werte. Der Zeitanteil, in dem sich der Patient im Zielbereich befindet, ist die TIR. Sie wird in Prozent angegeben (2, 6). Je höher der Anteil ausfällt, umso besser ist es.
Ein niedriger TIR-Anteil kann auf eine hohe Glukosevariabilität hinweisen. Hypo- und Hyperglykämien können ursächlich sein. Daher ist die Betrachtung der Zeit unter und über dem Zielbereich ebenfalls von hoher Bedeutung (TAB: Time above Range, TBR: Time below Range).
Für die TIR wurde zunächst von der deutschen Expertengruppe eine TIR von > 70 Prozent für erwachsene Menschen mit Typ-1- und Typ-2-Diabetes als Mindestanforderung empfohlen. Diese wurde nun auch international bestätigt (2, 8). Bei schwangeren Frauen und älteren Menschen mit Diabetes ist das Ziel individuell (2, 6).
Wichtig: Je kleiner der angestrebte Glukose-Zielbereich ist, umso schwieriger ist es, ihn einzuhalten. Den Patienten fällt es dann auch schwerer, die angestrebte Zeitspanne für die TIR zu erreichen. Der "Misserfolg" kann sie dann verunsichern (6).
3. Hat der Patient Hypoglykämien?
Im internationalen Konsens von 2017 (1) werden Hypoglykämien in drei Grade eingeteilt:- Level 1: < 70 – 54 mg/dl bzw. < 3,9 – 3,0 mmol/l,
- Level 2: < 54 mg/dl bzw. < 3,0 mmol/l,
- Level 3: schwere Unterzuckerung mit Fremdhilfebedarf.
- Häufigkeit (Frequenz),
- Dauer, angegeben in Minuten (min),
- erreichte Tiefe des Glukosewerts,
- Ereigniszahl im Zeitintervall (Periodizität).
Mit diesen Parametern können Hypoglykämien klassifiziert und in Stufen hinsichtlich des Schweregrads eingeteilt werden, wie in Tabelle 1 dargestellt. Die Tabelle zeigt weitere Empfehlungen der Experten zu der Frage, wann Therapieanpassungen bei Hypoglykämien empfohlen werden (6).
Allgemein gilt, dass das Verhindern von Hypoglykämien und insbesondere schweren Hypoglykämien zu den primären Zielen einer Therapieanpassung zählt (9). Hypoglykämien werden oft als belastend empfunden und können lebensbedrohlich sein. Gegenreaktionen und die Behandlung einer Hypoglykämie können die Glukoseverläufe destabilisieren und so die Glukosevariabilität erhöhen.
Eine weitere Folge kann sein, dass Menschen mit Diabetes höhere Werte in Kauf nehmen, um erneute Hypoglykämien zu verhindern. Zur Analyse der Hypoglykämien ist neben der Mustererkennung im AGP auch das Betrachten der Einzeltage ratsam.
4. Wie ist die Glukosevariabilität?
Im vierten Schritt der Analyse wird die Glukosevariabilität des Patienten bewertet. Dadurch lassen sich tageszeittypische Schwankungen aufdecken und spezifische Therapieanpassungen ableiten (Abb. 1) (6).
Die Glukosevariabilität steht für die Streuung der Glukosewerte – ein Parameter, über den der HbA1c-Wert keine Aussage zulässt (10). Es gibt wissenschaftliche Hinweise darauf, dass Glukoseschwankungen in Zusammenhang mit einem erhöhten Risiko für mikrovaskuläre Diabeteskomplikationen stehen. Endpunktstudien hinsichtlich dessen fehlen (2, 11 – 13). Der HbA1c-Wert ist zum heutigen Zeitpunkt hinsichtlich dieser Fragestellung der Parameter mit der höchsten Wertigkeit.
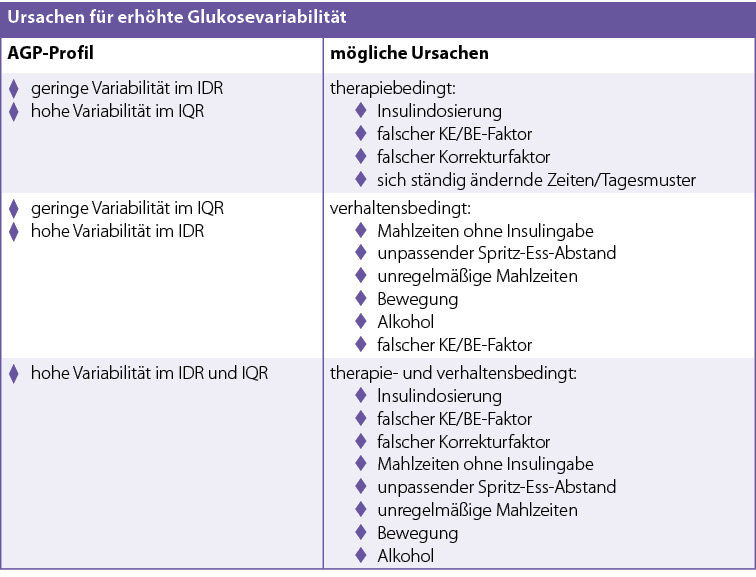
Die Glukosevariabilität kann mithilfe des IQR und des IDR differenziert betrachtet werden. Ein verbreiterter IQR weist in der Regel auf eine nicht passende Therapie hin (Tab. 2). Dagegen liegen die Ursachen für einen breiten IDR eher im Verhalten des Menschen mit Diabetes, wie ein unregelmäßiger Tagesablauf, das Auslassen oder Verringern eines Bolus oder ein falscher Spritz-Ess-Abstand (2, 6) (Tab. 2). Ein unregelmäßiger Tagesablauf kann jedoch sowohl zu einem breiteren IDR wie auch zu einem breiteren IQR führen (2).
Die Betrachtung des IQR und IDR ermöglicht somit in vereinfachter Form eine erste Entscheidung zu den möglichen Ursachen und einer entsprechenden Therapieänderung. Wichtig ist jedoch, dass das AGP der Mustererkennung dient. Für eine detaillierte Analyse und zur Entscheidung über Therapieanpassungen sollten neben dem AGP auch die Einzeltage betrachtet werden.
Für die Ursachensuche und fundierte Entscheidungen zu Therapieanpassungen ist es demnach wichtig, dass die Menschen mit Diabetes neben den automatisch gespeicherten Glukosewerten weitere Informationen in ihr elektronisches Tagebuch eintragen – etwa Menge und Zeit der Zufuhr von Kohlenhydraten und Insulin, Angaben zu Bewegung oder Krankheit (14).
Eine vollständige Dokumentation wird jedoch im Alltag nur vereinzelt dauerhaft durchgeführt, daher wird in Zukunft z. B. der Einsatz von Smart-Pens eine gute Therapieunterstützung darstellen. Smart-Pens dokumentieren die gespritzten Insulineinheiten automatisch in verschiedenen Software-Programmen.
Der Variationskoeffizient (VK) beschreibt die Schwankung der Glukosewerte um den Mittelwert. Hierbei konnte gezeigt werden, dass ein VK > 36 Prozent Instabilität mit einer erhöhten Wahrscheinlichkeit für Hypoglykämien bedeutet (15). Dieser Parameter steht bereits in einigen Programmen zur Verfügung.
5. Wie steht es um die Stabilität des Glukoseprofils?
Die Bewertung der Stabilität erfolgt anhand des Verlaufs der Mediankurve (16). Auch Höhe und Steilheit der Glukoseanstiege und -abfälle werden dabei berücksichtigt (6). Verläuft die Mediankurve gleichmäßig flach, ist die Stabilität zufriedenstellend. Steile Anstiege und Abfälle signalisieren Optimierungsbedarf. Das Verbessern der Stabilität des Glukoseprofils sollte jedoch erst erfolgen, wenn Hypoglykämien und die Glukosevariabilität reduziert wurden (2).
Nicht alles auf einmal angehen!
Generell gilt: Wenn die Analyse zeigt, dass Therapieanpassungen nötig sind, sollten nicht zu viele Punkte gleichzeitig angegangen werden. Experten empfehlen, bei jedem Termin zur Beurteilung des Glukoseprofils nur eine, höchstens zwei Änderungen durchzuführen (2, 6).
Das Fallbeispiel
Peter, 76-jähriger Rektor im Ruhestand, hat seit 33 Jahren Typ-2-Diabetes, sein Body-Mass-Index liegt bei 24,1 kg/m² und sein HbA1c- Wert bei 7,5 Prozent. Er führt eine intensivierte Insulintherapie mit Insulin aspart und Insulin detemir durch und nimmt zusätzlich Metformin 2-mal 1000 mg täglich (6). Sein AGP zeigt: Die Datenqualität ist gut (86 Prozent erfasste Sensordaten über 15 Tage). Der Zielbereich ist mit 70 bis 180 mg/dl bzw. 3,9 bis 10,0 mmol/l sinnvoll eingestellt und die Glukosewerte sind während 69 Prozent der erfassten Zeit (Ziel: > 70 Prozent) im Zielbereich.
Aber zwischen 6 und 8 Uhr morgens treten periodisch Hypoglykämien mit Werten < 54 mg/dl bzw. < 3,0 mmol/l auf (Abb. 3a), die Peter ohne CGM nicht bemerkt hätte – entsprechend der Expertenempfehlung besteht hier dringender Handlungsbedarf (Tab. 1). Bezüglich der Glukosevariabilität zeigt sich, dass der IQR von 10 bis 14 Uhr und der IDR von 10 bis 18 Uhr zu breit sind (Abb. 3a). Die Stabilität ist noch nicht beurteilbar.
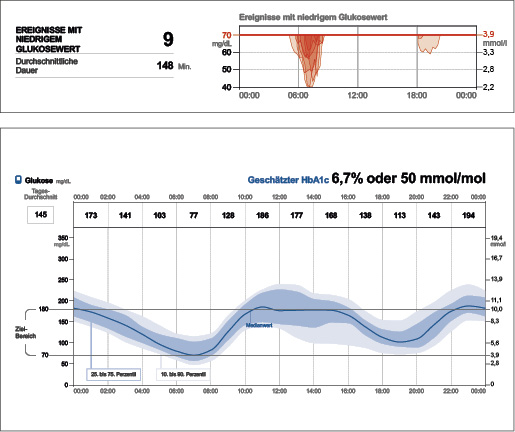 Abb. 3a: Der Fall aus der Praxis: Zwischen 6 und 8 Uhr treten periodisch Werte < 54 mg/dl bzw. < 3,0 mmol/l auf. Der Interquartil-Bereich ist von 10 bis 14 Uhr und der Interdezil-Bereich von 10 bis 18 Uhr zu breit (6).
Abb. 3a: Der Fall aus der Praxis: Zwischen 6 und 8 Uhr treten periodisch Werte < 54 mg/dl bzw. < 3,0 mmol/l auf. Der Interquartil-Bereich ist von 10 bis 14 Uhr und der Interdezil-Bereich von 10 bis 18 Uhr zu breit (6).
In diesem Fall wurden Insulindosis und Verhalten angepasst. Darunter sank die Hypoglykämiezahl bis zum nächsten Besprechungstermin stark. Da aber ein Ereignis noch eine Tiefe < 54 mg/dl bzw. 3,9 mmol/l erreichte (Abb. 3b), reduzierte Peter weiter seine späte Basalinsulindosierung. Außerdem wurden die KE-Faktoren morgens und abends erhöht. Eine erneute strukturierte Schulung wurde vereinbart.
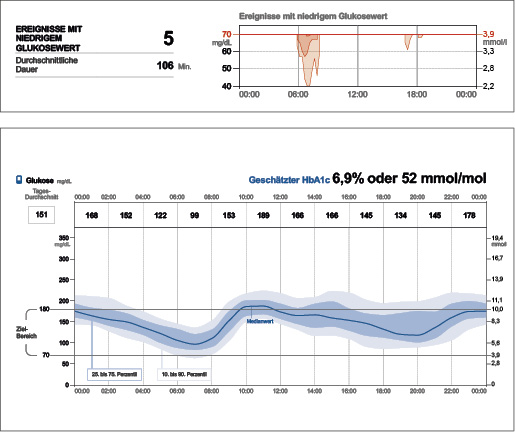 Abb. 3b: Nach Anpassen der Insulindosis sank die Hypoglykämiezahl, aber es gab noch einen Wert < 54 mg/dl bzw. 3,0 mmol/l. Peter reduzierte weiter seine späte Basalinsulindosierung, außerdem wurde er erneut bezüglich der Kohlenhydratberechnung geschult (6).
Abb. 3b: Nach Anpassen der Insulindosis sank die Hypoglykämiezahl, aber es gab noch einen Wert < 54 mg/dl bzw. 3,0 mmol/l. Peter reduzierte weiter seine späte Basalinsulindosierung, außerdem wurde er erneut bezüglich der Kohlenhydratberechnung geschult (6).
Ist die TIR eine Alternative zum HbA1c?
Der HbA1c-Wert liefert keine Informationen über die Glukosevariabilität und mögliche Zeiträume mit extrem hohen oder niedrigen Glukosewerten. Kann die TIR den HbA1c-Wert ersetzen? Das lehnt die Kommission Labordiagnostik in der Diabetologie der Deutschen Diabetes Gesellschaft (DDG) ab (17). Sie stuft die TIR jedoch als "sinnvolle und wertvolle Ergänzung" des HbA1c ein. Das entspricht der Bewertung im internationalen Konsens, der Anfang 2019 vorgestellt wurde (8).
Der HbA1c-Wert misst die Qualität der langfristigen Stoffwechselkontrolle und hat sich als Parameter zur Bewertung der glykämischen Kontrolle im Zusammenhang mit Folgeerkrankungen etabliert. Die TIR beschreibt hingegen die aktuelle Qualität der Stoffwechseleinstellung und bietet darüber hinaus wertvolle Informationen für fundierte Therapieentscheidungen, jedoch gibt es bislang wenige Studien, die einen Zusammenhang mit der Entwicklung von diabetesbezogenen Komplikationen beschreiben.
Die Kommission beschreibt, dass ein Zusammenhang zwischen der TIR und mikrovaskulären Komplikationen ermittelt werden konnte und zudem die TIR stark mit der Time below Range korreliere, aber kaum mit dem HbA1c-Wert. Das heißt: Für einen TIR-Wert kann der dazugehörende individuelle HbA1c-Wert erheblich variieren.
Unabhängig davon werten die Autoren der Kommission die TIR bei Patienten mit CGM ergänzend als sehr nützlich zur Beurteilung der Stoffwechsellage. Patienten mit mehr Zeit im Zielbereich haben weniger Hypo- und/oder Hyperglykämien, erklären sie. Auch kann die TIR bei Therapieumstellungen wichtige Informationen liefern. Von der TIR, so die Autoren der Kommission, könnten besonders Patienten mit starken Glukoseschwankungen und schwangere Frauen mit Diabetes profitieren.
Neue internationale Empfehlungen zu Zielwerten
Über die Zielwerte im AGP wurde oft diskutiert. Tadej Battelino (Slowenien) präsentierte im Februar 2019 bei einem Kongress in Berlin den neuen Internationalen Konsensus zur TIR. Im Juni wurde er in Diabetes Care publiziert (8) (Abb. 2). Der TIR-Zielbereich von 70 bis 180 mg/dl bzw. 3,9 bis 10,0 mmol/l stimmt mit dem der deutschen Expertengruppe überein und bestätigt ihn somit bei der Anwendung von CGM-Systemen (1, 2, 6, 8).
CME-Fortbildung – holen Sie sich Ihre Punkte!
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 10. Oktober 2019 einen Fragebogen zu diesem Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Diabetes-Forum, 2019; 31 (10) Seite 27-32