- wie man eine nichtalkoholische Fettleber diagnostiziert und wie deren Verlauf ist
- wie häufig eine nichtalkoholische Fettleber bei Übergewicht, Prädiabetes und Typ-2-Diabetes auftritt
- welche Mechanismen hauptsächlich an der Entstehung der nichtalkoholischen Fettleber beteiligt sind
- über welche Mechanismen die nichtalkoholische Fettleber die Entstehung von kardiometabolischen Erkrankungen fördert
- wie man die nichtalkoholische Fettleber therapiert.
Zusammenfassung
In den vergangenen 10 Jahren ist die nichtalkoholische Fettlebererkrankung (non-alcoholic fatty liver disease, NAFLD) als eine wichtige Erkrankung zunehmend in den Fokus getreten. Sie ist nicht nur ein bedeutender Risikofaktor für Lebererkrankungen, wie Leberzirrhose und das hepatozelluläre Karzinom, sondern auch Ursache und Komplikation von kardiometabolischen Erkrankungen, vor allem Typ-2-Diabetes. Entsprechend diagnostiziert man die NAFLD am häufigsten bei Patienten mit einem Typ-2-Diabetes. Das über die vergangenen Jahre angehäufte Wissen über die pathomechanistischen Zusammenhänge von NAFLD und Typ-2-Diabetes hat wegweisende Erkenntnisse gebracht, um beiden Erkrankungen vorzubeugen und sie besser zu therapieren.
Definition der NAFLD
Eine Verfettung der Leber kann viele Ursachen haben [Chalasani 2018]. Bei vermehrtem Alkoholkonsum kommt es durch das Zellgift Alkohol zunächst zu einer gesteigerten Fettansammlung in der Leber und bei weiterem übermässigem Alkoholkonsum zur Inflammation und Fibrose der Leber. In den allermeisten Fällen liegt aber eine nichtalkoholische Fettlebererkrankung (non-alcoholic fatty liver disease, NAFLD) vor. Somit werden bis heute die Fettlebererkrankungen in die alkoholische (alcoholic fatty liver disease, AFLD) und NAFLD eingeteilt. Weiterhin sind andere mögliche Ursachen für eine Fettleber, wie beispielsweise die langjährige Einnahme steatogener Medikamente oder bestimmte monogenetische Erkrankungen auszuschließen (Tabelle 1).
Diagnose der NAFLD
Zur einfachen Diagnose der Fettleber ist die abdominelle Ultraschalluntersuchung geeignet. Die Transiente Elastographie mit der Softwaremethode Controlled Attenuation Parameter (CAP) ist im Vergleich dazu präziser. Diese Methode ist jedoch relativ teuer und der Grad der Adipositas ist bei deren Anwendung mit in Betracht zu ziehen. Fettleberindizes sind wenig präzise und im Rahmen einer Zusatzinformation geeignet. Die Computertomographie sollte vor allem wegen der Strahlenbelastung nicht zur Diagnose der Steatose herangezogen werden.
Die Protonen-Magnet-Resonanz (MR)-Spektroskopie (MRS) und die MR-Bildgebung (MR Imaging, MRI) sind dafür viel besser geeignet, da sie sehr präzise Ergebnisse liefern und keine Strahlenbelastung mit sich bringen. Beide MR-basierte Verfahren sind allerdings relativ teuer. Die Leberbiopsie sollte zur alleinigen Quantifizierung des Grades der Steatose nicht herangezogen werden. Zur Diagnose der NASH ist die Bestimmunng der hepatischen Inflammation mittels Leberbiopsie das Goldstandardverfahren. Einzelne Biomarker oder Indizes aus Blutparametern, welche dafür vorgeschlagen wurden, haben sich bisher dafür noch nicht bewährt.
Zur Diagnose der Leberfibrose stellt die Leberbiopsie ebenfalls weiterhin den Goldstandard dar. Ultraschall- oder MR-basierte Techniken wie Transiente Elastographie und MR-Elastographie (MRE) sind genaue, aber auch teure, nicht-invasive Methoden zur Diagnose der Fibrose [Chalasani 2018, Stefan 2019, Rinella 2015].
Häufigkeit und Entwicklung einer NAFLD
Heutzutage liegt eine NAFLD weltweit bei mehr als 25 % der erwachsenen Bevölkerung vor [Younossi 2016, Younossi 2019]. Die NAFLD ist auch die häufigste Ursache für neu aufgetretene und undifferenzierte Lebererkrankungen. In einer US-Amerikanischen Studie, in der Patienten eine Leberbiopsie zur Abklärung der Lebererkrankung erhielten, hatten 75,7 % der Patienten eine NAFLD. Im Gegensatz dazu waren die Prävalenzen anderer Ursachen für die Lebererkrankungen verschwindend gering (Alkohol: 1,9 %, Hepatitis C: 0 %, Medikamente: 4,7 %, Hämochromatose: 0,5 %, Autoimmunhepatitis: 1,8 %, Hepatis B: 0 %, Primäre Billiäre Cholangitis: 1,2 %, Mobus Wilson: 0 %, Aplha-1-Antitrypsinmangel: 0 %) [Tapper 2017]. Etwa ein Drittel der Menschen mit NAFLD entwickelt im Laufe ihres Lebens eine nichtalkoholische Steatohepatitis (NASH). Während nur ein geringer Anteil (~ 4 %) der Menschen mit einer nichtalkoholischen Fettleber (NAFL) an einer Leberzirrhose erkrankt, ist dieser Anteil bei Menschen mit einer NASH mit ~ 20 % deutlich höher (Abbildung 1) [Chalasani 2018, Stefan 2019, Rinella 2015]. Vor allem die Fibrose, welche bereits bei einer NAFL vorliegen kann, geht mit einer erhöhten Gesamtmortalität und vor allem mit einer stark erhöhten Leberspezifischen Mortalität einher [Younossi 2019]. Die NAFLD verläuft chronisch und ist meist Folge von genetischen und verhaltensbedingten Ursachen. Während die genetisch bedingte NAFLD, z.B. aufgrund von Polymorphismen in den PNPLA3- und im TM6SF2-Genen, nicht mit einer Insulinresistenz und nicht mit einem erhöhten Risiko für die Entwicklung eines Typ-2-Diabetes einhergeht, und sogar mit einem etwas geringeren Risiko für Herz-Kreislauferkrankungen vergesellschaftet ist, assoziiert die verhaltensbedingte und durch eine Fettverteilungsstörung bedingte NAFLD sehr stark mit kardiometabolischen Erkrankungen [Stefan 2022].
NAFLD bei Übergewicht, Prädiabetes und Typ-2-Diabetes
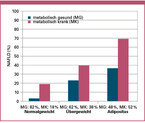
Bei Übergewicht und Adipositas liegt sehr häufig auch eine NAFLD vor [Stefan 2019, Stefan 2022]. Dieser Zusammenhang ist aber variabel, da es auch eine stoffwechselgesunde Adipositas gibt [Stefan 2008, Stefan 2011]. Vor allem beim Nachweis einer Hyperglykämie ist die Prävalenz der Fettleber deutlich erhöht. Entsprechend findet sich beispielsweise in der Tübinger Diabetes Familienstudie zur Pathogenese des Diabetes bei Übergewicht und Adipositas eine Prävalenz der NAFLD von 21 % und 42 %, wenn kein Prädiabetes vorliegt. Wurde aber ein Prädiabetes diagnostiziert, liegt die Prävalenz der NAFLD bei 46% und 70% [Stefan 2016]. Ähnliche Prävalenzen sind zu finden, wenn nicht nur die Hyperglykämie, sondern eine globale Stoffwechselstörung (metabolisch krank), bestehend aus Hyperglykämie, Dyslipidäme und arterieller Hypertonie, zur Stratifikation von Menschen mit Übergewicht und Adipositas herangezogen wird (36 % vs 23 % und 69 % vs 39 %) (Abbildung 2) [Stefan 2017]. Diesbezüglich müsste auch bei Normalgewicht und dem Vorliegen einer isolierten oder globalen Stoffwechselstörung eine erhöhte Prävalenz der Fettleber zu beobachten sein. In der Tat findet sich bei normalgewichtigen Menschen eine erhöhte Prävalenz der NAFLD, wenn ein Prädiabetes (11 % vs 3 %) oder eine globale Stoffwechselstörung (19 % vs 3 %, Abbildung 2) vorliegt [Stefan 2016, Stefan 2017]. Mein Kollege Kenneth Cusi von der Universität Florida, USA, und ich haben kürzlich Daten zur weltweiten Prävalenz der NAFLD, spezifisch bei Patienten mit Diabetes, zusammengetragen. Dabei wurde ersichtlich, dass eine NAFLD bei 55-70 %, eine NASH bei 30-40 % und eine höhergradige (F2-F4) Fibrose bei 12-20 % der Patienten mit Diabetes vorliegt [Stefan 2022b].
Ursachen einer NAFLD
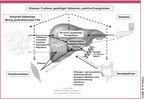
Diese Zahlen sind erschreckend hoch und somit stellt sich die Frage, was die Hauptursachen für die Entstehung der NAFLD, spezifisch bei Diabetes, sind. Eine Fettansammlung in der Leber wird durch eine positive Energiebilanz und v.a. durch einen vermehrten Konsum von Glukose, Fructose und gesättigten Fettsäuren hervorgerufen. Somit wird in der Leber die Neubildung von Fetten (de-novo Lipogenese und Triglyzeridsynthese) induziert. Diese Fehlernährung führt teils auch zu einer Verfettung der Skelettmuskulatur, womit eine Insulinresistenz mit daraufhin folgender Hyperglykämie hervorgerufen wird. Weiterhin führt diese Fehlernährung zur gestörten Funktion der pankreatischen Betazellen mit der Folge einer initialen Hyperinsulinämie, welche im weiteren Verlauf in einen relativen Insulinmangel übergehen kann. Die initiale Hyperinsulinämie fördert ebenfalls die Neubildung von Lipiden in der Leber. Weiterhin kann diese Fehlernährung im Fettgewebe eine subklinische Entzündung auslösen. Dieser Vorgang resultiert oft über eine Dysregulation von Zytokinen und Adipokinen und eine vermehrte Freisetzung von Fettsäuren in einer weiteren Verfettung der Leber. Liegt zusätzlich eine meist genetisch bedingte Störung der Lipidspeicherung im Unterhautfettgewebe mit Folge einer viszeralen Adipositas vor, so ist dieser Pathomechanismus noch mehr ausgeprägt. Diese Über- und Fehlernährung kann auch über eine Dysbiose des Darmes zur Freisetzung von Entzündungsmediatoren führen, welche, meist über eine zusätzlich gestörte Darmbarrierefunktion, die Leber schädigen (Abbildung 3) [Stefan 2019].
Metabolische Folgen der NAFLD
Weiterhin ist die NAFLD eine Ursache des Diabetes. Eine vermehrte Fettansammlung in den Hepatozyten führt in den meisten Fällen, nicht aber bei einer Fettleber, die durch genetische Veränderungen in den wichtigen "Fettlebergenen" PNPLA3 und TM6SF2 induziert wird, zu einer gestörten Insulinsignalübertragung. Als Folge davon ist die Glukoseproduktion der Leber erhöht, was einen Diabetes verschlimmern kann. Zusätzlich gibt die verfettete Leber in diesen Fällen auch vermehrt Hepatokine, wie Fetuin-A, Follistatin, Selenoprotein-P und andere Proteine in das Blut ab, was nach unseren Erkenntnissen und Ergebnissen vieler anderer Wissenschaftler die Insulinwirkung in der Leber und im Skelettmuskel hemmt und im Fettgewebe und in den Immunzellen eine subklinische Inflammation hervorruft, welche wiederum die Insulinresistenz verstärkt [Pal 2012, Stefan 2013a, Stefan 2013b, Stefan 2014]. Diese indirekten und direkten Effekte, vor allem des Hepatokins Fetuin-A, sind wahrscheinlich auch an der Entstehung von koronarer Herzkrankheit, Herzinsuffizienz, Atherosklerose und Niereninsuffizienz beteiligt. Weiterhin gibt es neue Erkenntnisse, dass Fetuin-A die Insulin-produzierenden Betazellen schädigt [Gerst 2017] (Abbildung 3). Schliesslich geht man zunehmend davon aus, dass die NAFLD und Diabetes, im Rahmen ihrer Interaktionen, neben ihren bekannten Effekten auf die Entstehung von kardiometabolischen Erkrankungen, auch bei der Entstehung eines schweren Verlaufs von infektiösen Erkrankungen, wie z.B. COVID-19, beteiligt sind [Stefan 2022b]. Diese Erkenntnis ist umso wichtiger, da Übergewicht und vor allem eine eingeschränkte metabolische Gesundheit, mit einem schwereren Verlauf von COVID-19 und mit einer reduzierten Wirkung der SARS-CoV-2-Schutzimpfung assoziiert ist [Stefan 2021, Stefan 2022a, Stefan 2022c].
Therapie der NAFLD bei Diabetes
Lebensstilintervention und bariatrische Chirurgie
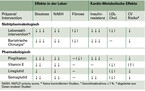
Bei Menschen mit Übergewicht oder Adipositas, die eine NAFLD haben, ist eine Gewichtsreduktion im Rahmen einer Lebensstilmodifikation der wichtigste Bestandteil bei der Therapie der Fettlebererkrankung. Eine Gewichtsabnahme von etwa 5 % führt bei den meisten Patienten bereits zu einer deutlichen Reduktion des Fettgehalts in der Leber [Stefan 2019, Stefan 2018]. Für eine Verbesserung der NASH bedarf es aber meist einer Gewichtsreduktion von mehr als 7 %. Eine Gewichtsabnahme von mehr als 10 % ist bei den meisten Patienten notwendig, um bei mehr als 90 % der Patienten eine Resolution der NASH und bei mehr als 45 % der Patienten eine Regression der Fibrose zu erzielen [Vilar-Gomez 2015]. Ist es aber schwierig eine deutliche Gewichtsabnahme zu erreichen, oder wird eine spezifische Diät gewünscht, ist eine Mediterrane Kost erfolgreich, um diese Ergebnisse, wenn gleich in geringerem Maße, zu erzielen [Stefan 2019]. In einer Studie, die schwer adipöse Menschen mit NASH untersuchte, die sich einer bariatrischen Operation unterzogen, trat bei 85 % der Patienten eine Resolution der NASH auf und bei 33 % eine Regression der Fibrose [Lassailly 2015]. Ein großer Vorteil einer deutlichen Gewichtsabnahme, aber auch einer Mediterranen Kost ist, dass nicht nur die Progression der NAFLD aufgehalten und teils die Leberhistologie verbessert werden kann, sondern dass sie mit einer Verbesserung der Insulinresistenz und der Dyslipidämie einhergehen. Besonders wichtig dabei ist, dass damit auch das kardiometabolische Risiko, welches bei der NAFLD stark erhöht ist, verringert wird (Tabelle 2).
Pharmakotherapie
Manchmal bringen die Maßnahmen zur Lebensstilintervention nicht den gewünschten Erfolg bei der Therapie der NAFLD. Das liegt teils auch an seltenen Verläufen einer NAFLD. Diesbezüglich behandelten meine Kollegen und ich am Universitätsklinikum Tübingen eine 45-jährige Patientin, die aufgrund einer Erkrankung an einem Malignen Melanom unter einer Immunkontrollblockade mit Nivolumab eine schwere NASH entwickelte, obwohl sie im Verlauf der Therapie 31 kg Körpergewicht verlor [Eigentler 2020]. Grund für dieses Ereignis war eine ausgeprägte und immunvermittelte Entzündung des Unterhautfettgewebes, mit der Folge der Entwicklung einer Lipodystrophie, eines Typ-2-Diabetes und einer Hyperlipidämie. In diesem Fall hat, neben vielen weiteren Versuchen der Therapie dieser Stoffwechselentgleisung, erst eine Therapie mit dem Thiazolidindion und PPARγ Agonist Pioglitazon, welcher auch zu einer Ausdehnung des Unterhautfettgewebes führt [Stefan 2020], den erhofften Erfolg in der Therapie der Fettlebererkrankung gezeigt [Eigentler 2020].
Bislang ist kein Medikament zur Therapie der NAFLD zugelassen. Pioglitazon wird jedoch von der American Association for the Study of Liver Diseases (AASLD) [Chalasani 2018] und den europäischen Fachgesellschaften European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD) und European Association for the Study of Obesity (EASO) [European Association for the Study of the Liver 2016] als Therapieoption bei NASH empfohlen, falls eine Lebensstilmodifikation nicht erfolgreich ist. Gleiches gilt auch für Vitamin E. Pioglitazon hat insulinsensitivierende und antiinflammatorische Eigenschaften und reduziert den Substratfluss zur Leber und Vitamin E hat antioxidative Eigenschaften. Beide Präparate wurden u.a. in der großen PIVENS Studie im Vergleich zu Plazebo bei Patienten ohne Diabetes getestet. Dabei waren beide Präparate sehr effektiv darin, den Fettgehalt der Leber zu vermindern und die Inflammation zu verbessern [Sanyal 2010]. Pioglitazon zeigte in einer Meta-Analyse aller verfügbaren randomisierten und kontrollierten Studien eine Verbesserung der hepatischen Fibrose bei Patienten mit fortgeschrittener Fibrose (Stadium F3-F4) [Musso 2017] (Tabelle 2). Beide Präparate sind mit Nebenwirkungen, die relativ selten auftreten, vergesellschaftet (Pioglitazon: Ödemneigung und Knochenbrüche, bis zu 5 % und Harnblasenkrebs bei 0,3 %; Vitamin E: Haemorrhagischer Schlaganfall, Prostatakrebs und erhöhte Gesamtmortalität). Bei Patienten mit Prädiabetes oder Typ-2-Diabetes war Pioglitazon kurzfrristig eingesetzt sehr effektiv zur Verbesserung der Steatose in der hepatischen Inflammation und langfristig auch zur Verbesserung der Fibrose [Belfort 2006, Cusi 2016].
Auch Glucagon-like Peptide1(GLP-1) Rezeptor-Agonisten sind effektiv und relativ nebenwirkungsarm bei der Therapie der NAFLD. Diesbezüglich hat in einer kleinen Studie mit NASH-Patienten, bei der etwa ein Drittel einen Typ-2-Diabetes hatte, der GLP-1-Rezeptor-Agonist Liraglutid eine höhere Rate einer Resolution der NASH als Plazebo gezeigt [Armstrong 2016]. In einer größeren Studie mit Einschluß von Patienten mit NASH, von denen 62% einen Typ-2-Diabetes hatten, zeigte der GLP-1-Rezeptor-Agonist Semaglutid ebenfalls stark positive Effekte hinsichtlich Verbesserung der Steatose und der hepatischen Inflammation [Newsome 2021]. In Deutschland sind sowohl Liraglutid in der Dosierung von 1,8 mg/Tag, als auch Semaglutid in der Dosierung von 1,0 mg/Woche zugelassen zur Therapie des Typ-2-Diabetes. Bei Patienten mit einem BMI ≥27 kg/m2 und zusätzlich Vorliegen von mindestens einem kardiovaskulären Risikofaktor, ist Liraglutid in der Dosierung von 3,0 mg/Tag, auch ohne Bestehen eines Typ-2-Diabetes, zur Therapie des Übergewichts/der Adipositas zugelassen.
Auch andere metabolisch aktive Substanzen sind teilweise effektiv bei der Therapie der NAFLD bei Menschen mit Typ-2-Diabetes. Dabei zeigen Metformin und Dipeptidylpeptidase-4-Inhibitoren keine oder nur geringe Effekte auf die Reduktion des Fettgehalts in der Leber. Solche Effekte sind beim Einsatz von SGLT-2-Inhibitoren ausgeprägter. Dabei ist die Wirkung vor allem bedingt durch die Reduktion der Hyperglykämie und durch die geringe Gewichtsabnahme [Stefan 2019]. Diese Präparate wurden bislang aber nicht hinreichend hinsichtlich möglicher Effekte auf den Verlauf der NASH oder der Fibrose getestet.
Fazit
Eine NAFLD diagnostiziert man sehr häufig bei Patienten mit einem Typ-2-Diabetes. Die NAFLD begünstigt das Entstehen eines Typ-2-Diabetes, sie wird aber in ihrer Progression stark durch die Hyperglykämie gefördert. Die NAFLD wurde zu einem wichtigen Bestandteil in der Prädiktion, Prävention und Therapie des Typ-2-Diabetes und von kardiovasulären Erkrankungen. Bei der Therapie der NAFLD muss eine gute und Pathogenese-orientierte Therapie des Diabetes sichergestellt werden. Erst danach ist es sinnvoll spezifische pharmakologische Therapien einzusetzen, um die fortgeschrittenen Formen der NAFLD, die NASH und die Fibrose, beim Vorliegen einer NAFLD und eines Diabetes zu therapieren.
Manuskript eingegangen: 11. Juli 2022
Manuskript angenommen: 18. Juli 2022
Erschienen in: Diabetes, Stoffwechsel und Herz, 2022; 31 (6) Seite 345-352