Herzinsuffizienz (HF) ist nach den Geburten in Deutschland die häufigste Krankenhauseinweisungsdiagnose. Etwa 2,5 Mio. Menschen oder 3,4 % der erwachsenen Bevölkerung sind davon betroffen, wobei die Erkrankung mit zunehmendem Alter deutlich häufiger auftritt. Bei den über 80-jährigen kann bei jedem Fünften die Diagnose konstatiert werden [1]. Die Prognose der HF ist mit einer durchschnittlichen 5-Jahres-Überlebensrate von 50 % schlecht und vergleichbar mit einigen Krebserkrankungen [2]. Dabei wird die Mortalität in erster Linie durch wiederholte Krankenhausaufenthalte aufgrund kardialer Dekompensationen bestimmt.
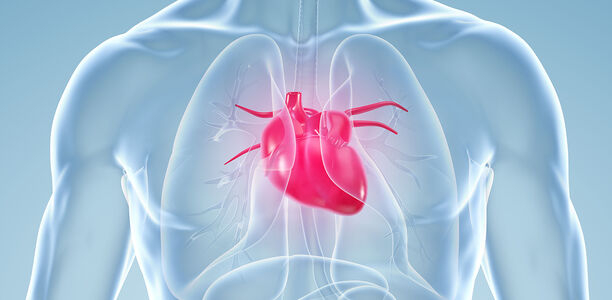
Bei der Herzinsuffizienz handelt sich nicht um eine einzelne Krankheitsentität, sondern um ein Syndrom oder einen Symptomkomplex, der Folge verschiedenster kardialer, nichtkardialer oder systemischer Erkrankungen sein kann. Pathophysiologisch ist die Herzinsuffizienz dadurch gekennzeichnet, dass das Herz nicht mehr in der Lage ist, bei normalen Füllungsdrücken zunächst unter Belastung, später in Ruhe, den Sauerstoffbedarf des Körpers zu decken [3]. Dies resultiert in dem typischen Symptom der Dyspnoe, aufgrund der rascheren Erschöpfung der Muskulatur, die bereits bei leichter Belastung auf einen anaeroben Stoffwechsel umstellen muss, der erhöhten Sauerstoffausschöpfung aus dem Blut, und der erhöhten Druckbelastung des linken Vorhofs mit konsekutiver pulmonalvenöser Kongestion. Aufgrund des erhöhten venösen Drucks und des verminderten venösen und lymphatischen Rückstroms entstehen periphere Ödeme, eine Leberstauung und gastrointestinale Beschwerden. Zum initialen diagnostischen Workup gehören neben Anamnese hinsichtlich kardialer Vorerkrankungen (auch in der Familie) und einem Ruhe-EKG die Bestimmung des NT-proBNP sowie eine transthorakale Echokardiographie [4]. Ein unauffälliges NT-proBNP schließt eine Herzinsuffizienz aus. Das BNP als Herzinsuffizienzmarker sollte nicht verwendet werden, da aktuelle Therapien in den BNP-Stoffwechsel eingreifen, das Peptid somit als Verlaufsparameter nicht mehr verwertbar ist. Durch die Echokardiographie können Hinweise auf die Entität der Herzinsuffizienz gewonnen als auch eine Einordnung in die aktuelle Klassifikation als Herzinsuffizienz mit reduzierter (EF < 40 %, HFrEF), mit mild reduzierter (EF 41–50 %, HFmrEF) und mit erhaltener systolischer LV-Pumpfunktion (EF > 50 %, HFpEF) vorgenommen werden (Abb. 1). Zur weiteren differentialdiagnostischen Abklärung haben sich in den letzten Jahren neben einer Herzkatheteruntersuchung mit Koronarangiographie, insbesondere bei eingeschränkter LV-Pumpfunktion, spezialisierte echokardiographische Techniken zur Beurteilung regionaler Myokardeigenschaften, wie der Gewebedoppler und das speckle tracking, das Kardio-MRT sowie bei bestimmten Fragestellungen das kardiale CT, PET sowie szintigraphische Verfahren etabliert. Aktuell in Einzelfällen eingesetzt, erlangt auch eine genetische Diagnostik insbesondere bei familiären dilatativen Kardiomyopathien (DCM) und Stoffwechselerkrankungen, wie dem M. Fabry, eine zunehmende Bedeutung.
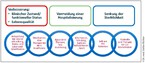
Therapieziele sind neben der Reduktion der Mortalität und der Hospitalisierungen aufgrund einer Verschlechterung der Herzinsuffizienzsymptomatik die Verbesserung der Lebensqualität und der körperlichen Belastbarkeit (Abb. 2). Um diese Ziele zu erreichen, ist ein multiprofessioneller und multimodaler Ansatz notwendig, der allerdings vielerorts noch nicht zum Standard gehört oder gerade im Aufbau befindlich ist. Zentraler Kern ist ein Herzinsuffizienzteam bestehend aus klinischen und ambulant tätigen Kardiologen, spezialisierten Herzchirurgen, Intensivmedizinern und Kardioanästhesisten, dem Hausarzt, speziell ausgebildeten Herzinsuffizienzpflegekräften, klinischen und ambulanten Physiotherapeuten, Psychologen, Palliativmedizinern und Sozialdiensten (Infokasten). Zunächst sollte, wenn möglich, die Grunderkrankung behandelt werden. So sollte eine Ischämie aufgrund einer koronaren Herzerkrankung durch eine interventionelle oder operative Revaskularisation beseitigt werden. In den letzten Jahren werden immer häufiger auch Hybridverfahren eingesetzt, die mittels minimalinvasiver operativer Revaskularisation der Vorderwandarterie ohne Herzlungenmaschine und perkutaner Koronarintervention der übrigen Stenosen schonender sind und eine schnellere Rekonvaleszenz des Patienten ermöglichen.

Herzinsuffizienz -Team Herzzentrum Bad Berka
Spezifische Therapien
Auch für weitere das Myokard betreffende Erkrankungen konnten in den letzten Jahren in Studien spezifische Therapien ihren Nutzen klar darlegen. Beispielhaft genannt seien hier die Therapie der ATTR-Amyloidose mit dem Transthyretin-Stabilisator Tafamides [5], der HOCM durch die alkoholbasierte Induktion eines kleinen Herzinfarktes im Bereich der Hypertrophie (TASH) oder medikamentös durch den Myosinmodulator Mavacamten [6] (aktuell noch im Zulassungsprozess der FDA), der kardialen Sarkoidose durch eine immunsuppressive Therapie und des M. Fabry durch eine Enzymsubstitution genannt. Neben diesen spezifischen Therapien profitieren Patienten mit HFrEF und HFm-rEF von einer Herzinsuffizienztherapie, die in verschiedene neurohumorale Regelkreise eingreift und in mehreren multizentrischen, randomisierten, doppelblinden Studien weltweit mit insgesamt mehreren hunderttausend Studienteilnehmern eine herausragende Reduktion von Mortalität und Krankenhaushospitalisation zeigen konnte.
Überlebenszeit kann verlängert werden
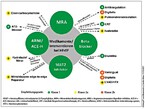
Hierzu zählen die RAAS-Blockade durch einen ACE-Hemmer oder AT1-Blocker und einem Mineralokortikoidrezeptorantagonisten, des BNP-Stoffwechsels durch einen Neprilisinhemmer [verfügbar ist hier der kombinierte AT1-/Neprilisinhemmer Sacubitril-Valsartan (Entresto®)], des sympatischen Nervensystems durch einen Betablocker sowie eine Hemmung des SGLT2-Rezeptors. Durch die Anwendung der "Big Four" [7], die für alle Patienten mit HFrEF und HFmrEF empfohlen sind, kann die mittlere Überlebenszeit um bis zu 12,7 Jahre verlängert werden [8]. Ergänzt wird diese Therapie durch individuelle Ansätze, die spezifische kardiale und nichtkardiale Komorbiditäten adressieren und in Abbildung 3 aufgeführt sind [7,9]. Seit der Veröffentlichung der MADIT-2-Studie 2002 [10], in der bei Patienten mit hochgradig eingeschränkter linksventrikulärer Pumpfunktion eine signifikante Reduktion des plötzlichen Herztodes (SCD) erreicht wurde, gehören Implantierte Cardioverter-Defibrillatoren (ICD )ebenfalls zur Therapiestrategie. Analysen der großen HF-Studien der letzten Jahre konnten jedoch zeigen, dass durch eine leitliniengerechte medikamentöse HI-Therapie die Häufigkeit des SCD deutlich abnahm. In der 2016 veröffentlichten Danish-Studie konnte bei über 70-jährigen Patienten mit DCM kein Einfluss des SCD auf die Gesamtsterblichkeit nachgewiesen werden [11], weshalb insbesondere bei diesen Patienten die Indikation zur primärprophylaktischen ICD-Implantation kritisch gestellt werden sollte. Neben der klinischen Beurteilung des Patienten kann der Fibrosegrad, bestimmt im Kardio-MRT, bei der Entscheidungsfindung hilfreich sein. Betrachtet man die immensen Fortschritte im Einsatz der Künstlichen Intelligenz (Synonyme: deep learning, machine learning) auch in der Medizin, ist hier auf der Grundlage der patientenindividuellen Parameter der Herzinsuffizienzstudien und auch von Real-World-Daten eine bessere Vorhersage von Risikopatienten für den SCD möglich, als dies aktuell durch die reine Betrachtung der Ejektionsfraktion (EF) der Fall ist. Eine bessere Selektion gefährdeter Patienten reduziert nicht nur die Kosten für die ICD-Therapie, sondern auch die durch inadäquate ICD-Therapien und Komplikationen durch die Operation, das Device und der Sonden (Infektion, Sondenbruch) bedingte Morbidität. Bereits jetzt existieren smarte Sensoren, die in sog. Wearables (klassische Beispiele sind Fitnesstracker und Smart-Watches) aber auch schon in Kleidung integriert sind und Vitalfunktionen aufzeichnen können. Denkbar ist hier durchaus, dass zukünftig diese smarte Kleidung ähnlich wie eine Life-Vest den Herzrhythmus analysieren und im Falle eines Kammerflimmerns selbstständig einen Schock abgeben kann.
Anspruchsvolle Diagnose
Die Diagnose und Therapie der HFpEF ist um einiges anspruchsvoller. Selbst durch Scoringsysteme, die klinische und spezielle apparative Parameter berücksichtigen, ist die Korrelation mit dem Goldstandard, einer Rechtsherzkatheteruntersuchung mit Bestimmung des pulmonalkapillären Verschlußdrucks (PCWP), nur bei 74 % [12]. Der Herzinsuffizienzsymptomatik können eine ganze Reihe kardialer und nichtkardialer Erkrankungen zugrunde liegen, die der "klassischen" Herzinsuffizienztherapie nicht zugänglich sind. Dies zeigt sich auch in den großen Herzinsuffizienzstudien, in denen bis auf eine Gewichtsabnahme bei massiver Adipositas, regelmäßigem supervidiertem Sport als einziges medikamentöses Therapiekonzept eine SGLT2-Hemmertherapie einen positiven Effekt auf Hospitalisation und Mortalität hatte [13]. Von einer Therapie mit einem Mineralorezeptorantagonist und Sacubitril/Valsartan profitierten nur Subgruppen [14,15]. Auch hier kann uns möglicherweise Künstliche Intelligenz helfen, die Patienten zu selektieren und einer personalisierten Behandlung zuzuführen.
Evidenzbasierte Therapieoptionen
Trotz der geschilderten, sehr gut evidenzbasierten Therapieoptionen und auch, wenn Patienten meist mit einer begonnenen Herzinsuffizienztherapie entlassen werden, wird nahezu jeder vierte Patient innerhalb von 30 Tagen und nahezu jeder zweite Patient innerhalb von zwei Monaten erneut hospitalisiert [16]. Die Gründe hierfür sind vielfältig. Als ein wesentlicher Aspekt kann jedoch die sektorale Trennung zwischen stationärer und ambulanter Versorgung in Deutschland mit Defiziten in der Weitergabe von Informationen und die fehlende lückenlose Betreuung genannt werden. Die digitale Patientenakte, durch die allen an der Versorgung Beteiligten (Ärzten) sämtliche Informationen, Diagnosen und Therapieentscheidungen zugänglich wäre, lässt seit über 20 Jahren auf sich warten. Auch ist in vielen Regionen ein fachärztlicher Termin innerhalb von 7–14 Tagen nach Entlassung, zur Kontrolle und Anpassung der Therapie und zur frühzeitigen Erkennung einer drohenden erneuten kardialen Dekompensation, nicht zu realisieren und viele Hausärzte greifen nur ungern in die teilweise sehr komplexe Therapie ein. Aber auch seitens der Patienten gibt es nicht selten Defizite in Kenntnis über die Erkrankung, die Notwendigkeit einer kontinuierlichen Einnahme der Medikation sowie der täglichen Messungen von Körpergewicht, Puls und Blutdruck, das Erkennen einer drohenden kardialen Dekompensation und Selbstmaßnahmen zur Gegensteuerung. An dieser Stelle sei das Herzinsuffizienzteam und hier besonders die Herzinsuffizienzpflegekräfte, die die Patienten schulen, ihnen weiterführende Informationen zur Verfügung stellen und einen niedrigschwelligen Kontakt im Falle von Fragen oder Unsicherheiten die Erkrankung betreffend, anbieten können erneut erwähnt; ebenso die Physiotherapeuten, die bereits während des stationären Aufenthaltes Sportübungen mit dem Patienten gemeinsam einüben und durchführen können, und der Sozialdienst, der Hilfe zur Neugestaltung des häuslichen Umfelds und Unterstützung bei der Organisation von Pflegediensten, spezifischen Rehabilitationsmaßnahmen oder bei der Änderung der Wohnsituation unterstützen kann. Die (ambulante) kardiale Rehabilitation nach Erstdiagnose einer Herzinsuffizienz oder nach kardialer Dekompensation wird in Deutschland leider ebenfalls noch deutlich weniger genutzt als z.B. in den skandinavischen Ländern. Alle diese Maßnahmen können und sollen dazu beitragen, dass der Patient eigenständig ohne kontinuierliche Kontrolle durch medizinisches Personal mit der Erkrankung gut leben kann und die Morbidität und Mortalität gesenkt wird (Selfcare, siehe Abb. 4).
Inneren Schweinehund überwinden
Dazu gehört neben der notwendigen verständlichen Information des Patienten, dem Empowerment, die Überwindung des inneren Schweinehunds und die Förderung "erwünschter" Verhaltensweisen, was durch Nudges angestoßen werden kann (Abb. 5). Apps, ie an die regelmäßige Einnahme der Medikation oder die Messung von Körpergewicht, Puls, Blutdruck etc. erinnern und in kleinen Portionen verständliche Fachinformationen vermitteln, können dies unterstützen. Die Nutzung der erhobenen Daten zu medizinischen Zwecken ist jedoch aufgrund datenschutzrechtlicher und versicherungstechnischer Gründe meist schwierig. Einige Gesundheitsapps befinden sich im Zulassungsprozess zur digitalen Gesundheitsanwendung (DiGA) oder sind bereits zugelassen, und somit zulasten der Krankenkassen zu rezeptieren, datenschutzrechtlich unbedenklich und sicher. In den USA besteht bereits seit einiger Zeit eine Kooperation zwischen Apple und den Mayo-Kliniken, wobei Apple-Health als digitale Gesundheits- (oder Kranken-)Akte genutzt wird, die sowohl den Mayo-Kliniken zur Verfügung steht als auch als Datencloud für Dokumente und Befunde, die von ambulanten und klinisch tätigen Ärzten genutzt werden kann [17].
Telemedizin
In Deutschland ist das in dieser Form aufgrund der Datenschutzverordnungen absehbar so nicht möglich. Allerdings gibt es auch hier bereits telemedizinische Anwendungen, die eine Aufzeichnung und Kontrolle auffälliger Parameter durch medizinisches Personal ermöglichen. Meist sind diese mit implantierten Devices wie Schrittmachern, ICDs oder Ereignisrecordern, aber auch einem implantierten Sensor zur Messung des pulmonalarteriellen Drucks verbunden. Durch Analyse der Daten, frühzeitiger Erkennung einer möglichen Verschlechterung der Herzinsuffizienz, Kontaktaufnahme zum Patienten und betreuenden Ärzten kann in vielen Fällen die Therapie ambulant angepasst und eine stationäre Aufnahme vermieden werden.
Zusammenfassung
Durch wissenschaftliche Fortschritte v.a. auf dem Gebiet der kardialen Bildgebung stehen in den letzten Jahren diagnostische Verfahren zur Verfügung, die die Differentialdiagnostik der Herzinsuffizienz deutlich verbessert haben. Zudem steht mit den "Big Four", bestehend aus einem Betablocker, einem Hemmer des RAAS-Systems (incl. Neprilisinhemmer), einem Mineralokortikoidantagonisten und einem SGLT2-Hemmer, eine Basistherapie zur Verfügung, die bei Patienten mit eingeschränkter LV-Pumpfunktion und Herzinsuffizienzsymptomatik die Lebensqualität bessert, Hospitalisation und Mortalität reduziert. Je nach kardialen und nicht-kardialen Komorbititäten gibt es zusätzliche Optionen, die individualisiert zur Anwendung kommen können. Durch die Bildung von Herzinsuffizienzteams und Netzwerken, in denen Ärzte verschiedener Professionen und nichtärztliches medizinisches Personal Hand in Hand zusammenarbeiten, kann die Erkrankung immer wieder reevaluiert und Therapien angepasst werden. Informationsvermittlung durch Schulungen und Anreize, schädliches Verhalten abzulegen und förderliche Verhaltensweisen in den Alltag zu integrieren, stärkt das Selfcare des Patienten und kann dazu beitragen die individuelle Prognose und Lebensqualität zur verbessern. Sowohl Therapieentscheidungen als auch die Förderung des Selfcare werden künftig durch Algorithmen Künstlicher Intelligenz, Telemonitoring, Apps und Wearables unterstützt werden.
Wichtige Abkürzungen:
HF: Herzinsuffizienz
LV: linker Ventrikel
EF: Ejektionsfraktion
ATTR: Spezifische Form der Amyloidose mit Ablagerung von Transthyretintetrameren
HOCM: hypertroph obstruktive Kardiomyopathie
DCM: dilatative Kardiomyopathie
SCD: plötzlicher Herztod
ICD: implantierbarer Kardioverter-Defibrillator
HFpEF: Herzinsuffizienz mit erhaltener (preserved) systolischer Pumpfunktion
HFmrEF: Herzinsuffizienz mit mild reduzierter systolischer Pumpfunktion
HFrEF: Herzinsuffizienz mit reduzierter Pumpfunktion
Dr. med. Stefan Richter, MHBA
Erschienen in: Diabetes-Forum, 2022; 34 (10) Seite 42-47

![Bild: Dr. med. Stefan Richter, adaptiert nach [4]](/_storage/asset/2453226/storage/kirchheim:article-0_75-1/file/359293576/28720991.jpg)

![Bild: Dr. med. Stefan Richter, adaptiert nach [18]](/_storage/asset/2444304/storage/kirchheim:article-0_75-1/file/359293564/28720986.jpg)