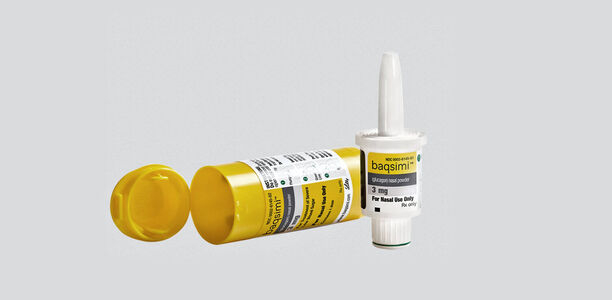
Die EU-Kommission hat Baqsimi in der Europäischen Union zugelassen: Das nasale Glukagon ist angezeigt zur Behandlung schwerer Hypoglykämie bei Erwachsenen, Jugendlichen und Kindern ab 4 Jahren mit Diabetes mellitus.¹ Für Betroffene steht damit eine neue, schnell wirksame Notfalloption¹ zur Verfügung, die von hilfeleistenden Personen auch ohne Schulung leicht appliziert werden kann.² ³
Menschen mit Typ-1-Diabetes, aber auch Menschen mit Typ-2-Diabetes, die mit Insulin, Sulfonylharnstoffen oder Gliniden behandelt werden, haben ein erhöhtes Risiko für das Auftreten schwerer Hypoglykämien.⁴ Während Betroffene leichte Hypoglykämien durch die Zufuhr von schnell wirkenden Kohlenhydraten in der Regel selbst behandeln können, benötigen sie bei schweren Hypoglykämien die Hilfe von Menschen aus ihrem persönlichen Umfeld oder von medizinischem Personal.⁵
Im Vergleich zu leichten Hypoglykämien sind schwere Unterzuckerungen sehr seltene Ereignisse, können aber trotz intensiver Schulung und Beachtung aller Empfehlungen nicht immer vermieden werden. Die bisher verfügbaren Notfallkits für schwere Hypoglykämien enthalten ein intramuskulär zu verabreichendes Glukagon, das die Freisetzung von Glukose aus der Leber stimuliert. Die Vorbereitung und Applikation einer Glukagon-Spritze gelingt jedoch auch geschulten Hilfspersonen in einer solchen Stresssituation oft nicht.² ³
Einfache Anwendung und Lagerung
Mit der Zulassung von Baqsimi, dem ersten nasal anwendbaren Glukagon, kann diese therapeutische Lücke nun geschlossen werden. Das Pulver wird mit Hilfe eines Einzeldosisbehältnisses einfach in ein Nasenloch verabreicht und dann passiv über die Nasenschleimhaut aufgenommen. Dies funktioniert auch bei einer erkältungsbedingt verstopften Nase und unabhängig davon, ob gleichzeitig ein schleimhautabschwellendes Spray verwendet wurde oder nicht. Das kleine, gebrauchsfertige Einzeldosisbehältnis enthält 3 mg Glukagon, das bei Raumtemperatur gelagert werden kann. Baqsimi kann so ständig mitgeführt oder an häufig besuchten Aufenthaltsorten deponiert werden.¹
Die Information, wo das Medikament zu finden ist, könnte in einen Notfallplan aufgenommen werden, den Arzt und Patient gemeinsam erarbeiten. Ein solcher Plan für die Bewältigung einer schweren Hypoglykämie kann den Betroffenen und ihrem persönlichen Umfeld ein sicheres Gefühl vermitteln, gut auf den Fall der Fälle vorbereitet zu sein.
Klinische Studien belegen erfolgreiche Anwendung
Die Zulassung von Baqsimi basiert auf klinischen Studien, in denen Wirksamkeit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik bei Erwachsenen und Kindern ab 4 Jahren mit der von 1 mg intramuskulärem Glukagon verglichen wurde. Hierbei war das nasale Glukagon in allen drei Studien dem intramuskulären nicht unterlegen.⁷ ⁸ ⁹ Anwendungsstudien zeigten darüber hinaus, dass nasales Glukagon in einer simulierten Notfallsituation schneller und einfacher anwendbar ist als Glukagon zur Injektion.² ³ So konnten etwa in einer Studie nur 16 % der zuvor im Gebrauch unterwiesenen und keiner der ungeschulten Teilnehmer intramuskuläres Glukagon erfolgreich vorbereiten und injizieren, während eine erfolgreiche Applikation von Baqsimi in beiden Gruppen über 94 bzw. 93 % der Probanden gelang.³
„Schwere Hypoglykämien können lebensbedrohliche Konsequenzen haben und müssen daher rasch behandelt werden. Auf eine solche Situation nicht ausreichend vorbereitet zu sein, ist für viele Patienten, aber auch für ihre Angehörigen, oft eine große Belastung“, weiß Dr. Dorothee Mechau, Senior Direktorin der Business-Unit Diabetes bei Lilly Deutschland. „Wir freuen uns, dass wir mit Baqsimi® nun ein wirksames Notfallmedikament zur Verfügung stellen können, das in einer solchen Stresssituation einfach anwendbar ist und damit Menschen mit Diabetes sowie ihrem persönlichen Umfeld mehr Sicherheit gibt, für den Fall der Fälle vorbereitet zu sein.“
Baqsimi wurde zuvor bereits in den USA und Kanada zur Behandlung schwerer Hypoglykämien bei Menschen mit Diabetes ab 4 Jahren zugelassen. Mit der Zulassung durch die EU-Kommission kann es nun auch in allen 28 Mitgliedsländern der Europäischen Union zum Einsatz kommen. Die Einführung auf dem deutschen Markt ist für den 16. März 2020 vorgesehen.
Quelle: Pressemitteilung von Lilly Diabetes