Einleitung
Aus Überlegungen zur physiologischen Regulation des Glukosestoffwechsels ergibt sich für Patienten mit Typ-1-Diabetes, dass idealerweise die Pankreasfunktion nachgebildet werden müsste. Bei den aktuellen technischen AID-Systemen (AID: automated insulin delivery) gelingt das jedoch nur auf Umwegen, denn einige Modifikationen unterscheiden sich erheblich von der Regulation bei Stoffwechselgesunden.
Der Hauptunterschied ist die Abgabe des Insulins ins subkutane Gewebe und daraus folgend dessen verzögerte Wirkung. Außerdem, anders als im stoffwechselgesunden Organismus, wirkt es zunächst peripher und erst danach hepatisch. Die Bremsung der hepatischen Glukoseausschüttung nach Insulingabe erfolgt also immer zu spät. Weiterhin wird die Wirkung des zugeführten Insulins durch dessen Pharmakodynamik bestimmt, nicht wie im natürlichen Fall über den Glukosereiz. Eine physiologische Insulinwirkung ist so folglich nicht gegeben. Ein weiterer Unterschied zum stoffwechselgesunden Organismus besteht darin, dass auf niedrige bzw. abfallende Glukosewerte nur dann rasch und zuverlässig reagiert werden kann, wenn zusätzlich zur subkutanen Insulininfusion eine Glukagoninfusion realisiert wird. Bei monohormonellen technischen Systemen ist dies nicht vorgesehen, sodass die Glukosekonzentration möglichst zuverlässig vom Hypoglykämiebereich ferngehalten werden muss. Es existieren aber Entwicklungen für bihormonelle Systeme (Inreda von Inreda Diabetic BV/Niederlande, iLet von Beta Bionics Inc./USA). Weiterhin gibt es mittlerweile stabile flüssige Glukagonformulierungen (Dasiglucagon, im Zulassungsverfahren). Die Algorithmen für die Insulinabgabe in bihormonellen Systemen unterscheiden sich dabei nicht wesentlich von monohormonellen Systemen. Der Unterschied besteht in der besseren Kompensation bei gefährlich fallenden Glukosewerten. Allerdings ist deren Marktzulassung erst zu erwarten.
Bei Verwendung der aktuell verfügbaren subkutan positionierten Glukosesensoren existiert insbesondere bei Glukoseanstiegen und -abfällen eine teils deutliche Abweichung zwischen der gemessenen Glukosekonzentration in der interstitiellen Flüssigkeit und der im Blut. Mehrere Fakten bekräftigen die Messung im Interstitium: Die physiologische Messung der Glukose erfolgt in den Betazellen und damit in einem durch den interstitiellen Fluss genährten Gebiet, nicht in den nebenan liegenden Blutgefäßen [Siegmund 2017]. Weiterhin ist das Blut "nur" das Transportsystem. Von der Glukoseaufnahme der Blutzellen abgesehen findet der Metabolismus in der Peripherie statt. Es wird kontrovers diskutiert, ob man die interstitiellen Glukosewerte in Blutglukosewerte umrechnen sollte, um das gewohnte Therapiemanagement auf Grundlage der Blutglukose beibehalten zu können. Dies geschieht zumindest zum Teil bei den CGM-Systemen, die auf Blutglukosewerte kalibriert sind. Diese Tatsache bedeutet, dass CGM-Systeme einen gemittelten Hybridwert ausgeben aus gemessener Glukose in der interstitiellen Flüssigkeit und verschiedenen Berechnungen in den Systemen. Das Diabetesmanagement funktioniert über die subkutane Glukosemessung mit den fortgeschrittenen aktuellen Systemen hinreichend gut [Ajjan 2018, Bailey 2015]. Daher ist es auch möglich, unter Zuhilfenahme prädiktiver Algorithmen zur Insulindosisberechnung bereits jetzt mit den aktuellen Sensoren eine automatisierte Insulinabgabe zu realisieren. Bei Hybrid-AID-Systemen mit automatischer basaler Insulinabgabe, bei denen aber der Bolus zu einer Mahlzeit weiterhin von den Patienten manuell abgegeben wird, belegen das nicht nur Studien [Bergenstal 2016, Petrovski 2020], sondern auch die tägliche Praxis. Im Gegensatz dazu werden bei einem vollständigen AID-System auch die Boli zu den Mahlzeiten automatisch abgegeben. Ein Glukoseanstieg zu einer Mahlzeit lässt sich im Blut ca. 12 Minuten (Standardmahlzeit) früher feststellen (mit Blutglukosemessung) als im Interstitium [Kovatchev 2009]. Von subkutan messenden Sensoren wird der Anstieg den Algorithmen also erst später bekannt gegeben. Das ist bei einem Voll-AID-System zu berücksichtigen.
In gleichem Maß betrifft das auch den Abfall der Glukosekonzentration. Fallen nach der Mahlzeit die Glukosewerte wieder, so tritt der niedrigere Wert beim CGM erst ca. 17 Minuten später auf [Kovatchev 2009]. Auch hier bekommt der Algorithmus die Information verzögert mitgeteilt. Das heißt, die Herausforderung besteht im Errechnen der abzugebenden Insulindosis auf Grundlage der aktuellen und zukünftigen Glukosewerte. Weil die Regulation der Glukosekonzentration auf einen breiten Zielbereich erfolgt (70 – 180mg/dl bzw. 3,9 – 10,0mmol/l), ist diese Aufgabe aber lösbar. Bei einem Hybrid-AID-System erfolgt das über manuelle Eingaben/Angaben für die Algorithmen, bei zukünftigen Voll-AID-Systemen berücksichtigen das die Algorithmen selbst.
Allgemeine Grundlagen von Algorithmen zur Steuerung der Insulinabgabe
Zuverlässige Hardware für die AID-Systeme ist seit Mitte der 2010er-Jahre gegeben, seitens der Insulinpumpen sowieso, aber auch seitens weitgehend zuverlässig messender Glukosesensoren. Auch bezüglich der Algorithmen für die Insulinabgabe wurden verschiedene Entwicklungen abgeschlossen, sodass seit 2016 mit der MiniMed™ 670G (Medtronic) und seit 2019 mit der t:slim X2™ mit dem zugehörigen Control-IQ™ (Tandem) zwei kommerzielle Hybrid-AID-Systeme auf dem internationalen Markt sind. Mit dem Algorithmus DBLG1™ von Diabeloop, der sich mit verschiedener Hardware nutzen lässt, hat seit 2018 eine separate AID-Software die CE-Kennzeichnung (das System ist noch nicht verfügbar). Bisher nutzte Diabeloop als Hardware die Insulinpumpe von Kaleido und als Glukosesensor den Dexcom G6®. Durch eine im Dezember 2020 angekündigte Kooperation mit dem Unternehmen Roche wird der Algorithmus DBLG1™ von Diabeloop mit der Accu-Chek® Insight kombiniert. Ähnlich verhält es sich mit dem an der Universität Cambridge entwickelten Stand-alone-Algorithmus CamAPS® FX, den sich Selbstzahler als App für 70 Pfund/Monat auf ihr Android-Smartphone laden können. Als Hardware dienen hier aktuell die Insulinpumpe DANA RS von Sooil und der Glukosesensor Dexcom G6®.
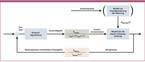
Ein Algorithmus soll nicht nur die Insulinabgabe aufgrund des aktuellen Glukosewerts steuern, er soll darüber hinaus die Glukosekonzentration über den nachfolgenden Zeitraum von zwei bis drei Stunden vorausberechnen und berücksichtigen. Dabei muss erreicht werden, dass neben der Glukosekonzentration CGluk auch die Insulinkonzentration CIns entsprechend reguliert wird. Bei den technischen Systemen laufen wegen der subkutanen Insulinzufuhr alle Prozesse der Regelstrecke mit einer zeitlichen Verzögerung ab. Das bedeutet, dass zusätzlich zur gemessenen Glukosekonzentration verschiedene Einflussfaktoren auf die glykämische Regulation in den Berechnungsmodellen zu berücksichtigen sind, wie die zeitabhängige Resorption von Kohlenhydraten und Insulin und die Wirkung von noch im Organismus befindlichem Insulin (Abb. 1).
Die den verschiedenen Algorithmen zugrunde liegenden Modelle drücken sich vom Grundansatz her als Differenzialgleichungen aus, welche die Insulininfusionsrate in Abhängigkeit von der Zeit und der sich ändernden Glukosekonzentration berechnen. Im Anhang ist dazu als Beispiel die Herleitung der Gleichungen für den PID-Algorithmus dargestellt. Als Anfangsbedingungen gehen die aktuellen Glukosewerte ein. Randbedingungen sind die Insulinempfindlichkeit, die Insulinwirkung und ggf. Zusatzinformationen über Kohlenhydrataufnahme, körperliche Aktivität und Stress. Auf jeden Fall müssen die in den Gleichungen enthaltenen Parameter angepasst werden. Diese lassen sich aus der retrospektiven Betrachtung des Metabolismus ermitteln, müssen aber eingesetzt werden, um den zu erwartenden Glukoseverlauf auch vorausberechnen zu können. Die neuesten Systeme basieren auf selbstlernenden Algorithmen, welche die Parameter individuell und situationsabhängig anpassen, was Methoden der künstlichen Intelligenz erfordert.
In den verschiedenen Arbeitsgruppen sind unterschiedliche Algorithmen entwickelt worden, zum Beispiel:
- der PID-Algorithmus (Proportional-Integral-Derivativ) [Steil 2006],
- der MPC-Algorithmus (Model Predictive Controller) [Bequette 2013, Elleri 2012, Hovorka 2010], inklusive Modifikationen [Quemerais 2014],
- der HPA (Hypoglycaemic Predictive Algorithm) [Dassau 2008],
- der Fuzzy-Logik-DreaMed-Algorithmus (auch als MD-Logic bezeichnet) [Atlas 2010, Nimri 2012, Nimri 2014],
- neuronale Netzwerke [Pérez-Gandía 2010].
Mathematisch berechnen alle Algorithmen die Insulininfusionsrate in Abhängigkeit von der Zeit und der sich ändernden Glukosekonzentration. Die Unterschiede in den Algorithmen liegen in der Art und Weise, wie verschiedene Parameter (Insulinempfindlichkeit, Insulinwirkung, Kohlenhydrataufnahme, körperliche Aktivität, Stress usw.) berücksichtigt und inwieweit prädiktive Glukosewerte errechnet werden. Die beim Einsatz in diversen AID-Projekten mit den verschiedenen Modellen und Algorithmen erzielten klinischen Ergebnisse sind aber durchaus vergleichbar [Benhamou 2019, Bergenstal 2016, Brown 2019].
PID-Algorithmus beim Einsatz im System MiniMed™ 670G
Weil sich das System MiniMed™ 670G bereits seit 2016 in den USA und seit 2019 in Europa im Einsatz befindet, soll der darin wirksame Algorithmus näher beschrieben werden. Außerdem gibt es als Besonderheit einen Sicherheitsalgorithmus.
Die MiniMed™ 670G besitzt zwei Optionen: den "manuellen Modus" und den "Auto-Modus". Im manuellen Modus erfolgt die Abgabe des Insulins für den basalen Insulinbedarf auf Grundlage eines fest programmierten Basalratenprofils. Die Mahlzeiten- und Korrekturboli werden manuell per Knopfdruck abgegeben. Gekoppelt mit einem CGM-System kann damit eine sensorunterstützte Pumpentherapie (SuP) durchgeführt werden.
Der "Auto-Modus" bezieht sich nur auf die basale Insulinabgabe; der Mahlzeiten- und Korrekturbolus wird nach wie vor manuell abgegeben. Aber anders als bisher wird die basale Insulinabgabe an den aktuellen Glukoseverlauf angepasst (adaptive Basalabgabe). Das bedeutet, aus dem durch den Glukosesensor gemessenen Glukosewert mithilfe eines Algorithmus eine basale Insulindosis so zu berechnen, dass ein fest vorgegebener Glukosezielwert von 120mg/dl (6,7mmol/l) erreicht wird.
Der dabei verwendete PID-Algorithmus [7] (siehe auch Anhang 1) ist, wie alle anderen Algorithmen auch, die Umsetzung des in Abbildung 1 skizzierten Schemas eines über Glukosewerte gesteuerten Regelkreislaufs. Der PID-Algorithmus ist gut bekannt aus der Regelungstechnik, z. B. zur Temperatursteuerung einer Heizung. Liegt bei einer solchen die Raumtemperatur auf oder in der Nähe des eingestellten Zielwerts, so wird eine proportionale Energiemenge zu deren Erhaltung abgegeben. Ist die Raumtemperatur über dem Zielwert, so erfolgt keine Energiezufuhr. Einige Grad unter dem Zielwert wird dagegen eine ansteigende Energiemenge abgegeben (Integral), weit unter dem Zielwert ist diese dann groß (Derivativ), also ein kräftiger Wärmemengenimpuls. In der gleichen Weise arbeitet der PID-Algorithmus zur Insulinabgabe: Ist die Glukosekonzentration in der Nähe von 120mg/dl (6,7mmol/l), erfolgt eine proportionale Insulinabgabe, bei Werten > 120mg/dl ist diese ansteigend, bei Werten >> 120mg/dl derivativ und bei abfallenden Werten < 120mg/dl wird gar kein Insulin abgegeben. Diese drei Anteile sind parallel geschaltet, arbeiten also gleichzeitig mit den der jeweiligen Situation angepassten Anteilen.
Zur Realisierung des Algorithmus wird vom CGM-System alle 5 Minuten ein Glukosewert übertragen und daraus ein Minibolus berechnet. Die Ermittlung der Bolusgröße kann plausibel gemacht werden mit der Berechnung eines Korrekturbolus, wie es allgemein in der Insulintherapie üblich ist. Der Bolus ergibt sich zunächst aus der Differenz von aktuellem Glukosewert und Zielwert, multipliziert mit dem Faktor der Insulinempfindlichkeit (eine Einheit Insulin senkt den Glukosewert um xxmg/dl). Bei einem Korrekturbolus ist noch zu beachten, wie lange das Insulin wirkt (das ergibt sich aus dessen Pharmakodynamikkurve) und wie viel aktiv wirkendes Insulin noch vorhanden ist. Folglich muss dem Algorithmus die Insulinwirkdauer als Größe für die Berechnungen bekannt sein. Die Wirkdauer muss in das System eingegeben werden (z.B. 3 – 4 Stunden bei Erwachsenen). Die hinterlegte Insulinwirkkurve ist systemspezifisch und damit auch die individuell zu programmierende Insulinwirkdauer. Neben der Insulinwirkdauer muss die Insulinsensitivität bekannt sein. Diese errechnet der Algorithmus, indem er den Tagesinsulinbedarf (TIB) der letzten 6 Tage mittelt und die 1800er-Regel (bei mg/dl) bzw. die 100er-Regel (bei mmol/l) anwendet. Die Zahl 1 800 kommt aus der Pharmakologie und gilt für kurzwirksame Insulinanaloga. Die Insulinsensitivität (IS) errechnet sich nun aus dem Quotienten IS = 1800/TIB. Damit rechnet der Algorithmus aus, wie viel Insulin zum Erreichen des Glukosewerts von 120mg/dl nötig ist. Dabei berücksichtigt er die Insulinwirkdauer und die dafür bekannte Wirkkurve. Die Wirkdauer teilt er in 5-Minuten-Abschnitte, weil ja alle 5 Minuten ein Mikrobolus abgegeben wird. Ist z.B. eine Insulinwirkdauer von 3 Stunden eingestellt, so wären das 36 Mikroboli in dieser Zeit (alle 5 Minuten). Zur Abgabe gelangt nun aber nur der erste Mikrobolus, denn 5 Minuten später wird diese Rechnung erneut vorgenommen. Weiterhin wird die Wirkung des vorher abgegebenen Insulins berücksichtigt, so wie das z.B. beim Bolusrechner "BolusExpert" der Fall ist.
Die Patienten bzw. die Diabetesteams müssen also die Insulinwirkdauer einstellen, als einen von nur zwei einzustellenden Parametern. Wichtig ist zu erwähnen: Wird die Insulinwirkdauer kürzer eingestellt, sind die Mikroboli größer, der Algorithmus also "aggressiver". Weiterhin ist wichtig zu wissen: Da der Algorithmus eine gewisse Toleranz bei den eingegebenen Werten akzeptiert, kann er auch tageszeitabhängige Unterschiede in der Insulinempfindlichkeit ausgleichen.
Der zweite einzustellende Parameter ist der tageszeitabhängige Kohlenhydratfaktor, also wie viel Insulin eine Kohlenhydrateinheit kompensiert. Dieser Faktor ist primär für das Management des Mahlzeitenbolus wichtig, wofür der Patient manuell die Kohlenhydratmenge in Gramm eingibt. Die Pumpe berechnet daraufhin den Bolusvorschlag, der abgegeben werden sollte. Es lassen sich bis zu 8 solcher Faktoren über den Tagesverlauf einstellen. Sekundär hat dieser Faktor auch Auswirkungen auf die Regulierung der basalen Insulinabgabe: Viele Boli oder auch inadäquate Boli (z.B. aufgrund eines falschen Kohlenhydratfaktors) haben eine Auswirkung auf den Tagesinsulinbedarf und damit wiederum auf den IS-Faktor, der täglich um 0.00 Uhr ermittelt wird. Außerdem bewirken z.B. zu hohe Glukosewerte (wegen zu geringer Boli) höhere Mikroboli.
Grundsätzlich sollte der Bolus vor den Mahlzeiten abgegeben werden, ggf. auch mit einem Drück-Ess-Abstand, vor allem zum Frühstück. Postprandiale Insulinabgaben führen mitunter zu hyperglykämischen Werten, die später einen Korrekturbolus erfordern. Dabei ist zu beachten, dass die basale Insulinabgabe im "Auto-Modus" begrenzt ist. Das System kann maximal das ca. 2,5-Fache der im "Auto-Modus" durchschnittlichen basalen Insulinmenge abgeben. Diese Begrenzung verhindert, dass Patienten vorsätzlich auf die Bolusgabe zum Essen verzichten. Das hat einerseits mit der sicheren Regulation des Glukoseverlaufs zu tun, andererseits aber auch regulatorische Gründe bei der Zulassung des Systems durch die amerikanische Food and Drug Administration (FDA).
Treten erhöhte Glukosewerte auf, die durch den Algorithmus nicht kompensiert werden, kann ein Korrekturbolus abgerufen werden. Dieser wird vom System, nach Befragung des Bolusrechners, vorgeschlagen und reguliert auf einen voreingestellten Zielwert von 150 mg/dl (8,3 mmol/l). Die weitere Regulation auf 120 mg/dl (6,7 mmol/l) übernimmt wieder der Algorithmus. Unter gewissen Umständen wie vor und bei sportlichen Aktivitäten kann es sinnvoll sein, den Zielwert temporär zu ändern. Dieser kann für einige Stunden auf 150 mg/dl erhöht werden.
Zum Algorithmus der MiniMed™ 670G gehört auch ein Sicherheitsmodus innerhalb des "Auto-Modus" (Abb. 2). Der Sicherheitsmodus gewährleistet die Anwendungssicherheit des Systems während der automatisierten Insulinabgabe und verhindert, dass bei nicht ganz klaren Stoffwechselsituationen oder bei fehlenden Glukosedaten das System sofort wieder in den "manuellen Modus" übergeht. Diese Situationen sind im Kästchen "Basal sicher" von Abbildung 2 dargestellt. Das System fordert in einer solchen Situation die Messung und Eingabe eines Blutglukosewerts. Bei "Basal sicher" arbeitet die Insulinpumpe mit einer minimalen basalen Insulinabgabe, ermittelt aus der Insulindosierung im "Auto-Modus". Reagiert der Patient über einen Zeitraum von 90 Minuten nicht darauf, geht die Insulinpumpe in den "manuellen Modus" über.
Der am Beispiel der MiniMed™ 670G dargestellte PID-Algorithmus stellt noch keine Form der künstlichen Intelligenz dar, auch wenn das System zum Teil schon "lernt". Die ständig gemessene Glukosekonzentration ist dabei das Eingangssignal. Grundsätzlich rechnet der Algorithmus mit Daten aus der Stoffwechselsituation, nimmt aber keine Simulation des Glukoseverlaufs vor; die Wirkdauer des Insulins beruht auf den bekannten pharmakologischen Kurven. Physiologische Daten wie die Regulation des Stoffwechsels nach körperlicher Aktivität oder Krankheit werden nicht gespeichert, aufgearbeitet oder später genutzt. Bei der Erstzulassung dieses ersten Hybrid-AID-Systems hatten Sicherheitsaspekte die höchste Priorität, kam doch erstmals ein kommerzielles Gerät auf den Markt, welches von jedem Patienten mit entsprechender Indikation anwendet werden kann. Darauf aufbauend wird in künftigen Systemen der Sicherheitsmodus für die glykämische Regulation modifiziert werden.
Glukoseregulation nach dem MPC-Modell
Ein weiterer Algorithmus zur Regelung von variablen Prozessen ist der MPC (Model Predictive Control) [Bequette 2013, Elleri 2012, Hovorka 2010]. Wie der Name sagt, kalkuliert ein MPC-Algorithmus die zu einem bestimmten Zeitpunkt abzugebende Insulindosis anhand der Prädiktion des Glukoseverlaufs, nicht nur anhand der aktuellen Werte. Das heißt, MPC ist ein dynamisches Modell, welches das zukünftige Verhalten des Regelprozesses (nämlich die Insulindosis) in Abhängigkeit von den Eingangssignalen (Glukosekonzentration) simuliert. Dazu wird die Zeitachse in äquidistante Bereiche unterteilt und für jeden einzelnen dieser Bereiche die Glukosekonzentration in Abhängigkeit von der Insulindosis berechnet (Abb. 3). Soll ein Insulinbolus (ein Mikrobolus bei der adaptiven basalen Insulinabgabe) abgegeben werden, so berechnet der Algorithmus auf Grundlage der aktuellen Glukosekonzentration und des im Organismus noch vorhandenen Insulins ("Insulin on Board") die zukünftigen Glukosewerte für jedes Zeitsegment. Die Anzahl der Zeitsegmente ergibt sich in Abhängigkeit von der Frequenz, mit der die Glukosewerte geliefert werden, und der pharmakologischen Wirkdauer des Insulins (z. B. ein CGM-Wert alle 5 Minuten und Wirkdauer des Insulins von 4 Stunden ergibt 48 Zeitsegmente). Sind diese Glukosewerte im gewünschten Bereich, so wird der "normale" Mikrobolus abgegeben. Sind sie es nicht, so wird die Dosis verändert: höher, wenn die errechnete Glukosekonzentration zu hoch, niedriger, wenn diese zu niedrig war. Diese Simulation wird so lange durchgeführt, bis für die ausgewählte Dosis der optimale Glukosewert in allen Zeitbereichen gegeben ist (eine solche Rechnung dauert Bruchteile von Sekunden). Voraussetzung für die Simulation ist, dass Rechenregeln und entsprechende Daten, wie die Wirkdauer des Insulins in Abhängigkeit von der Dosis, implementiert sind (z. B. als Datentabellen). Für jeden dieser Zustände sind mathematische Funktionen hinterlegt.
Auf der Basis des MPC-Algorithmus arbeiten z. B. folgende Hybridlösungen (d. h. die basale Insulinabgabe erfolgt adaptiv, den Mahlzeitenbolus gibt sich der Patient manuell):
- das Hybrid-AID-System t:slim X2™ mit dem zugehörigen Control-IQ™ (Unternehmen Tandem); in Deutschland noch nicht verfügbar,
- der Algorithmus CamAPS® FX: dieser wird als App auf einem Smartphone (Android) installiert, bei Nutzung der Insulinpumpe DANA RS und des CGM-Systems Dexcom G6® kann der Patient dieses als Hybrid-AID nutzen; die Entwicklung erfolgte an der Universität Cambridge [Elleri 2012, Hovorka 2010], die App ist kostenpflichtig (80 – 90 Euro pro Monat), hat die CE-Kennzeichnung seit März 2020 und ist bereits auf Deutsch verfügbar (ist aber noch nicht in Deutschland erstattungsfähig),
- der Algorithmus DBLG1™ (Diabeloop) [Quemerais 2014]: der Algorithmus ist auf einem Handset installiert und war ursprünglich vorgesehen im Zusammenspiel mit der Insulinpumpe Kaleido und dem CGM-System Dexcom G6®, durch Kooperation mit dem Unternehmen Roche wird er mit der Accu-Chek® Insight zusammenwirken,
- ein Teil der DIY-Systeme ("Looper-Community").
Diabeloop hat über den MPC-Algorithmus hinaus seine Software selbstlernend gestaltet [Quemerais 2014]. Mit Mitteln der künstlichen Intelligenz werden die Glukosedaten der jeweils vergangenen zwei Wochen ausgewertet. Diese retrospektive Analyse vergleicht die sich aus der Glukoseregulation ergebenden CGM-Profile, z. B. Glukoseanstiege und -abfälle bei Mahlzeiten, inklusive vorgenommener Eingaben zur Kohlenhydrataufnahme, abgerufener Mahlzeitenboli, postprandialer Auslenkungen usw. Auch die Auswirkungen körperlicher Aktivität (Intensität der Übungen, Änderung der Insulinempfindlichkeit dabei etc.) wird analysiert. Ebenfalls Eingang finden Daten aus der Anamnese der Patienten (Lebensalter, Diabetesdauer, Triglyzeride [haben Einfluss auf die Insulinempfindlichkeit]). Vergleichbare Glukoseverläufe bei vergleichbaren Aktionen/Aktivitäten werden im Algorithmus hinterlegt. Im Prinzip findet eine Personalisierung der Daten im Sinne der Glukoseregulation statt. Ziel ist es, die Patienten mehr und mehr in ihren therapeutischen Entscheidungen zu entlasten und dabei gleichzeitig Therapiefehler zu verhindern. Mit künstlicher Intelligenz lässt sich das realisieren, ohne dass das für die Patienten eine intellektuelle Herausforderung darstellt. Ohne künstliche Intelligenz ist die Personalisierung der Eingangsdaten für den Algorithmus schwierig. Ein Teil der "DIY-Looper" muss die künstliche Intelligenz durch eigenes Engagement mit hoher Kompetenz bezüglich des eigenen Metabolismus aufwendig umsetzen.
Zukünftig wird der Einsatz der künstlichen Intelligenz bei verschiedenen Herstellern Eingang in die Algorithmen finden. Auf ähnliche Weise lässt sich das zum Beispiel mit Fuzzy-Logik bewerkstelligen.
AID-Systeme, gesteuert über Fuzzy-Logik
Die bisher genannten Algorithmen für die Insulinabgabe (PID bzw. MPC) berücksichtigen relativ grob das physiologische Verhalten des einzelnen Patienten. Dieses ist aber geprägt durch die Nichtlinearität, Komplexität und Unsicherheit des biologischen Systems, eingeschlossen deren innewohnende dynamische Regulation. Es erscheint nicht ausreichend, mit einem Input-Parameter (die Glukosekonzentration) und einem Output-Parameter (die Insulinabgabe) den Stoffwechsel umfassend subtil zu regeln.
Bei den bisher angewendeten Hybrid-AID-Systemen traten diese Limitierungen kaum in Erscheinung, werden doch nur die basale Insulinabgabe (MiniMed™ 670G/770G) und gegebenenfalls zusätzlich die Korrekturboli (MiniMed™ 780G, t:slim X2™ mit zugehörigem Control-IQ™) automatisch reguliert. Beide Formen der Insulinabgabe zeichnen sich durch eine relativ geringe Bolusgröße (Mikroboli) aus, was ein linearer Regelungsalgorithmus bewältigt. Aufgrund der kleinen, in kürzeren Zeitabschnitten gegebenen Mikroboli ist selbst bei Fehldosierung die Gefahr von kritischen Stoffwechselsituationen gering. Sollen jedoch große Insulinboli zu unterschiedlichen Mahlzeiten automatisiert abgegeben werden, bestehen die genannten Herausforderungen im Aufbau einer nichtlinearen, nahezu physiologischen Regulation. Eine Möglichkeit, diese zu bewältigen, besteht in der Anwendung der Prinzipien der Fuzzy-Logik. In einem zukünftigen MD-LAP (Medical Doctor – Logic Artificial Pancreas)-System wird darauf zugegriffen [Atlas 2010].
Was bedeutet nun Fuzzy-Logik? Wird an mathematische Logik gedacht, so betrifft das als Erstes die klassische, also die binäre Logik, welche streng unterscheidet in: Eine Aussage trifft zu ("1") oder eine Aussage trifft nicht zu ("0"). Diese Logik dient dem Erzielen eindeutiger Resultate und Beweise und wird in elektronischen Schaltkreisen und generell in der Digitaltechnik angewandt. Die Information "das Wasser ist warm" oder "das Wasser ist nicht warm" ist für einen Computer eindeutig. Jedoch ist die Information "warmes Wasser hat die Temperatur von 40 ˚C, nicht warmes Wasser von 39,5 ˚C" nicht logisch. So kann das nur ein Mensch empfinden. Im Prinzip ist das eine unscharfe Logik. Darauf beruht nun die "Fuzzy-Logik", die im Prinzip die menschliche Denkweise imitiert. Anders ausgedrückt heißt das, dass man damit unscharfe (nicht präzise unterteilte) Zustände, Muster usw. beschreibt, also zum Beispiel "ein bisschen warm", "ziemlich warm" oder ähnlich unscharfe Begriffe, wie sie Menschen bilden. Es werden Zwischenwerte zugelassen. "Ein bisschen warm" ist eben dann zum Beispiel "0,7 warm" und ergibt sich aus logischen Verknüpfungen zwischen zwei binären Werten durch die logischen Operatoren "UND" (Bildung von Schnittmenge), "ODER" (Bildung von Vereinigungsmengen), "NICHT" (Bildung von Komplementärmengen).
Graphisch sieht ein Vergleich von "binärer Logik" und "Fuzzy-Logik" aus obigem Beispiel folgendermaßen aus: Binär ist jede Temperatur ab 40 ˚C warm und jede Temperatur darunter kalt. Es ergibt sich also eine Stufenfunktion. In der Fuzzy-Logik (z. B. 0,5 warm, 0,65 warm usw.) bilden dagegen die Zwischenwerte eine nicht linear ansteigende Funktion, die einen fließenden Übergang darstellt. Im beschriebenen Beispiel sind 40 ˚C also 1,0 warm, 25 ˚C sind 0,5 warm, 10 ˚C sind kalt, also 0,0 warm.
Was bedeutet das für die Regelungstechnik? Als Beispiel sei die Steuerung einer Verkehrsampel mit "Rot" und "Grün" genannt. Wird diese binär gesteuert, dann schaltet sie immer zu einem festen Zeitpunkt um. Gesteuert mit der Fuzzy-Logik berücksichtigt sie dagegen nicht lineare Einflüsse, wie die Verkehrsdichte, den Verkehrsfluss aufgrund der Steuerung von anderen Ampeln usw. Dazu gelten Fuzzy-Regeln, wie "wenn der Verkehrsfluss in die eine Richtung nahezu ununterbrochen ist, dann bleibe bei ‚Grün‘". Die aktuelle Situation geht in die aktuelle Fuzzy-Logik-Steuerung mit ein.
Umgesetzt für die Steuerung der Insulinabgabe einer Insulinpumpe bedeutet dies die Berücksichtigung des noch wirksamen Insulins, der aktuellen Glukosekonzentration, deren Änderung aufgrund einer weiteren Insulinabgabe sowie die Wirkung von Einflüssen z. B. durch körperliche Aktivität. Die Fuzzy-Regeln sind hier die "Behandlungsregeln" und werden in einem Fuzzy-Logik-Controller implementiert. Diese lauten dann z. B.: "wenn der Glukosespiegel zu hoch ist, dann gib Insulin ab" oder (im komplexeren Fall einer "UND"-Verknüpfung): "wenn der Glukosespiegel zu hoch ist und der Patient Sport treibt, dann gib kein Insulin ab". Damit werden bei der MD-Logik "Behandlungsregeln" auf der Basis von diabetologischem Wissen aufgestellt. Diese Regeln sind individualisiert, berücksichtigen also das individuelle Therapiemanagement des Patienten, wie Insulinabgabeschema, Korrekturfaktoren, Pharmakodynamik des Insulins und typische Aktivitäten. Als Eingangsparameter gehen der vergangene und der zukünftige Glukosetrend sowie aktuelle und zukünftige Glukosewerte ein, die aus Daten des kontinuierlichen Glukosemonitorings errechnet werden. Ausgangsparameter jeder Regel sind 1. die Änderung der Basalrate und 2. der Anteil des Insulinbolus an der Gesamtinsulintagesmenge. Das Ziel besteht im Erhalten eines Glukosespiegels zwischen 80 und 120 mg/dl (4,4 und 6,7 mmol/l), wobei das durch ein Control-to-Target-Modul (CTM) unterstützt wird. Dies ist ein Detektor, um spezielle Glukosedynamiken in bestimmten Situationen zu identifizieren, welche eine besondere Behandlung erfordern. Dazu zählen zum Beispiel Mahlzeiten. Als Ergebnis wird die Dosierung entsprechend angepasst.
Es lässt sich feststellen, dass über die Fuzzy-Logik ein individuell angepasstes, selbstlernendes AID-System entsteht, welches experimentell in den DREAM-Studien realisiert wurde [Nimri 2012, Nimri 2014]. Auf diese Weise wird zukünftig ein Voll-AID-System entstehen, bei dem also sowohl die basale als auch die Bolusinsulingabe vollautomatisch reguliert werden, ganz im Sinne des Erfüllens eines seit Langem gehegten Wunsches von Patienten mit Typ-1-Diabetes.
Zusammenfassung
Algorithmen für die automatisierte Steuerung der Insulinabgabe sind bekannt und mathematisch gut darstellbar. Die Herausforderung besteht in der Anpassung an die aktuelle Lebenssituation. Dem Algorithmus sollten dafür korrekte und zeitnahe Informationen zu Mahlzeiten und Aktivitäten verfügbar gemacht werden. Die Glukosekonzentration gilt in einem breiten Bereich von 70 bis 160 mg/dl (3,9 bis 8,9 mmol/l) als normal. Für Patienten mit Diabetes wird ein Bereich von 70 bis 180 mg/dl (3,9 bis 10,0 mmol/l) angestrebt. Dadurch kann die Regulierung auch mit einer gewissen Toleranz umgesetzt werden. Aufgrund der Wirkung des Insulins über das Unterhautfettgewebe, also am falschen Ort mit einer nicht der Physiologie entsprechenden Pharmakodynamik, sind kleine Abweichungen von der Normoglykämie unvermeidlich und zu erwarten. Jede Regelung stellt folglich einen gewissen Kompromiss dar, den es möglichst vertretbar zu gestalten gilt.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2021; 30 (2) Seite 118-127