Latenter Autoimmundiabetes bei Erwachsenen (Late onset Autoimmune Diabetes in the Adult, LADA [Tuomi 1993]), manchmal auch als Typ-1,5-Diabetes bezeichnet, ist eine Form des Autoimmundiabetes, die neben diagnostischen Merkmalen von Typ-1- auch zeitweise diagnostisch wie ein Typ-2-Diabetes erscheinen kann [Hernandez 2015, Buzetti 2017, Carlsson 2019].
Zusammenfassung
Die Zerstörung der Betazellen bei Autoimmundiabetes (LADA und Typ 1) wird durch eine T-Zell-vermittelte Zytotoxizität, Autoantikörper, entzündliche Zytokine und chronische Immunaktivierung angetrieben. Der Prozess verläuft bei Typ-1-Diabetes schnell, bei LADA (latenter Autoimmundiabetes) jedoch langsamer, sodass eine vorübergehende Insulinunabhängigkeit und damit auch eine Verwechslung mit einem Typ-2-Diabetes möglich ist. Neben einem schlanken Habitus weisen die mögliche (aber nicht immer auffindbare) Prävalenz von Autoantikörpern (GAD65-AK) und das Ausbleiben eines adäquaten Anstiegs der Insulinsekretion, C-Peptid-Sekretion und/oder der Sekretion von intaktem Proinsulin im oralen Glukosebelastungstest auf einen LADA hin. Die Therapie sollte wie beim jugendlichen Typ-1-Diabetes mit Insulin durchgeführt werden, um eine möglichst lange Remissionsphase und damit auch eine Verzögerung bei der Entwicklung von Spätschäden zu erreichen. Durch die Verwechslung mit dem Typ-2-Diabetes werden viele LADA-Patienten allerdings häufig erst durch das rasche Auftreten des "oralen Sekundärversagens" diagnostiziert, wodurch diesen Patienten der positive Effekt einer betazellprotektiven Therapie auf die Entwicklung von Spätschäden durch eine frühe Insulintherapie leider versagt bleibt.
Schlüsselwörter
LADA, Autoimmundiabetes, Insulintherapie, Betazellzerstörung, Autoantikörper
LADA: late-onset autoimmune diabetes in older adults – an underestimated phenomenon
Summary
The destruction of beta cells in autoimmune diabetes (LADA and type 1) is driven by T-cell-mediated cytotoxicity, autoantibodies, inflammatory cytokines and chronic immune activation. The process is rapid in type 1 diabetes, but slower in LADA (Latent Autoimmune Diabetes in Adults), so that temporary insulin independence and thus confusion with type 2 diabetes is possible. In addition to a slender habitus, the possible (but not always detectable) prevalence of autoantibodies (GAD65-AK) and the absence of an adequate increase in insulin secretion, C-peptide secretion and/or the secretion of intact proinsulin in the oral glucose load test are indicative of LADA. In LADA, as in juvenile type 1 diabetes, therapy should be carried out with insulin as soon as possible in order to achieve the longest possible remission phase and thus also delay the development of late damage. However, due to the confusion with type 2 diabetes, many LADA patients are often only diagnosed due to the rapid onset of "oral secondary failure", which unfortunately means that these patients are denied the positive effect of beta cell protective therapy on the later development of late damage through early insulin therapy.
Keywords
LADA, autoimmune diabetes, insulin therapy beta cell destruction, autoantibodies
Einleitung
Es handelt sich dennoch um eine Autoimmunerkrankung, bei der das körpereigene Immunsystem insulinproduzierende Zellen in der Bauchspeicheldrüse angreift, was zu einer allmählichen Abnahme der Insulinproduktion führt. Im Gegensatz zur schnellen Entwicklung des Typ-1-Diabetes im Kindes- und Jugendalter, entwickelt sich LADA deutlich langsamer und wird in der Regel bei Erwachsenen mit einem Alter von über 35 Jahren diagnostiziert ("Typ-1-Diabetes in Zeitlupe") [Pieralice 2018]. Der langsame Verlust der Betazellen kann dabei zu einem Zeitraum kurz vor der Manifestation führen, während dessen diagnostische Maßnahmen (z. B. ein oraler Glukosetoleranztest [OGTT] oder eine Bestimmung von intaktem Proinsulin) ähnliche Ergebnisse haben können wie bei Menschen mit einem betazelldysfunktionsgetriebenen Typ-2-Diabetes [Bolinder 1990, Pieralice 2018, Pfützner 2023]. Die Dunkelziffer beim LADA ist daher hoch und einige Autoren schätzen, dass ca. 10 % der Menschen mit neu diagnostiziertem Typ-2-Diabetes im Alter von über 35 Jahren in Europa tatsächlich einen LADA haben [Irvine 1977, Tuomi 1999, Hawa 2013].
DC: dendritische Zelle
GAD: Glutamatdecarboxylase
GAD65-AK: Glutamatdecarboxylase-Autoantikörper
HbA1c: glykiertes Hämoglobin
HLA: humanes Leukozytenantigenhs
CRP: hochsensitives C-reaktives Protein
IA2: Antikörper gegen das Tyrosinphosphatase-like insulinoma antigen 2
IAA: Insulin-Autoantikörper
ICA: Inselzellantikörper
INS: Insulin-Gen
LADA: Latenter Autoimmundiabetes bei Erwachsenen (Latent Autoimmune Diabetes in the Adult)
MHC: Haupthistokompatibilitätskomplex (Major Histocompatibility Complex)
OGTT: oraler Glukosetoleranztest
ZnT8A: Zink-Transporter-8-Autoantikörper
Pathophysiologie
Personen mit LADA weisen häufig genetische Marker auf, die sowohl mit Typ-1- als auch mit Typ-2-Diabetes in Verbindung gebracht werden. Bestimmte HLA-Gene (humanes Leukozytenantigen), insbesondere HLA-DR3 und HLA-DR4, stehen in engem Zusammenhang mit einem erhöhten Risiko für Autoimmundiabetes, einschließlich LADA [Desai 2007, Andersen 2010, Pettersen 2010, Mishra 2017]. Andere Gene, die nicht zu den HLA-Genen gehören, wie PTPN22, CTLA-4 und INS (Insulin-Gen), spielen möglicherweise ebenfalls eine Rolle bei der Fehlregulation des Immunsystems und machen manche Menschen anfälliger für eine Autoimmunreaktion gegen die Betazellen der Bauchspeicheldrüse [Mishra 2017].
Es wird angenommen, dass LADA wie auch der klassische Typ-1-Diabetes bei genetisch prädisponierten Personen durch Umweltfaktoren ausgelöst wird [Dahlquist 1994, Buzettil 2017, Carlsson 2019]. Zu den Auslösern gehören Virusinfektionen (z. B. Enteroviren, Coxsackievirus B, Röteln, Cytomegalovirus und COVID-19) [Yoon 1990, Yoon 1991, Real-Fernández 2021, Bahtia 2024], Veränderungen in der Zusammensetzung der Darmmikrobiota ("Darmmikrobiota-Dysbiose") [Poulsen 2024], bestimmte Nahrungsproteine (z. B. Gluten) und anhaltende Entzündungen oder stressbedingte Immunaktivierung [Manisha 2022]. Diese Auslöser können zu einer Verwechslung führen, bei der das Immunsystem einige Proteine der Betazellen fälschlicherweise als fremd erkennt (molekulares Mimikry) und einen Autoimmunangriff auslöst [Dyrberg 1989, Vreugdenhil 1998]. Ein Beispiel sind Ähnlichkeiten der Aminosäuresequenz eines viralen Hüllproteins (P2-C von Coxsackievirus B4) mit einer Sequenz eines Enzyms (Glutamatdecarboxylase), das in den Betazellen eine Rolle bei der Regulation der Insulinsekretion spielt, wobei in den Betazellen nur die Enzymvariante mit dem Molekulargewicht 65 kD nachweisbar ist (GAD65), während die 67 kD-Variante im Nervensystem anzutreffen ist (Abbildung 1) [Solinema 1991, Real-Fernández 2021].
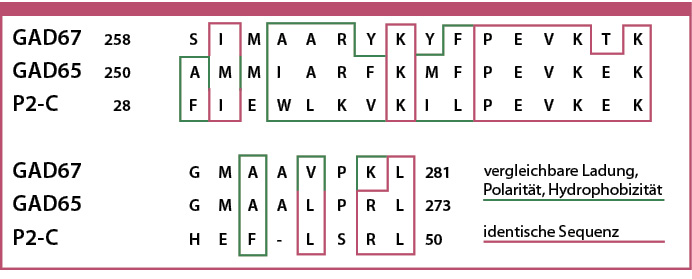 Abb. 1: Aminosäuresequenz von GAD67, GAD65 und des Hüllproteins P2-C von Coxsackievirus B4. Die übereinstimmenden Stellen bestehen aus Aminosäuren mit sehr polaren Seitenketten und sind daher gute Antikörper-Erkennungsstellen (Epitope) [nach Vreugdenhil 1999].
Abb. 1: Aminosäuresequenz von GAD67, GAD65 und des Hüllproteins P2-C von Coxsackievirus B4. Die übereinstimmenden Stellen bestehen aus Aminosäuren mit sehr polaren Seitenketten und sind daher gute Antikörper-Erkennungsstellen (Epitope) [nach Vreugdenhil 1999].
Eines der Hauptmerkmale des LADA ist das Vorhandensein von Autoantikörpern gegen Bestandteile der Betazellen der Bauchspeicheldrüse. Zu den häufigsten Autoantikörpern, die bei LADA gefunden werden, gehören neben den bereits genannten Glutamatdecarboxylase-Autoantikörpern (GAD65-AK), Insulin-Autoantikörper (IAA), Antikörper gegen das Tyrosinphosphatase-like insulinoma antigen 2 (IA2) und Zink-Transporter-8-Autoantikörper (ZnT8A). Im Gegensatz zum Typ-1-Diabetes des Jugendlichen, bei dem in der Regel mehrere dieser Autoantikörper bei der Diagnose vorhanden sind [Regnell 2017], ist LADA häufig mit einem einzigen Autoantikörper verbunden, insbesondere mit GAD65-AK [Tuomi 1999, Schranz 2000, Sørgjerd 2012, Hawa 2013]. Es ist jedoch wichtig zu wissen, dass die Autoantikörper nicht immer bei der Manifestation vorhanden sind, da sie mit fortschreitender Erkrankung verschwinden können, was beim LADA in der Praxis zu einer anfänglich falschen Typ-2-Diagnose und -Behandlung führen kann [Pfützner 2000].
Die Zerstörung der Betazellen beginnt, wenn das Immunsystem die Betazellen fälschlicherweise als fremd erkennt. Dies geschieht wie oben erwähnt aufgrund einer Kombination aus genetischer Anfälligkeit und umweltbedingten Auslösern (z. B. Virusinfektionen, Veränderungen der Darmmikrobiota oder Toxine). Dendritische Zellen (DCs) und Makrophagen opsonisieren und verarbeiten Betazellproteine und präsentieren sie auf Molekülen des Haupthistokompatibilitätskomplexes (Major Histocompatibility Complex, MHC) der Klasse II [Kobayashi 2006]. Naive CD4+ T-Helferzellen (Th-Zellen) erkennen diese Betazellantigene und werden aktiviert. Die aktivierten CD4+ T-Zellen stimulieren andere Immunzellen, wodurch eine Autoimmunreaktion ausgelöst wird [Ravikumar 2023].
In der Folge infiltrieren zytotoxische CD8+ T-Zellen die Pankreasinseln und greifen die Betazellen direkt an. Sie erkennen Peptide der Betazellen, die von MHC-Klasse-I-Molekülen präsentiert werden. Nach der Aktivierung setzen die CD8+ T-Zellen zytotoxische Moleküle frei: Perforin (bildet Poren in den Betazellmembranen) und Granzym B (dringt durch die Perforinporen ein und löst die Apoptose (programmierter Zelltod) aus (Tabelle 1) [Gardener 2021].
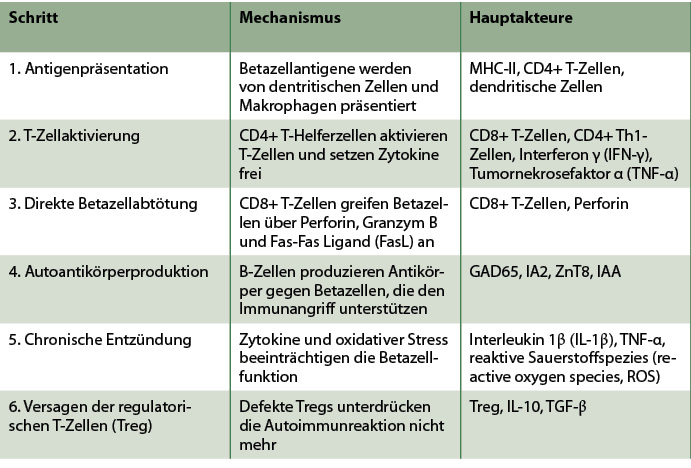 Tab. 1: Zerstörung von Betazellen bei jugendlichem Typ-1-Diabetes und LADA.
Tab. 1: Zerstörung von Betazellen bei jugendlichem Typ-1-Diabetes und LADA.
Anfänglich verläuft die Zerstörung der Betazellen langsam und viele LADA-Patienten können über Jahre bis Jahrzehnte hinweg eine gewisse Insulinproduktion aufrechterhalten (Tabelle 2).
 Tab. 2: Unterschiede beim Autoimmunprozess bei Typ-1-Diabetes und LADA.
Tab. 2: Unterschiede beim Autoimmunprozess bei Typ-1-Diabetes und LADA.
Mit der Zeit, wenn immer mehr Betazellen zerstört werden, nimmt die Insulinproduktion beim Typ-1-Diabetes und beim LADA allmählich ab (Abbildung 2).
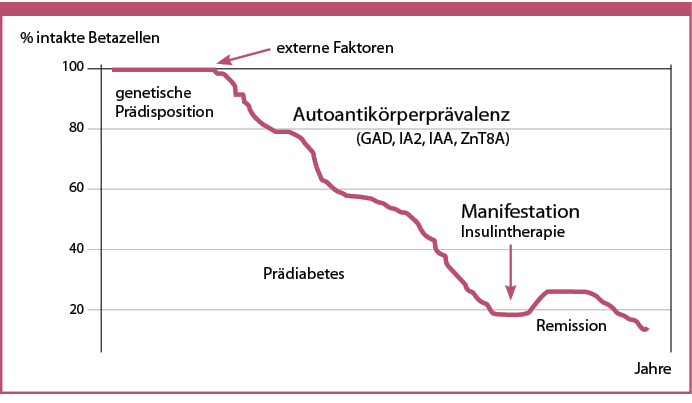 Abb. 2: Autoimmune Zerstörung der Betazellen. Erst wenn mehr als ca. 80 % der Betazellmasse zerstört ist, kommt es zur Manifestation (jugendlicher Typ-1-Diabetes: erhöhte Blutzuckerwerte, Schwäche, viel Wasserlassen, viel Durst; LADA: Schwäche, Depression, Hyperglykämie unter Belastung).
Abb. 2: Autoimmune Zerstörung der Betazellen. Erst wenn mehr als ca. 80 % der Betazellmasse zerstört ist, kommt es zur Manifestation (jugendlicher Typ-1-Diabetes: erhöhte Blutzuckerwerte, Schwäche, viel Wasserlassen, viel Durst; LADA: Schwäche, Depression, Hyperglykämie unter Belastung).
Im Gegensatz zum Typ-2-Diabetes, bei dem die Insulinresistenz ein wichtiger Faktor ist, ist LADA durch einen fortschreitenden Insulinmangel gekennzeichnet, der schnell erkannt und unserer Meinung nach sofort mit Insulin behandelt werden sollte, um die Restsekretion der Betazelle möglichst lange zu erhalten und damit das Eintreten von Spätschäden zu verzögern. Da der LADA eine deutlich langsamere Dynamik hat als der Typ-1-Diabetes im jugendlichen Alter, kommt es kurz vor der endgültigen Manifestation – wenn mehr als ca. 80 % der Betazellmasse zerstört ist – zu einer Prä-Manifestationsphase, in der der LADA labormedizinisch wie ein Typ-2-Diabetes erscheinen kann, da noch eine gewisse Restsekretion vorhanden ist [Carlsson 2019].
In dieser Phase, die beim LADA mehrere Jahre dauern kann (Abbildung 3), ist die noch vorhandene Insulinmenge ausreichend, um die Blutzucker-Nüchternwerte im normnahen Bereich zu halten. Geraten die Betazellen aber unter Stress, z. B. durch eine Mahlzeit oder durch einen Glukosetoleranz-Test, steigen die Glukosewerte jedoch zunächst massiv an und kehren nur sehr langsam und über mehrere Stunden zum Normalwert zurück.
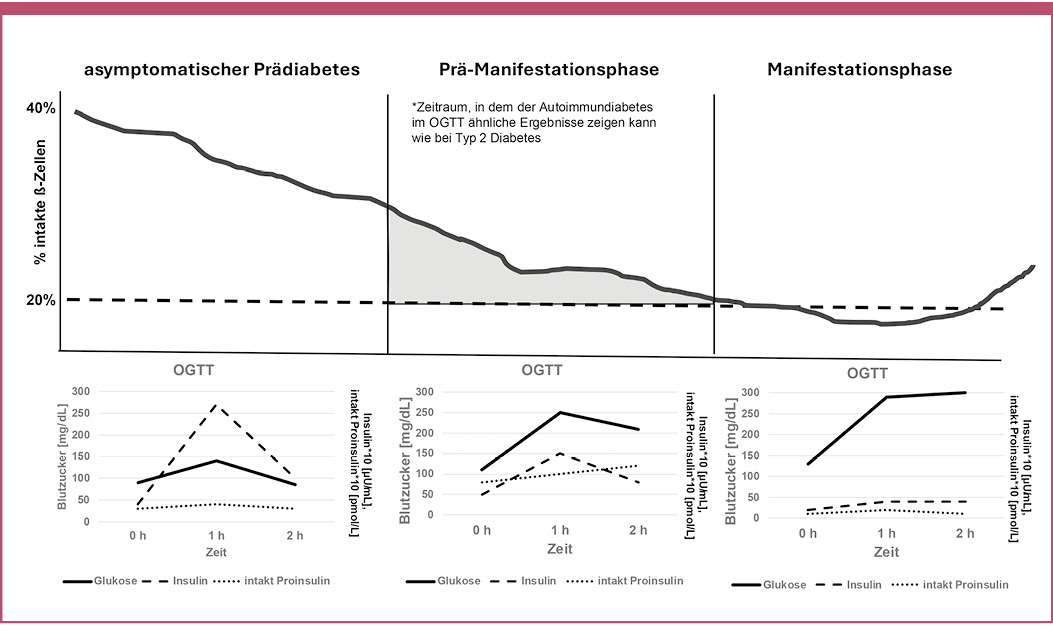 Abb. 3: Typische Ergebnisse beim oralen Glukosetoleranztest (OGTT) in den verschiedenen Phasen der autoimmunen Zerstörung der Betazellen. In der Prä-Manifestionsphase kann der OGTT bei LADA-Patienten ähnliche Ergebnisse zeigen wie bei Menschen mit Typ-2-Diabetes.
Abb. 3: Typische Ergebnisse beim oralen Glukosetoleranztest (OGTT) in den verschiedenen Phasen der autoimmunen Zerstörung der Betazellen. In der Prä-Manifestionsphase kann der OGTT bei LADA-Patienten ähnliche Ergebnisse zeigen wie bei Menschen mit Typ-2-Diabetes.
In dieser Situation schütten die Betazellen häufig nicht nur Insulin, sondern auch die noch vorhandenen Restmengen an unprozessiertem intaktem Proinsulin aus [Guttmann-Bauman 2000, Bolinder 2005], das bekanntlich ebenfalls eine blutzuckersenkende Wirkung hat [Galloway 1992, Pfützner 2004]. Postprandial erhöhtes Insulin, intaktes Proinsulin und erhöhte Glukosewerte sind allerdings genau die Parameter, die einen Typ-2-Diabetes definieren. Wenn in dieser Situation keine Autoantikörper zu finden sind, wird oft ein Typ-2-Diabetes diagnostiziert und gemäß den Guidelines mit oralen Antidiabetika (in der Regel mit Metformin) behandelt [Pfützner 2005]. Die orale Therapie ist an dieser Stelle wahrscheinlich eher suboptimal und unterstützt häufig noch den Betazelluntergang und erst nach einigen Monaten bis Jahren erhält der Patient dann endlich als "oraler Sekundärversager" die Insulintherapie, von der der Organismus von Anfang an mehr profitiert hätte. Leider ist zu diesem – oral austherapierten – Zeitpunkt keine Remission durch die Insulintherapie mehr möglich, die nach allgemeiner Einschätzung geholfen hätte, die Betazellfunktion längerfristig zu präservieren, um z. B. eine frühzeitige Entwicklung von sekundären Komplikationen zu verhindern [Kobayashi 2002, Maruyama 2008, Thunander 2011, Yin 2022].
Während die prominenten Symptome des akuten absoluten Insulinmangels beim jugendlichen Typ-1-Diabetes (deutliche Hyperglykämie und Schwäche bei gleichzeitiger Polyurie und Polydypsie) sehr schnell zur Diagnose führen, sind die Symptome des langsamen chronischen absoluten Insulinmangels beim LADA deutlich verschleierter: Gewichtsabnahme, obwohl der Patient versucht zuzunehmen, Energiearmut, Schwäche, depressive Verstimmung durch die fehlende Hydratisierung der Gehirnzellen (früher auch HOPS – hirnorganisches Psychosyndrom – genannt) und werden (trotz der unerklärlichen Gewichtsabnahme) oft einem Typ-2-Diabetes zugeordnet [Pipi 2014, Chen 2022].
Es bleibt also festzustellen, dass ein LADA durch einen langsam fortschreitenden Autoimmunangriff auf die Betazellen der Bauchspeicheldrüse ausgelöst wird, der in erster Linie durch eine T-Zell-Dysfunktion und die Produktion von Autoantikörpern vermittelt wird. Im Gegensatz zum jugendlichenTyp-1-Diabetes, der rasch fortschreitet, findet sich beim LADA eine vorübergehende manchmal Jahre andauernde Periode der therapeutischen Insulinunabhängigkeit. Da die immunvermittelte Zerstörung jedoch fortschreitet, wird schließlich eine Insulintherapie erforderlich. Die frühzeitige Erkennung und angemessene Behandlung sind entscheidend, um die sonstigen Funktionen der Betazellen zu erhalten und somit auch die Entwicklung von Spätschäden zu verzögern oder sogar zu verhindern.
In unserer Praxis erkennen wir die inadäquate Sekretion der Betazellen beim LADA anhand von hohen Nüchtern-Blutzuckerwerten bei gleichzeitig niedrigen Insulin- und intaktes Proinsulinspiegeln im Rahmen unserer Phänotypisierung. Einige Autoren schlagen hierfür auch den Nüchtern-Blutzucker/C-Peptid-Quotienten vor, der eine relativ einfache Bestimmung der Insulinpflichtigkeit darstellt [Jones 2013, Buzetti 2017, Fritsche 2023]. International gilt die differenzialdiagnostische Vorgehensweise, die jährlich in den "Standards of Care" der Amerikanischen Diabetesgesellschaft publiziert wird, als Standard. Bei diesen werden allerdings eher klinische Parameter (z. B. Körpergewicht, Alter, schlechtes Ansprechen auf orale Antidiabetika, früher Insulinbedarf, Autoimmunerkrankungen in der Eigen- oder Familienanamnese, Ketose bei Manifestation) verwendet, sodass der LADA häufig erst spät erkannt wird [ADA 2025].
Fallbeispiel aus der Praxis
Die Patientin E. K., Rentnerin, 67 Jahre alt stellte sich im März 2024 in der Praxis vor. Ein Typ-2-Diabetes sei seit August 2022 bekannt und sie nehme seitdem Metformin (500 mg – 0 – 500 mg), ein homöopathisches Kombinationspräparat, das bei leichten Formen von Bluthochdruck eingesetzt wird (Homviotensin), sowie diverse Nahrungsergänzungsmittel ein (Omega-3-Fettsäuren, Vitamin B und D, Q10). Trotz intensiver Bemühungen sich kohlenhydratarm zu ernähren, lag der HbA1c-Wert zuletzt bei ca. 7,5 % und sie hätte bei einem Ausgangsgewicht von ca. 65 kg seit Diagnose ständig abgenommen. Ansonsten sei sie antriebsarm und fühle sich depressiv. In der körperlichen Untersuchung zeigten sich bei der stark untergewichtigen Patientin (Gewicht: 47,4 kg, Größe: 1,63 m, BMI: 17,8 kg/m²) eine massive arterielle Hypertonie (systolisch: 210 mmHg, diastolisch: 112 mmHg, Puls: 69/min) aber noch keine Hinweise auf manifeste diabetische Spätkomplikationen. Im Labor fanden sich ein Nüchternblutzucker von 182 mg/dL (10,1 mmol/L), ein HbA1c-Wert von 7,2 % (55,2 mmol/mol), aber kein Nachweis von Autoantikörpern (GAD65-AK: negativ, ICA: negativ, IA2: negativ). Die in der Praxis etablierte Typ-2-Phänotypisierung [Pfützner 2023, Pfützner 2024] zeigte eindeutige Hinweise auf einen LADA (Nüchterninsulin unter der Nachweisgrenze, intaktes Proinsulin < 1,8 pmol/L, Adiponektin 11,2 mg/L (= gute Insulinsensitivität), hsCRP < 0,6 mg/dL). Alle anderen Laborwerte (Leberwerte, Elektrolyte, großes Blutbild, Nierenwerte, Fette etc.) zeigten keine Auffälligkeiten.
Es wurde noch am gleichen Tag das Meformin abgesetzt und mit einer intensivierten Insulintherapie begonnen (4 U Basalinsulin und 2 U kurzwirksames Analoginsulin zu den Mahlzeiten). Des Weiteren wurde nach sofortiger Blutdrucksenkung in der Praxis ein Angiotensin 1-Rezeptorblocker dauerhaft verschrieben. Die Patientin wurde hinsichtlich der Insulintherapie geschult und das Prinzip der Basalinsulintitration [Pfützner 2016] wurde ihr erläutert. In den nächsten vier Wochen wurde die Basalinsulindosis auf zunächst 12 U gesteigert und darunter der Zielblutzucker von 90 – 110 mg/dL (5 – 6 mmol/L) erreicht. Die Patientin fühlt sich seit Beginn der Insulintherapie psychisch deutlich besser und hat wieder viel mehr Energie und Lebensfreude. Nach ca. sechs Wochen setzte die Remissionsphase ein und es gelang, die Patientin von der Fortführung der Insulintherapie zu überzeugen. Bei der letzten Vorstellung im November 2024 lag der HbA1c bei 6,1 % und die normotone Patientin hatte ihr Wunschgewicht von 63 kg wieder erreicht. An diesem Fallbeispiel kann man erkennen, wie die Nicht-Erkennung des LADA die Patientin durch ein unnötiges "Tal der Tränen" geschickt hat, was bei entsprechender frühzeitiger Diagnostik hätte vermieden werden können.
Zukunftsaspekte in Diagnostik und Therapie
Während in der aktuellen Praxis der Begriff LADA für den Autoimmundiabetes beim Älteren endlich langsam in der Routine anzukommen scheint, ist die nationale und internationale Forschung schon wieder einen Schritt weiter und empfiehlt sogar den Terminus LADA wieder zu verlassen. Führende Wissenschaftler weisen zurecht daraufhin, dass unter dem Sammelbegriff LADA häufig Patienten mit klassischen Merkmalen eines Typ-1-Diabetes aber auch eines Typ-2-Diabetes subsummiert werden, was sich durch Pankreasbiopsien [Jones 2021] oder die Erfassung der intaktes Proinsulinsekretion im Verhältnis zu C-Peptid im Sinne der klassischen Betazelldysfunktion beim Typ-2-Diabetes nachweisen lässt [Redondo 2023]. Tatsächlich ist ein extrem betazelldysfunktionsgetriebener Typ-2-Diabetes Phänotyp klinisch nur sehr schwer von einem spätmanifesten Typ-1-Diabetes abgrenzbar [Pfützner 2023].
Auch deutsche Experten empfehlen daher auf dem Weg zur Präzisionsmedizin den Begriff LADA zu verlassen. Zwar ist der Begriff in der Fortbildung von Hausärzten wertvoll, da er dort bekannt ist, Awareness schafft und daran erinnert, dass sich hinter einem im Erwachsenalter neu diagnostizierten Diabetes auch ein Typ 1 verbergen kann. Bedenkt man aber die zahlreichen, teils willkürlichen Definitionen des LADA (Alter > 30, > 35, < 70 Jahre; insulinfrei für > 6 Monate etc.), dessen unzureichende Charakterisierung und die fehlende Abdeckung aller Formen jenseits des klassischen Typ-1-Diabetes im Erwachsenenalter sowie die hohe Rate an falsch positiven Diagnosen, ist aus wissenschaftlicher Sicht der Begriff wahrscheinlich nicht mehr zeitgemäß [Tuomi 2014, Leslie 2016, Thomas 2018]. Weitere modulierende Faktoren wie Ethnizität, Geschlecht, Alter, Gewicht/BMI etc. sollten in zukünftige Prädiktionsmodelle einfließen können. Auch prospektive Studien im Erwachsenenalter dürften für den weiteren Erkenntnisgewinn hilfreich bzw. notwendig sein [Hummel 2017, Hummel 2020].
Da die Pathomechanismen beim Autoimmundiabetes in den letzten Jahrzehnten immer besser erforscht wurden, gibt es bereits mehrere pharmakologische Ansätze, um in das Geschehen so einzugreifen, dass der Autoimmunprozess verlangsamt werden kann und dass die Insulinproduktion möglichst lange erhalten bleibt. Dadurch soll der klinische Ausbruch hinauszögert oder verhindert werden. Seit 2022 ist in den USA ein Anti-CD3-Antikörper als erstes Medikament überhaupt zugelassen (Teplizumab, Tzield). Teplizumab bindet an das CD3-Molekül auf T-Zellen, das als Bestandteil des T-Zell-Rezeptorkomplexes zentral für die Aktivierung von T-Zellen ist [Smith 1997]. Die Zulassung in der EU läuft, ist aber noch nicht abgeschlossen. Die Zielgruppe für das Medikament sind Verwandte von Menschen mit Typ-1-Diabetes mit zwei oder mehr nachweisbaren Autoantikörpern und einem Alter ≥ 8 Jahre. Der Wirkstoff wird im Rahmen einer 14-tägigen Infusionsserie einmalig verabreicht und soll zu einer Verzögerung der Manifestation des klinischen Typ-1-Diabetes um durchschnittlich etwa zwei Jahre führen. Dies führt zu einer vorübergehenden Inaktivierung (Anergie) und/oder Apoptose (Zelltod) dieser T-Zellen. Gleichzeitig fördert der Antikörper eine Umprogrammierung von T-Zellen zu regulatorischen T-Zellen (Tregs), die entzündungshemmend wirken. Dadurch wird die Autoimmunreaktion gegen Betazellen abgeschwächt – allerdings nicht dauerhaft gestoppt [Mignogna 2021, Herold 2019].
Weitere Wirkstoffe befinden sich in Studien, sind aber noch nicht allgemein zugelassen (z. B. orales Insulin zur Immuntoleranzinduktion, Anti-CD20-Antikörper wie Rituximab, CTLA4-Immunglobulin (Abatacept), Antigen-spezifische Immuntherapien wie rhGAD65/alum und DiamydTM, und ein Impfstoff gegen Coxsackievirus [Jeun 2024]).
Schlussfolgerungen
Zusammenfassend wird die Zerstörung der Betazellen bei Autoimmundiabetes (LADA und Typ 1) durch T-Zell-vermittelte Zytotoxizität, Autoantikörper, entzündliche Zytokine und chronische Immunaktivierung angetrieben. Der Prozess verläuft bei Typ-1-Diabetes schnell, bei LADA jedoch viel langsamer, sodass eine vorübergehende Insulinunabhängigkeit und damit auch eine Verwechslung mit einem Typ-2-Diabetes möglich sind. Hinweisend für einen LADA sind ein schlanker Habitus, die mögliche (aber nicht immer vorhandene) Prävalenz von Autoantikörpern (GAD65-AK) und das Ausbleiben eines adäquaten Anstiegs der Insulinsekretion, C-Peptid-Sekretion und/oder der Sekretion von intaktem Proinsulin im OGTT. Durch ein effizientes Screening bei fraglichem oder manifestem Diabetes im höheren Lebensalter (z. B. Autoantikörperbestimmung und Typ-2-Phänotypisierung) lässt sich der LADA in der Regel gut erkennen und einer schnellen betazellprotektiven Insulintherapie zuführen. Dies kann in der Folge dazu beitragen, die Entwicklung von Spätschäden zu verzögern oder sogar zu verhindern.
- Der spätmanifeste Autoimmundiabetes im höheren Lebensalter (LADA) schreitet häufig sehr langsam voran und wird oft mit Typ-2-Diabetes verwechselt.
- Hinweise auf LADA sind:ein schlanker Habitus, kürzlicher Gewichtsverlustdas mögliche Vorliegen von Autoantikörpern (z. B. GAD65-AK) eine eingeschränkte Insulin-, C-Peptid- und/oder Proinsulinsekretion im OGTT.
- Die Therapie sollte optimalerweise von Beginn an mit Insulin erfolgen, um eine längere Remission und ein Hinauszögern von Spätschäden zu ermöglichen.
- Eine Fehldiagnose als Typ-2-Diabetes führt oft erst spät – nach "oralem Sekundärversagen" – zur richtigen Diagnose, wodurch die Chance auf eine Betazell-protektive Insulintherapie verloren geht.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2025; 34 (5) Seite 262-268


