Laut einer Modellierung beträgt in Deutschland die Prävalenz des diagnostizierten Typ-2-Diabetes (T2D) im Jahr 2025 unter konservativen Annahmen etwa 11,7 % bei Männern und 10,5 % bei Frauen [Tönnies 2019] bei steigender Tendenz [Tönnies 2023]. Hinzu kommt eine Dunkelziffer von mindestens 2,0 % an unerkanntem Diabetes [Heidemann 2016]. Vergleichbare geschätzte Daten bietet auch der Gesundheitsbericht Diabetes 2025 [Seidel-Jacobs 2025].
Zusammenfassung
Die Prävalenz von Diabetes im Krankenhaus ist deutlich höher als in der Allgemeinbevölkerung. In über 90 % der Fälle ist Diabetes eine Nebendiagnose. Dsyglykämien führen zu deutlich erhöhten Komplikationen, einer erhöhten Wiederaufnahmerate und Mortalität. Gleichzeitig gibt es in Deutschland diverse Lücken in der Diabetesversorgung: Ein allgemeines Screening auf Diabetes erfolgt weder im ambulanten Bereich noch bei Krankenhausaufnahme. In randomisierten, kontrollierten Studien wurde gezeigt, dass kontinuierliches Glukosemonitoring (CGM) potenziell lebensbedrohliche Dysglykämien reduzieren und den HbA1c-Wert verringern kann. Der Einsatz von CGM im Krankenhaus wird in mehreren Praxisempfehlungen und Leitlinien empfohlen. Die dem medizinischen Fachpersonal kontinuierlich zur Verfügung stehenden Daten ermöglichen bessere Therapieanpassungen und die Prävention von Dysglykämien. Vor Notfällen wird durch Echtzeitalarme gewarnt.CGM ist im Krankenhaus noch nicht etabliert und erfordert die Integration in bestehende Arbeitsabläufe. Im Rahmen einer digitalen Diabetesstrategie erfolgt bei stationärer Aufnahme generell ein Diabetes-Screening. Automatisiert wird ein spezielles Diabetes-Team informiert, das Zugang zu allen Daten erhält und ggf. weitere Krankenhäuser telemedizinisch betreuen kann. Werden Daten aus dem Krankenhaus im ambulanten Bereich verfügbar und andersherum, wird Behandlungskontinuität erreicht. Der potenzielle Nutzen des Einsatzes von CGM im Krankenhaus liegt in einer verbesserten Behandlungsqualität, der Vermeidung von Komplikationen, der Reduktion von Verweildauer und Wiederaufnahmen, einer höheren Patienten-zufriedenheit, verbesserten Prozessabläufen, der Entlastung des medizinischen Fachpersonals und Kosteneinsparungen. Somit sollte CGM im Krankenhaus ein wichtiger Bestandteil einer umfassen-den digitalen Diabetesstrategie sein.
Schlüsselwörter
CGM, digitale Diabetesstrategie, stationäre Versorgung, Blutzuckerkontrolle
Continuous glucose monitoring (CGM) as part of a digital diabetes strategy in hospitals
Summary
The prevalence of diabetes in hospitals is significantly higher than in the general population. In over 90 % of cases, diabetes is a secondary diagnosis. Dysglycaemias lead to markedly increased complications, higher readmission rates, and elevated mortality. At the same time, there are various gaps in diabetes care in Germany: There is no general screening for diabetes in the outpatient sector or upon hospital admission.Randomised controlled trials have shown that continuous glucose monitoring (CGM) can reduce potentially life-threatening dysglycaemias and lower HbA1c concentrations. The use of CGM in hospitals is recommended in several clinical practice guidelines and expert consensus statements. The data continuously available to the medical staff enables better therapy adjustments and the prevention of dysglycaemia. Real-time alerts provide early warnings before emergencies occur. CGM is not yet widely used in hospitals and requires integration into existing clinical workflows. As part of a digital diabetes strategy, all patients undergo diabetes screening upon hospital admission. A specialised diabetes team is automatically notified and gains access to all relevant data, enabling it to provide telemedical support to other hospitals. By making data from hospitals accessible to the outpatient sector and vice versa, continuity of care is ensured. The potential benefits of using CGM in hospitals include improved quality of care, prevention of complications, reduced length of stay and readmissions, greater patient satisfaction, optimised clinical workflows, reduced workload for medical staff, and cost savings. Therefore, CGM should be considered a key element of a comprehensive digital diabetes strategy.
Keywords
CGM, digital diabetes strategy, inpatient care, glycaemic control
Hohe Prävalenz von Personen mit Diabetes im Krankenhaus
Die Prävalenz von Diabetes im Krankenhaus ist überproportional hoch: In einer die Jahre 2015 bis 2017 umfassenden Studie hatten 2017 von 16,7 Millionen stationär behandelten Personen in Deutschland 18,4 % eine Haupt- oder Nebendiagnose Diabetes, und zwar 17,1 % T2D und 0,5 % Typ-1-Diabetes (T1D). Nur bei 1,2 % der stationären Fälle war Diabetes die Hauptdiagnose, während in 17,2 % der stationären Fälle der Diabetes eine Nebendiagnose darstellte [Auzanneau 2021]. Mit anderen Worten: 93,4 % der stationären Personen mit Diabetes befinden sich nicht wegen, sondern mit Diabetes im Krankenhaus. Die Studie nutzte ICD-10 Codes, um die Häufigkeit des Diabetes im Krankenhaus abzuschätzen. Da insbesondere Nebendiagnosen nicht immer vollständig codiert werden, sind die gefundenen Prävalenzen möglicherweise falsch zu niedrig. Dafür sprechen zwei Studien von 2018 und 2022, in denen bei der stationären Aufnahme systematisch der HbA1c-Wert bestimmt wurde: Sie kamen sogar auf 42,3 % Diabetes (bei über 55-Jährigen) bzw. 38,2 % Diabetes und 37,5 % Prädiabetes (bei Personen mit COVID-19-Infektion und schwerem akutem respiratorischem Syndrom) [Müller-Wieland 2018, van Baal 2023]. Zwischen T1D und T2D wurde nicht unterschieden. All diese Prävalenzen sind sehr hoch.
Die stationäre Aufnahme erfolgt nur selten wegen diabetologischer Notfälle, erschwerter Stoffwechseleinstellung und schwerer Diabeteskomplikationen wie dem diabetischen Fußsyndrom. Überwiegend erfolgt sie wegen kardiovaskulärer und renaler Folgeerkrankungen oder aufgrund anderer Erkrankungen, die nicht primär mit dem Diabetes in Zusammenhang stehen, sondern bei denen Diabetes eine Nebendiagnose darstellt [Jenssen 2022, Overlack 2021]. Die viel höhere Diabetesprävalenz bei hospitalisierten Personen im Vergleich zur Allgemeinbevölkerung belegt die hohe diabetesassoziierte Morbidität und unterstreicht den erheblichen stationären Versorgungsbedarf von immer älter werdenden multimorbiden Personen mit Diabetes [Auzanneau 2021].
ADA: American Diabetes Association
AGP: ambulantes Glukoseprofil
AID: automatische Insulindosierung
BGM: Blutzuckermessung (Blood Glucose Monitoring)
BOT: basal unterstützte orale Therapie
CGM: kontinuierliches Glukosemonitoring (Continuous Glucose Monitoring)
CT: Computertomografie
DDG: Deutsche Diabetes Gesellschaft
DTS: Diabetes Technology Societye
DA: elektronische Diabetesaktee
PA: elektronische Patientenakte (EMR, Electronic Medical Record)
ES: Endocrine Society
FDA: Food and Drug Administration
GMI: Glukose-Management-Indikator
HbA1c: glykiertes Hämoglobin
ICD: International Statistical Classification of Diseases
ISF: interstitielle Flüssigkeit
KI: künstliche Intelligenz
KIS: Krankenhaus-Informationssystem
LIS: Labor-Informationssystem
MRT: Magnetresonanztomografie
POC: Point-of-Care
SOP: Standardarbeitsanweisung (Standard Operating Procedure)
T1D: Typ-1-Diabetes
T2D: Typ-2-Diabetes
TAR: Time Above Range (Zeit oberhalb des Zielbereichs)
TBR: Time Below Range (Zeit unterhalb des Zielbereichs)
TIR: Time In Range (Zeit im Zielbereich)
Negative Konsequenzen von Dysglykämien im Krankenhaus
In einer Studie des Universitätsklinikums Tübingen von 2018, in der ebenfalls bei Aufnahme HbA1c bestimmt wurde, hatten 22,1 % der dort behandelten Personen Diabetes und weitere 23,7 % Prädiabetes. Personen mit Diabetes hatten eine um 1,5 Tage längere Aufenthaltsdauer, und 23,8 % von ihnen hatten Komplikationen im Vergleich zu 15,4 % der Personen ohne Diabetes [Kufeldt 2018]. Generell haben Personen mit Diabetes im Krankenhaus ein höheres Risiko von Wundinfektionen [Martin 2016, Kyi 2019] und eine deutlich höhere Mortalität: In einer US-amerikanischen Studie betrug die Mortalität im Krankenhaus 1,7 % bei Normoglykämie, 3,0 % bei bekanntem Diabetes und 16,0 % bei im Krankenhaus neu aufgetretener Hyperglykämie. Die Verweildauern betrugen 4,5 sowie 5,5 bzw. 9,0 Tage [Umpierrez 2002]. Eine höhere Mortalität über alle Altersgruppen von 20 bis 90 Jahren hinweg sowie eine verlängerte Verweildauer von etwa einem Tag wurden auch in einer deutschen Studie bestätigt [Auzanneau 2021]. Das Risiko für eine Wiederaufnahme ins Krankenhaus innerhalb des nächsten Jahres ist hoch: In einer Studie in Singapur erlebten dies 50,3 % der stationären Personen mit Diabetes. Die Hälfte von ihnen wurde sogar mindestens dreimal wiederaufgenommen [Low 2016]. Das alles führt zu erhöhten Kosten für die Gesundheitssysteme: Bereits 2011 lagen in einer kalifornischen Studie die stationären Behandlungskosten bei Personen mit Diabetes um 2200 US-Dollar höher als bei Personen ohne Diabetes [Meng 2014]. 2013 lagen sie in einer australischen Studie um 22 % höher [Karahalios 2018].
Die akute Behandlung von Hyperglykämien im Krankenhaus erfolgt standardmäßig mit Insulin. Das amerikanische Institute For Safe Medication Practices (ISMP) beschreibt Insulin als "High-Alert-Medication", bei der ein erhöhtes Risiko besteht, dass bei fehlerhafter Anwendung den betroffenen Personen erheblicher Schaden zugefügt wird [ISMP 2018]. Insbesondere besteht das Risiko von Überdosierung, was engmaschige Glukosekontrollen erfordert, die oft nicht gegeben sind.
Dysglykämien im Krankenhaus sind häufig: In einer 126 Krankenhäuser und über 12 Millionen Glukosemessungen mittels Teststreifen umfassenden US-amerikanischen Studie wurde eine Hyperglykämie > 180 mg/dL (> 10,0 mmol/L) bei 46,0 % aller Glukosemessungen auf der Intensivstation und bei 31,7 % auf den restlichen Stationen beobachtet. Die Häufigkeit von Hypoglykämien < 70 mg/dL (< 3,9 mmol/L) betrug 10,1 % bzw. 3,5 %. Pro Tag wurden durchschnittlich fünf Glukosemessungen auf der Intensivstation und drei auf den restlichen Stationen durchgeführt [Cook 2009]. Studien, die CGM verwendeten, zeigten ebenfalls häufig Hypoglykämien bei stationären Personen an [Sing 2020, Spanakis 2022, Thullen 2024, Olsen 2025].
Hypoglykämien können u. a. zu zerebralen Krampfanfällen sowie zu kardialen Arrhythmien führen. Schwere Hypoglykämien erhöhen das Risiko kardiovaskulärer Komplikationen wie Herzinfarkt, Schlaganfall und plötzlichem Herztod innerhalb der nächsten sieben Tage etwa um das Achtfache [Zinman 2018]. Das allgemeine Sterberisiko steigt Schätzungen zufolge um den Faktor fünf bis 60 [Amiel 2021, Reno 2018].
Ein engmaschiges Glukosemonitoring und -management von Personen im Krankenhaus ist daher aus klinischer Sicht dringend erforderlich.
Gleichzeitig gibt es in Deutschland diverse Versorgungslücken: Ein allgemeines Screening auf Diabetes existiert weder im ambulanten Bereich, noch werden Personen bei Aufnahme ins Krankenhaus routinemäßig auf Diabetes untersucht, obwohl die Deutsche Diabetes Gesellschaft (DDG) dies seit langem fordert [DDG 2019]. Oft fehlt Diabetes-Expertise im Krankenhaus: 2020 wurde nur in 17 % der 1914 deutschen Krankenhäuser eine adäquate, zertifizierte Diabetes-Expertise vorgehalten [Fritsche 2017]. Experten fordern daher mehr Kapazitäten bei der Aus- und Weiterbildung [Kellerer 2020]. Außerdem werden Gesundheitsdaten immer noch sowohl im ambulanten wie im stationären Bereich vielfach nur auf Papier dokumentiert und stehen an der entscheidenden Stelle für Therapieentscheidungen nicht immer zur Verfügung.
Glukose-Selbstmonitoring im ambulanten Bereich schon lange etabliert
Um die Glukosekontrolle zu verbessern, wurde in den 1980er-Jahren das Konzept der Blutglukose-Selbstkontrolle von Personen mit Diabetes mittels Teststreifen (Blood Glucose Monitoring, BGM) zur Standardbehandlung, insbesondere für Personen mit T1D [Hirsch 2018].
Im Jahr 1999 kam das erste kommerzielle System zum kontinuierlichen Glukosemonitoring (Continuous Glucose Monitoring, CGM) in den USA auf den Markt [Hirsch 2018, Kesavadev 2023]. 2016 wurden CGM-Systeme Teil der Regelversorgung für Personen mit insulinpflichtigem Diabetes in Deutschland. CGM-Systeme messen die Glukosekonzentration mit einem Sensor in der interstitiellen Flüssigkeit (Interstitial Fluid, ISF) im subkutanen Fettgewebe. Zwischen den Glukosekonzentrationen in ISF und Blut besteht eine zeitliche Verzögerung (Lag Time). CGM-Systeme korrigieren dies mittels komplexer Algorithmen und berechnen aus der Glukosekonzentration in ISF die Glukosekonzentration im Blut. Daher ist die mittels CGM-Messungen ermittelte Glukosekonzentration im Blut zwangsläufig etwas ungenauer als die direkt in Blutproben mittels klinisch-chemischer Labormesssysteme oder Teststreifen gemessene [Heinemann 2020]. Dafür haben CGM-Systeme andere entscheidende Vorteile: Während jede Messung mittels Teststreifen nur eine Momentaufnahme der aktuellen Glukosekonzentration liefert, liefern CGM-Systeme rund um die Uhr alle paar Minuten, manche auch jede Minute, einen Wert, der auf einem Smartphone oder einem Kontroller dargestellt wird. Sie zeigen Trends an, senden Alarme, wenn Schwellenwerte für Hypo- und Hyperglykämie überschritten werden, sowie prädiktive Alarme, wenn die Überschreitung von Schwellenwerten zeitnah zu erwarten ist. Manche CGM-Systeme müssen oder können mittels Blutglukosemessungen kalibriert werden.
In randomisierten, kontrollierten Studien wurde gezeigt, dass BGM und CGM potenziell lebensbedrohliche Hypo- und Hyperglykämien reduzieren und die HbA1c-Konzentration verringern [ADA Professional Practice Committee 2025a]. CGM ist dabei BGM überlegen. Beispielsweise senkte in einer retrospektiven Studie in Frankreich an über 74 000 Personen mit Diabetes CGM gegenüber BGM die Hospitalisierungsrate aufgrund akuter Diabeteskomplikationen (diabetische Ketoazidose, diabetisches Koma, Hyper- und Hypoglykämie) um 49,0 % bei T1D und um 39,4 % bei T2D [Roussel 2021].
Als neues Konzept wurden für CGM zusätzliche Kontrollparameter eingeführt: die Zeiten im, unterhalb und oberhalb des Zielbereichs von 70 – 180 mg/dL (3,9 – 10,0 mmol/L) (Time In Range, TIR; Time Below Range, TBR; Time Above Range, TAR) und in weiteren Konzentrationsbereichen sowie die glykämische Variabilität (Variationskoeffizient) [Battelino 2019], die alle durch CGM verbessert werden [ADA Professional Practice Committee 2025a]. Die Daten dieser Parameter und weitere werden konsolidiert im sogenannten ambulanten Glukoseprofil (Ambulatory Glucose Profile, AGP) dargestellt [Bergenstal 2013]. Ein weiterer konsolidierter Parameter ist der Glukose-Management-Indikator (Glucose Management Indicator, GMI), der ähnlich dem HbA1c eine Aussage über die durchschnittliche Glukosekonzentration in den letzten Wochen liefert [Bergenstal 2018].
Der Einsatz von Insulinpumpen und die Entwicklung von Algorithmen, mit denen CGM-Systeme Insulinpumpen automatisch steuern können (automatische Insulindosierung, Automated Insulin Delivery, AID), auch Hybrid-Closed-Loop-System genannt, führten zu weiteren klinischen Verbesserungen [Ware 2022]. Durch die intelligente, konsolidierte und intuitive Anzeige von Daten können Trends und deren Ursache leicht erkannt, Einstellungen nachjustiert und das Bolus-Management optimiert werden. Die automatische Verbindung zur Cloud zum Datenaustausch, z. B. mit Angehörigen oder medizinischem Fachpersonal, schaffen zusätzlich die Grundlage für eine telemedizinische Betreuung. BGM und CGM sind gute Beispiele dafür, wie Technologie die Versorgung von Personen mit Diabetes verbessert hat. Diese sehen ihr behandelndes medizinisches Fachpersonal nur wenige Male im Jahr und managen ihren Diabetes über 99 % der Zeit selbständig.
Seit mehreren Jahren wird CGM zum Diabetes-Selbstmanagement vermehrt auch bei Personen mit T2D eingesetzt, die mittels Ernährungstherapie, einer Nicht-Insulin-Medikation oder mittels Insulin behandelt werden. Kürzlich wurden in einer großen US-amerikanischen Studie signifikante Reduktionen der Krankenhausaufnahmen und Notaufnahmebesuche durch den Einsatz von CGM bei dieser Personengruppe gezeigt: Je nach Therapieschema gab es 10,1 % – 22,6 % weniger Krankenhauseinweisungen insgesamt, 31,0 % – 52,7 % weniger akute diabetesbedingte Krankenhauseinweisungen und 28,2 % – 36,6 % weniger diabetesbedingte Notaufnahmebesuche [Garg 2024]. Die HbA1c-Konzentration sank um 0,9 – 1,1 Prozentpunkte. Die Autoren schlussfolgern, dass die Verwendung von CGM bei verschiedenen Therapieschemata bei Erwachsenen mit T2D mit einer Verringerung der Inanspruchnahme von Gesundheitsressourcen und einer verbesserten Glukosekontrolle verbunden ist.
Der Einsatz von CGM zum Diabetes-Selbstmanagement im ambulanten Bereich ist heute Bestandteil vieler Leitlinien zur Diabetestherapie, z. B. der DDG [Schlüter 2024] oder der American Diabetes Association (ADA) [ADA Professional Practice Committee 2025a].
CGM im Krankenhaus: Vorteile und Empfehlungen
Die Glukosemessung im Krankenhaus erfolgt sowohl im Zentrallabor mit klinisch-chemischen Labormesssystemen als auch in Form von patientennaher Sofortdiagnostik (Point-of-Care, POC) mittels Teststreifen. Letztere liefern unmittelbare Messergebnisse, sind aber tendenziell weniger genau als Labormessungen. Engmaschige POC-Glukosemessungen sind zeit- und personalintensiv und belasten die betroffenen Personen. Sie stellen außerdem nur Momentaufnahmen dar, sodass der Glukoseverlauf zwischen diesen Werten unbekannt ist. Insbesondere nächtliche Dysglykämien werden von den schlafenden Personen selbst nicht bemerkt und aufgrund niedriger Messfrequenz wegen des nachts oft reduzierten Personaleinsatzes meistens übersehen. Auch vor sich anbahnenden Dysglykämien können POC-Messungen oft nicht warnen.
All diese Limitationen können durch den Einsatz von CGM im Krankenhaus erheblich reduziert werden:
- Glukosemesswerte und Trendpfeile stehen kontinuierlich zur Verfügung und werden mit dem medizinischen Fachpersonal geteilt.
- Dies ermöglicht bessere Therapieanpassungen und die Prävention von Dysglykämien, insbesondere Hypoglykämien.
- Vor Notfällen wird durch Echtzeitalarme gewarnt.
Die folgenden Ausführungen beziehen sich weitgehend auf Erwachsene. Die Situation für Kinder ist komplexer, da Kinder (mit T1D) zunehmend zusätzlich automatisierte Insulinpumpen nutzen.
In den letzten Jahren sind mehrere Empfehlungen und Leitlinien zum Einsatz von CGM im Krankenhaus erschienen: Die ADA empfiehlt Personen, die ein CGM-System verwenden, dies im Krankenhaus weiterhin zu tun. POC-Glukosemessungen zur Optimierung der Insulindosierung und zur Bestätigung von Hypoglykämien sollen ergänzend durchgeführt werden. Zum jetzigen Zeitpunkt hat die amerikanische Zulassungsbehörde Food and Drug Administration (FDA) jedoch noch nicht die Zulassung für die Neu-Inbetriebnahme eines CGM-Systems im Krankenhaus erteilt. Während der COVID-19-Pandemie gab es eine befristete Ausnahmegenehmigung (die zum 7. November 2023 auslief). Seit dieser Zeit gibt es Daten zur Effektivität und Sicherheit der Verwendung von CGM im Krankenhaus [ADA Professional Practice Committee 2025b].
Auch die Endocrine Society (ES) empfiehlt für Personen, die CGM-Systeme nutzen, dies im Krankenhaus weiterhin zu tun, kombiniert mit POC-Glukosemessungen. Außerdem sollten über die elektronische Patientenakte (ePA; Electronic Medical Record, EMR) bei der Aufnahme alle Personen identifiziert werden, die eines der in Infokasten 1 genannten Kriterien für ein erhöhtes Risiko für Hypoglykämien erfüllen. Hierzu können beispielsweise automatisiert relevante ICD-10 Codes abgefragt werden. Bei diesen Personen sollten ebenfalls CGM-Systeme eingesetzt werden [McCall 2023].
Die American Association of Clinical Endocrinology (AACE) empfiehlt ebenfalls die Weiternutzung von CGM-Systemen bei hospitalisierten Personen mit Diabetes. Gleichzeitig merkt die AACE an, für hospitalisierte Personen mit Diabetes sei es oft eine Herausforderung, ihre CGM-Systeme weiterhin nutzen zu können. Dies könne daran liegen, dass es keine einheitlichen Krankenhausleitlinien gäbe oder dass das Krankenhauspersonal nicht über die nötige Erfahrung im Umgang mit dieser Technologie verfüge [Grunberger 2021].
Die DDG fordert beim Einsatz von CGM im Krankenhaus die Berücksichtigung u. a. folgender praktischer Aspekte [Müssig 2024]:
- Laut DDG dürfen CGM-Systeme für Therapieentscheidungen im Krankenhaus auch in Deutschland noch nicht verwendet werden. Daher seien weiterhin zusätzlich POC-Glukosemessungen mit Kapillarblut erforderlich (z. B. Glukose-Tagesprofil). Diese Empfehlung ist allerdings teilweise überholt: Inzwischen gibt es in der EU auch CGM-Systeme einzelner Hersteller, die außer für die Verwendung in der häuslichen Umgebung auch für die Verwendung in Einrichtungen des Gesundheitswesens durch die Nutzer selbst und durch medizinisches Fachpersonal bestimmt sind [Abbott 2024].
- POC-Glukosemessungen sind unter anderem auch bei Diskrepanzen zwischen den CGM-Daten und bestehenden Symptomen sowie bei Verdacht auf Hypoglykämie erforderlich.
- CGM-Systeme dürfen nicht an einer Körperpartie mit generalisierten Ödemen oder Hautinfektionen eingesetzt werden.
- Die Messgenauigkeit der CGM-Systeme kann infolge von herabgesetzter Gewebedurchblutung, Hypotonie, Hypothermie, Hypoxie und Verwendung von Vasopressoren beeinträchtigt sein. Deshalb ist CGM für die Verwendung bei kritisch kranken Personen derzeit noch kontraindiziert und sollte nicht auf Intensivstationen eingesetzt werden.
- Bestimmte Substanzen wie Paracetamol, Maltose, Ascorbinsäure, Dopamin, Mannitol, Heparin, Harnsäure, Hydroxyharnstoff und Salicylsäure können bei manchen CGM-Systemen zu Interferenzen führen. Ausmaß und Richtung der Interferenz sind je nach CGM-System unterschiedlich (Herstellerangaben beachten).
- Auch von der DDG gemachte Einschränkungen bezüglich der Verwendung von CGM-Systemen während Computertomografie (CT)- und Magnetresonanztomografie (MRT)-Untersuchungen sind teilweise überholt und treffen nicht mehr auf alle CGM-Systeme zu [Galindo 2020, Matievich 2023]. Gemäß einer internationalen, von der Diabetes Technology Society (DTS) initiierten Konsensus-Empfehlung zum Einsatz von CGM im Krankenhaus kann hier auch eine Bleiabschirmung helfen [Galindo 2020].
- Weitere Einschränkungen können bestehen (Herstellerangaben beachten).
Wichtige Empfehlungen der DDG für Gesundheitsorganisationen, die die Integration von CGM-Daten in die ePA realisieren wollen, lauten auszugsweise [Reger-Tan 2024]:
- Benennung eines Teams, das die Integration von CGM-Daten in die ePA unterstützt.
- Definition eines Minimums an beruflichen Kernkompetenzen für Teammitglieder, die Diabetes-Technologie in der Patientenversorgung einsetzen.
- Entwicklung von Standardprotokollen für Daten-Uploads und Daten-Integration in die ePA.
- Bereitstellung von Schulungsunterlagen und Checklisten oder Anleitungen zum Hochladen von Daten für die CGM nutzenden Personen.
Weitere Fachgesellschaften und Arbeitsgruppen haben eigene Empfehlungen zum Einsatz von CGM im Krankenhaus erarbeitet [Galindo 2020, Shaw 2024, Freckmann 2024].
- höheres Alter
- Kinder (insbesondere Kleinkinder und Vorschulkinder)
- Einnahme von Hypoglykämie verursachenden Medikamenten (z. B. Insulin, Sulfonylharnstoffe, Glinide)
- eingeschränkte Nieren- oder Leberfunktion
- Vorgeschichte schwerer Hypoglykämien
- kognitive oder intellektuelle Einschränkungen, die die Fähigkeit zur Reaktion auf eine niedrige Blutglukosekonzentration beeinträchtigen können
- eingeschränktes Wahrnehmungsvermögen für Hypoglykämie (Hypoglycemia Unawareness)
- lange Diabetesdauer (einschließlich Insulinverwendung seit ≥ 5 Jahren)
- erhöhter Alkoholkonsum
- Essstörungen
- unregelmäßiges Essverhalten
- Fasten aus religiösen oder kulturellen Gründen
- unbehandelte Hypophysen-, Nebennieren- oder Schilddrüseninsuffizienz in der Vorgeschichte
Hoher klinischer Nutzen von CGM im Krankenhaus
In einer Studie wurden eine hohe Messgenauigkeit und Zuverlässigkeit verschiedener CGM-Systeme beim Einsatz im Krankenhaus gezeigt: CGM-Messungen wurden mit POC-Glukosemessungen verglichen und mittels eines Clarke Error Grids [Clarke 1987] bewertet. Dabei lagen 99,1 % aller CGM-Messwerte im optimalen oder akzeptablen Bereich (Zonen A und B), während nur 0,9 % in den kritischen Bereichen (Zonen D und E) lagen. Das sogenannte 20/20-Kriterium (siehe unten) wurde von 90,7 % aller Messungen erfüllt [van Baal, ahead of print].
Inzwischen wächst die Zahl der Studien, die auch den klinischen Nutzen des Einsatzes von CGM im Krankenhaus belegen: In einer dänischen Studie konnte die TIR um 15 Prozentpunkte gesteigert werden, hauptsächlich durch die Senkung der TAR. Außerdem waren die TBR, die glykämische Variabilität, prolongierte Hypoglykämien und der Insulinverbrauch vermindert und Komplikationen traten seltener auf [Olsen 2025]. In einer US-amerikanischen Studie senkte der Einsatz von CGM die mittlere Glukosekonzentration im Vergleich zu POC-Glukosemessungen um 18,5mg/dL (1,0mmol/L) und die Zeit im Bereich >250mg/dL (>13,9mmol/L) um 11,4%. Er steigerte die Zeit im Bereich 70 – 180mg/dL (3,9 – 10,0mmol/L) um 27,2% und die Zeit im Bereich 70 – 250mg/dL (3,9 – 13,9mmol/L) um 11,3%. Hypoglykämien waren in dieser Studie selten und in beiden Gruppen gleich [Fortmann 2020]. In einer anderen US-amerikanischen Studie führte der Einsatz von CGM zu weniger Hypoglykämien <70mg/dL (<3,9mmol/L), weniger klinisch signifikanten Hypoglykämien <54mg/dL (<3,0mmol/L) und einem geringeren Prozentsatz an Zeit im hypoglykämischen Bereich [Singh 2020]. In einer weiteren US-amerikanischen Studie kam es bei Personen mit einem oder mehreren hypoglykämischen Ereignissen in der CGM-Gruppe im Vergleich zur POC-Gruppe zu einer signifikanten Verringerung des erneuten Auftretens von Hypoglykämien (1,8 vs. 2,8 Ereignisse pro behandelter Person), wobei die TIR unverändert blieb [Spanakis 2022]. Auf einer pneumologischen Station in den USA konnte die Anzahl von Hypoglykämien durch den Einsatz von CGM um 44,5% gesenkt werden [Thullen 2024].
Das Konsensus-Gremium der DTS hat 11 Studien evaluiert, die den Einsatz von CGM auf Nicht-Intensivstationen mit POC-Glukosemessungen verglichen haben. CGM führte zu einer verbesserten Erkennung und Prävention von Hypo- und Hyperglykämien, insbesondere von nächtlichen und asymptomatischen Hypoglykämien [Galindo 2020]. Hier liegt ein großer Vorteil von CGM: Asymptomatische Hypoglykämien werden durch POC-Glukosemessungen nicht systematisch gefunden, sondern bestenfalls zufällig entdeckt.
Auf Intensivstationen sollen Hyperglykämien unbedingt vermieden und das Hypoglykämie-Risiko gleichzeitig minimiert werden. Der Einsatz von CGM auf Intensivstationen stellt eine besondere Herausforderung dar, denn mehrere Faktoren können bei schwer erkrankten Personen die Messgenauigkeit von CGM-Systemen beeinträchtigen. Dazu gehören vor allem:
- Faktoren, die die Gewebedurchblutung oder -temperatur beinträchtigen wie Hypotonie, Verwendung von Vasopressoren, Dehydratation, Hypoxie oder Hypothermie und
- Interfenzen durch Arzneimittel und andere Substanzen.
Dennoch wurde CGM auch auf Intensivstationen bereits erfolgreich eingesetzt. Während der COVID-19-Pandemie wurde beispielsweise eine US-amerikanische Studie durchgeführt mit den Zielen:
- Optimierung der Glukosekontrolle bei Personen, die mit intravenösem Insulin überwiegend auf der Intensivstation behandelt wurden
- aktuellere Glukosedaten
- Verringerung der Anzahl von POC-Glukosemessungen
- Verringerung der Exposition des Personals gegenüber hochinfektiösen Personen
- Minimierung des Verbrauchs an Schutzkleidung
Alle Ziele wurden erreicht. Abweichungen zwischen CGM- und POC-Glukosemesswerten waren selten. Personen, die auf Intensivstationen behandelt wurden, befanden sich > 50 % der Zeit im Bereich von 70 – 180 mg/dL (3,9 – 10,0 mmol/L), < 1 % der Zeit bei < 70 mg/dL und < 10 % der Zeit bei > 250 mg/dL (13,9 mmol/L). Hypoglykämien wurden zu 34,4 % häufiger detektiert als zuvor. Eine Umfrage unter dem medizinischen Fachpersonal zeigte außerdem eine hohe Akzeptanz des Konzepts. Zeitaufwand und Kosten konnten gesenkt werden [Good 2025].
Das Konsensus-Gremium der DTS hat acht Studien evaluiert, die den Einsatz von CGM auf Intensivstationen mit POC-Glukosemessungen verglichen, und schließt daraus, dass der Einsatz von CGM zu besseren klinischen Ergebnissen, weniger Komplikationen und einer kürzeren Verweildauer führt, da engere glykämische Zielvorgaben mit höherer Wahrscheinlichkeit eingehalten werden [Galindo 2020].
Auch die Zufriedenheit der stationär behandelten Personen steigt durch CGM: In einer US-amerikanischen Studie wurde berichtet, dass sich Personen im Krankenhaus mit Zugang zu CGM-Daten besser befähigt fühlten, das Glukosemanagement mit dem medizinischen Fachpersonal zu besprechen, und angaben, eine bessere Kontrolle über ihre Glukoseverläufe zu haben [Lee 2024].
- Glukosesensor mit Sender, Empfänger (Smartphone oder Kontroller)
- Herkunft von CGM-Systemen (patienteneigene vs. krankenhauseigene)
- Desinfektion, Durchführung der Platzierung und Entfernung des Glukosesensors, Überprüfung auf Hautreaktionen
- Einschränkungen: nicht bei Ödemen oder Hautinfektionen, in Operationsgebieten oder Wunden
- Glukosekonzentration in der interstitiellen Flüssigkeit versus Blut, Verständnis des Zeitversatzes (Lag Time)
- kontinuierliche Messungen versus einzelne Datenpunkte
- akzeptable Unterschiede zwischen CGM-Messwerten und POC-Glukosemesswerten (20/20-Regel)
- Kalibration des Glukosesensors (falls möglich/erforderlich)
- bildgebende Verfahren mit elektromagnetischer Strahlung
- Diathermie, Kardioversion
- Interferenzen durch Arzneimittel und andere Substanzen
- herabgesetzte Gewebedurchblutung z. B. bei Hypotonie, Hypothermie, Hypoxie oder Verwendung von Vasopressoren
- Berechnung von Insulin-Dosierungsempfehlungen und Insulin-Basalraten
- Vorhersage und Vorbeugung von Hypoglykämien und Hyperglykämien
- angemessene Reaktion auf Systemwarnungen und Alarme
- Dokumentation der Reaktion auf Systemwarnungen und Alarme
- Anzeige von CGM-Daten auf Smartphones, Kontrollern oder anderen Lesegeräten (z. B. Tablets)
- Integration und Auffindbarkeit von CGM-Daten in der elektronischen Patientenakte (ePA)
Integration von CGM in bestehende Arbeitsabläufe
Es wird empfohlen, dass das Krankenhaus für den Einsatz von CGM im Rahmen seines Qualitätsmanagements Standardarbeitsanweisungen (Standard Operating Procedures, SOPs) erstellt, die verschiedene Aspekte umfassen sollten:
1. Verwendete CGM-Systeme
Hospitalisierte Personen mit T1D, die eine automatisierte Insulinpumpe nutzen, die mit ihrem CGM-System kommuniziert, müssen ihr eigenes CGM-System zur Fortführung der Therapie weiter verwenden, weil automatisierte Insulinpumpen in der Regel an ein spezielles CGM-System gebunden sind. In allen anderen Fällen kann Einsatz von CGM im Krankenhaus nach verschiedenen Szenarien erfolgen:
a. Die hospitalisierte Person verwendet bereits ein CGM-System und ist trotz ihrer Erkrankung in der Lage, dieses während des stationären Aufenthalts weiterhin zu verwenden.
- Vorteile: (1) Die Person ist mit dem CGM-System vertraut. (2) Dem Krankenhaus entstehen keine Kosten für Smartphones oder Kontroller, möglicherweise auch nicht für Glukosesensoren. (3) Die Person kann ihr CGM-System nach Entlassung weiterverwenden.
- Nachteile: (1) CGM-Systeme verschiedener Hersteller haben einen unterschiedlichen Verwendungszweck, ihre Messgenauigkeit ist verschieden, sie sind bei CT- und MRT-Aufnahmen unterschiedlich zu handhaben und weisen verschiedene Interferenzen durch Arzneimittel oder andere Substanzen auf. Das Personal muss diesbezüglich geschult werden. (2) Solange keine Standards existieren, benötigt jedes CGM-System eine eigene Schnittstelle zur digitalen Infrastruktur des Krankenhauses. (3) Solange eine solche Schnittstelle nicht existiert, hat das Krankenhauspersonal zeitweise keinen Zugriff auf die Daten (z. B. schlafende oder bewusstlose Person).
b. Die hospitalisierte Person verwendet bereits ein CGM-System. Dieses wird während des stationären Aufenthalts durch ein krankenhauseigenes System ersetzt. Nach der Entlassung wird wieder das ursprüngliche CGM-System verwendet.
- Vorteile: (1) Das Personal braucht nicht auf verschiedene CGM-Systeme geschult werden. (2) Die Messwerte sind vergleichbarer. (3) Es wird nur eine Schnittstelle zur digitalen Infrastruktur des Krankenhauses benötigt.
- Nachteile: (1) Die Person muss auf das neue CGM-System geschult werden. (2) Dem Krankenhaus entstehen Kosten für Smartphones, Kontroller und Glukosesensoren.
c. Die hospitalisierte Person verwendet noch kein CGM-System, bekommt stationär ein krankenhauseigenes CGM-System und verwendet, soweit erforderlich und im ambulanten Bereich verordnungsfähig, nach der Entlassung weiterhin ein CGM-System. Die Vor- und Nachteile sind identisch zu Szenario b.
Eine Diebstahlsicherung wird empfohlen, insbesondere wenn als Lesegeräte teure krankenhauseigene Smartphones eingesetzt werden. Ausgabe und Rücknahme erfolgen mittels Checkliste.
2. Anpassung der CGM-Systeme an stationäre Erfordernisse
Die ADA empfiehlt für hospitalisierte Personen mit Hyperglykämie auf Nicht-Intensivstationen einen Zielbereich von 100 – 180 mg/dL (5,6 – 10,0 mmol/L) und für solche auf Intensivstationen einen Zielbereich von 140 – 180 mg/dL (7,8 – 10,0 mmol/L). Strengere Zielbereiche sind akzeptabel, sofern sie ohne das Auftreten von Hypoglykämien erreicht werden können [ADA Professional Practice Committee 2025b]. Abhängig von den Angaben des Herstellers wird nach etwa fünf Tagen der GMI berechnet und nach etwa sieben Tagen ein AGP erstellt.
3. Schulung
Das Krankenhauspersonal muss adäquat geschult werden. Es gibt bereits ein Konzept der DDG zur Basisqualifikation Diabetes Pflege [DDG 2025], das allerdings zurzeit noch kein CGM-Modul beinhaltet. Es kann sinnvoll sein, hier auch die Hersteller der CGM-Systeme einzubinden. Personen, die auf ein krankenhauseigenes CGM-System umgestellt werden oder ein solches neu erhalten, müssen ebenfalls geschult werden. Danach können diese z. B. ihre Insulindosis zu den Mahlzeiten eigenständig berechnen. Wichtige Schulungsinhalte sind in Infokasten 2 zusammengefasst.
4. Qualitäts- und Plausibilitätskontrolle
CGM-Daten sind keine Labordaten und unterliegen daher nicht den Richtlinien der Bundesärztekammer zur Qualitätssicherung in medizinischen Laboratorien (Rili-BÄK) [Bundesärztekammer 2023]. Dennoch ist eine Qualitätskontrolle im Rahmen des Qualitätsmanagements des Krankenhauses erforderlich. Dabei wird z. B. einmal am Tag, in der Regel morgens, am besten nüchtern vor Insulingabe und Frühstück, der aktuelle CGM-Glukosemesswert mit dem einer POC-Glukosemessung verglichen. Weichen diese um nicht mehr als 20 mg/dL (1,1 mmol/L) für Messwerte bis 100 mg/dL (5,6 mmol/L) oder mehr als 20 % für höhere Messwerte ab, wird das CGM-System für 24 Stunden freigegeben. Andernfalls wird der Glukosesensor getauscht. Dieses sogenannte 20/20-Kriterium [Lee 2024] wird auch von den Joint British Diabetes Societies for Inpatient Care (JBDSIC) empfohlen [Avari 2025]. Es ist etwas weiter gefasst als das 15/15-Kriterium der FDA für sogenannte integrierte CGM-Systeme [FDA 2022].
Zusätzlich erfolgt stets eine POC-Glukosemessung, wenn der CGM-Messwert aus klinischer Sicht unplausibel erscheint.
Das Krankenhaus sollte zudem festlegen, unter welchen Bedingungen gegebenenfalls zusätzliche POC-Glukosemessungen durchgeführt werden. Falls die stationären Personen die zusätzlichen POC-Glukosemessungen ablehnen, sollte dies dokumentiert werden.
5. Bewertung der CGM-Daten
CGM-Daten und daraus konsolidierte Parameter und Darstellungen (z. B. GMI, AGP) werden bei jeder Visite bewertet, um die Glukosekontrolle zu steuern und die Therapie zu optimieren. Sie ergänzen die Messung von Blutdruck, Herzfrequenz, Temperatur und Sauerstoffsättigung und können als fünfter kontinuierlich verfügbarer Vitalparameter betrachtet werden. Die Daten sollten idealerweise z. B. via Tablets rund um die Uhr dem Krankenhauspersonal zur Verfügung stehen.
Die Dokumentation dieser Daten ist zugleich Ausgangspunkt für das interdisziplinäre Management der Personen mit der Haupt- oder Nebendiagnose Diabetes und ermöglicht weiterhin eine verbesserte überregionale Versorgung (Stichwort Experten-Mangel) und eine Kontinuität der Behandlung bei Entlassung in die ambulante Versorgung. Dafür müssen diese Daten auch im ambulanten Bereich verfügbar gemacht werden.
Trotz aller Vorteile der Einführung von CGM im Krankenhaus gibt es Barrieren, die jedoch überwindbar sind (Infokasten 3).
- Mangel an geschultem klinischen Personal für die Inbetriebnahme und Überwachung der CGM-Systeme
- mangelndes Wissen bezüglich Vorteilen und Einschränkungen/Kontraindikationen
- mangelndes Wissen bezüglich der Interpretation von CGM-Messwerten und daraus konsolidierten Parametern und Darstellungen (z. B. AGP, GMI)
- mangelndes Vertrauen in die Genauigkeit von CGM-Messwerten
- befürchteter Mehraufwand für Qualitätskontrolle
- fehlende digitale Infrastruktur im Krankenhaus
- fehlende Drittanbieter-Softwaresysteme
- Datenschutz-Bedenken
- wirtschaftliche Bedenken
- logistische Bedenken (z. B. Verfügbarkeit von Glukosesensoren für patienteneigene CGM-Systeme im Krankenhaus)
Etablierung einer adäquaten digitalen Infrastruktur
Ohne digitale Infrastruktur des Krankenhauses können CGM-Daten nur direkt am Krankenbett genutzt werden. Für eine darüber hinausgehende Nutzung der Daten ist eine adäquate digitale Infrastruktur erforderlich. CGM-Systeme ermöglichen in der Regel das Teilen der Daten mit Dritten (Data Sharing). Dazu werden die CGM-Daten mit dem Einverständnis des Nutzers in der Cloud des CGM-Herstellers gespeichert und der Nutzer kann Dritten durch aktive Einladung Zugriff auf diese gewähren (das Einverständnis kann jederzeit widerrufen werden.) So kann der Nutzer dem Krankenhaus erlauben, die CGM-Daten abzurufen und über eine in der Regel vom CGM-Hersteller programmierte Schnittstelle (Application Programming Interface, API) in die digitale Infrastruktur des Krankenhauses zu importieren und so für das Krankenhauspersonal verfügbar zu machen.
Was mit diesen Daten dort geschieht, ist von den Möglichkeiten der lokalen digitalen Infrastruktur abhängig. Prinzipiell können diese Daten in verschiedener Weise genutzt werden:
- Messwerte, Trends und Alarme, aber auch konsolidierte Darstellungen und Parameter wie das AGP oder der GMI, können dem Krankenhauspersonal in Echtzeit z. B. auf Tablets verfügbar gemacht werden. Dies ermöglicht Reaktionen in Echtzeit, auch über große Distanzen hinweg. Es können auch automatisch Listen generiert werden, die die Priorität einer akuten Intervention durch das Krankenhauspersonal beinhalten.
- Zur Qualitätssicherung sollten die CGM-Glukosewerte, vergleichende POC-Glukosewerte und Parameter wie die Erfüllung oder Nichterfüllung des 20/20-Kriteriums in der Patientenkurve gemeinsam dargestellt werden.
- CGM-Daten können mit weiteren Daten, z. B. der Zusammensetzung der von der Person gewählten Mahlzeiten und Informationen von Insulin-Smart-Pens oder Insulin-Pumpen, verknüpft werden.
- Aus diesen Daten könnten in Zukunft automatisiert Therapieempfehlungen erstellt werden (Clinical Decision Support, CDS): Z. B. könnten akute Insulin-Dosierungsempfehlungen berechnet, Insulin-Basalraten angepasst oder ganze Medikationspläne erstellt werden.
- Da CGM-Daten keine Labordaten sind, sollten sie auch nicht im Labor-Informationssystem (LIS) gespeichert werden. Stattdessen sollten sie zusammen mit anderen Daten wie Elektrokardiogramm- oder Röntgenbefunden im Krankenhaus-Informationssystem (KIS) gespeichert werden und somit z. B. auch für automatisiert erstellte Arztbriefe verfügbar gemacht werden.
- Die CGM-Daten können in die ePA importiert oder mit anderen Gesundheitsinstitutionen oder anderen behandelnden Ärzten geteilt werden. Als Minimum sollte das AGP in der ePA archiviert werden.
- Die Daten können in einem krankenhaus-internen sogenannten Medical Data Warehouse abgelegt werden. Mittels Algorithmen unter Verwendung von maschinellem Lernen können daraus Muster extrahiert und Vorhersagen getroffen werden. Damit würden neue KI-Anwendungen möglich.
- Die Daten können anonymisiert exportiert und für die Forschung verfügbar gemacht werden.
Selbstverständlich unterliegt jede Nutzung der Daten den gesetzlichen Datenschutzbestimmungen und erfordert das Einverständnis der Person, von der sie stammen.
Die obengenannten Anwendungen werden zurzeit im Rahmen von Pilotprojekten in einzelnen Kliniken entwickelt. Dies ist jedoch auf die Dauer unökonomisch. Daher ist es wünschenswert, dass derartige Lösungen letztendlich als Medizinprodukte von Software-Firmen verfügbar gemacht werden.
Erste Empfehlungen für die Einbindung von CGM-Daten in die ePA wurden kürzlich publiziert [Espinoza 2022, Reger-Tan 2024].
Ausblick: Bessere Versorgung durch digitale Diabetesstrategie
Die Nutzung von CGM-Systemen im Krankenhaus erfolgt idealerweise im Rahmen einer digitalen Diabetesstrategie [Tan 2024]. Diese optimiert die Versorgung im Krankenhaus sowie im ambulanten Bereich:
- Bei stationärer Aufnahme erfolgt generell ein Screening auf Diabetes. Bei positivem Befund wird automatisiert ein spezielles Diabetes-Team informiert. Dieses erhält Zugang zu allen Daten und kann Personen auf allen Stationen aus der Ferne betreuen (Telemedizin).
- Intrasektorale und transsektorale Kommunikation werden verbessert: Diabetes-Teams in spezialisierten Krankenhäusern können bei Bedarf auch weitere Krankenhäuser telemedizinisch betreuen. Durch die Verfügbarmachung von Daten aus dem Krankenhaus im ambulanten Bereich und andersherum wird Behandlungskontinuität erreicht.
- Auch eine rein virtuelle Betreuung von ambulant behandelten Personen mit Diabetes wird so möglich. Dass beispielsweise die durch schrittweise Titration erfolgende Einstellung auf ein Basalinsulin (basal unterstützte orale Therapie, BOT) virtuell funktioniert, wurde in einer US-amerikanischen Studie gezeigt: Personen mit Diabetes übermittelten über Amazon Alexa verbal Nüchternglukose-Daten an eine spezielle künstliche Intelligenz (KI) und erhielten im Anschluss von dieser Anweisungen zur Insulin-Dosisanpassung [Nayak 2023]. Mittels CGM ist eine weitere Optimierung der Basalinsulin-Titration möglich [Aradóttir 2021, Thomsen 2024, Ying 2025]. In einer aktuellen Studie, in der CGM für die Insulintitration bei einer BOT verwendet wurde, wurden ein Anstieg der TIR von 54,4 % auf 76,4 % und ein Rückgang der TAR von 45,2 % auf 22,9 % beobachtet. Die TBR blieb während der gesamten Studie niedrig. Schwere Hypoglykämien traten nicht auf [Bergenstal 2025].
- Wenn CGM-Systeme künftig weitere Metabolite erfassen (z. B. Ketone, Laktat), kann eine solche Multisensorik das Management der stationär behandelten Personen weiter verbessern.
- Auf diese Weise können Prozessabläufe im Diabetesmanagement optimiert werden. Dies kann zu Zeit- und Kostenersparnis, höherer Arbeitszufriedenheit und besseren Ergebnissen für die behandelten Personen führen.
- Die DDG hat das Konzept einer elektronischen Diabetesakte (eDA) vorgeschlagen (Abbildung 1). Dieses soll allen Personen mit Diabetes eine standardisierte, auswertbare, leitlinienbasierte Versorgung nach DDG-Standards und gemäß der Nationalen Versorgungs-Leitlinie sichern, unabhängig von der jeweiligen Krankenkasse, den Regionen oder der vorhandenen Arztdichte. Dies geschieht, ohne eine Parallelstruktur zur ePA aufzubauen. Die eDA wird Schnittstellen zu Krankenhausinformationssystemen und Praxisverwaltungssystemen im ambulanten Bereich haben sowie zu Portalen für Leistungserbringer und behandelte Personen. Außerdem ist eine Schnittstelle zu einem künftigen Diabetesregister vorgesehen. Dieses soll der Forschung und Entwicklung, der Optimierung der Versorgung sowie der Evaluierung neuer Medizinprodukte, digitaler Gesundheitsanwendungen (Apps, DiGA) und Medikamente im Bereich Diabetes dienen [Müller-Wieland 2021].
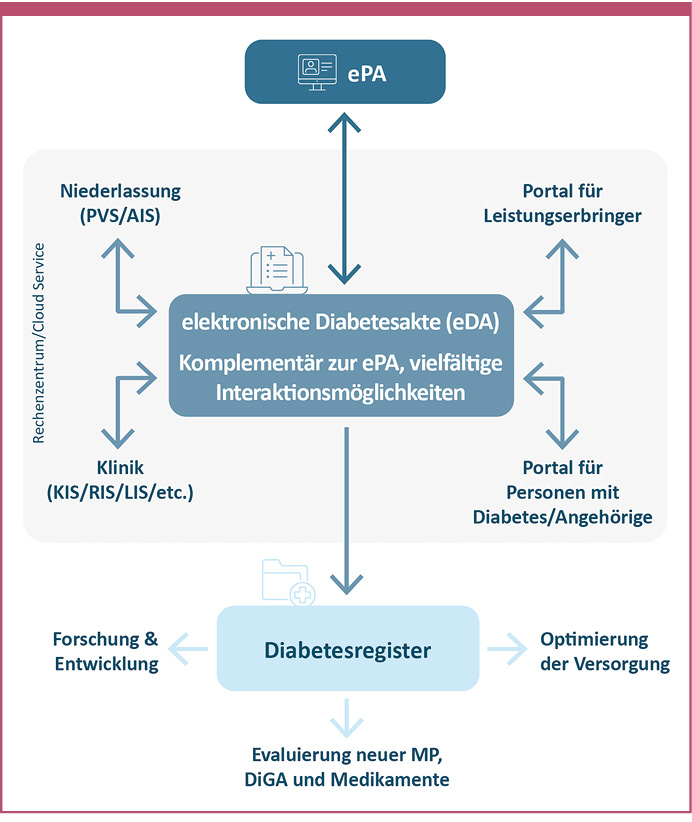 Abb. 1: Die von der Deutschen Diabetes Gesellschaft (DDG) vorgeschlagene elektronische Diabetesakte (eDA) einer Person mit Diabetes ist komplementär zur elektronischen Patientenakte (ePA). Die eDA ermöglicht vielfältige Interaktionsmöglichkeiten mit der ePA sowie mit Praxisverwaltungssystemen (PVS) und Arztinformationssystemen (AIS) im ambulanten Sektor und mit Krankenhaus-, Röntgen- und Laborinformationssystemen (KIS, RIS, LIS) im stationären Sektor. Außerdem kann sie von Leistungserbringern und Personen mit Diabetes und ihren Angehörigen genutzt werden. Die Person mit Diabetes ist Eigentümer der Daten. Mit ihrem Einverständnis fließen die Daten in ein angeschlossenes Diabetesregister, wo sie zur Evaluierung neuer Medizinprodukte (MP), digitaler Gesundheitsanwendungen (DiGA) und Medikamente sowie zur Optimierung der Versorgung und für die Forschung und Entwicklung genutzt werden können [modifiziert nach Müller-Wieland 2021].
Abb. 1: Die von der Deutschen Diabetes Gesellschaft (DDG) vorgeschlagene elektronische Diabetesakte (eDA) einer Person mit Diabetes ist komplementär zur elektronischen Patientenakte (ePA). Die eDA ermöglicht vielfältige Interaktionsmöglichkeiten mit der ePA sowie mit Praxisverwaltungssystemen (PVS) und Arztinformationssystemen (AIS) im ambulanten Sektor und mit Krankenhaus-, Röntgen- und Laborinformationssystemen (KIS, RIS, LIS) im stationären Sektor. Außerdem kann sie von Leistungserbringern und Personen mit Diabetes und ihren Angehörigen genutzt werden. Die Person mit Diabetes ist Eigentümer der Daten. Mit ihrem Einverständnis fließen die Daten in ein angeschlossenes Diabetesregister, wo sie zur Evaluierung neuer Medizinprodukte (MP), digitaler Gesundheitsanwendungen (DiGA) und Medikamente sowie zur Optimierung der Versorgung und für die Forschung und Entwicklung genutzt werden können [modifiziert nach Müller-Wieland 2021].
Die Digitalisierung im Krankenhaus hat das Potenzial, die stationäre Versorgung von Personen mit Diabetes oder anderen Dysglykämien auf ein neues Niveau zu heben und Herausforderungen wie dem Expertenmangel zu begegnen. Kontinuierlich erhobene Glukosedaten stellen dabei einen relevanten Grundpfeiler einer digitalen Diabetesstrategie dar. Der potenzielle Nutzen des Einsatzes von CGM im Krankenhaus liegt in der Verbesserung der Behandlungsqualität, der Vermeidung von Komplikationen, der Reduktion von Verweildauer und Wiederaufnahmen, einer höheren Patientenzufriedenheit, verbesserten Prozessabläufen, der Entlastung des medizinischen Fachpersonals und Kosteneinsparungen (Abbildung 2). Somit sollte CGM im Krankenhaus ein wichtiger Bestandteil einer umfassenden digitalen Diabetesstrategie sein.
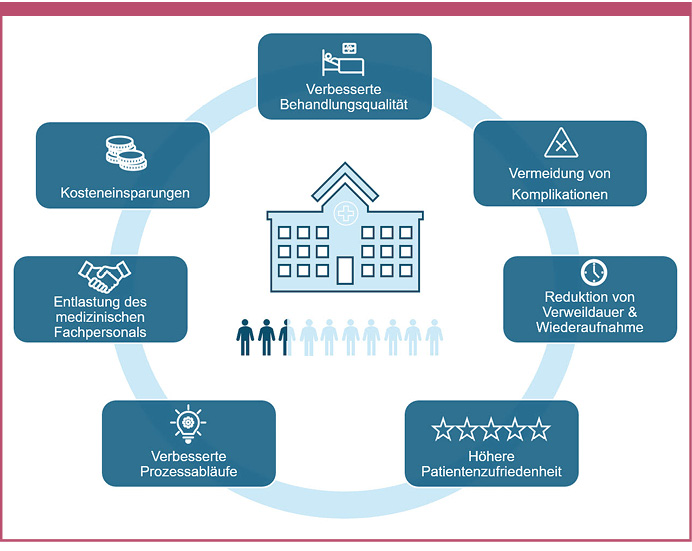 Abb. 2: Der Einsatz von CGM im Krankenhaus bei Personen mit Dysglykämien oder Risiko für Dysglykämien hat einen hohen potenziellen Nutzen bezüglich verschiedener Dimensionen der Versorgungsqualität.
Abb. 2: Der Einsatz von CGM im Krankenhaus bei Personen mit Dysglykämien oder Risiko für Dysglykämien hat einen hohen potenziellen Nutzen bezüglich verschiedener Dimensionen der Versorgungsqualität.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2025; 34 (5) Seite 271-282


