Diabetes beeinflusst nicht nur Blutgefäße im Herzen, sondern auch elektrische Leitungsbahnen. Das kann zu Herzrhythmusstörungen führen. Was zu tun ist, lesen Sie hier.
Diabetes mellitus ist eine Stoffwechselerkrankung, bei der entweder ein Mangel an Insulin (Typ-1-Diabetes) oder eine verminderte Insulinwirkung (Typ-2-Diabetes) zu erhöhten Glukosewerten führt. Zahlreiche Studien haben gezeigt, dass diese chronische Hyperglykämie mit erhöhter kardiovaskulärer Morbidität und Mortalität verbunden ist. Nicht ohne Grund heißt das Leitbild der Diabetologie im Herz- und Diabeteszentrum NRW "Mit Diabetes leben ohne Gefäßkomplikationen" – und auch die Stiftung DHD (Der herzkranke Diabetiker) verfolgt seit über zwei Jahrzehnten das Ziel, auf die kardiale und vaskuläre Gefährdung aufmerksam zu machen. Allerdings beeinflusst Diabetes nicht nur Blutgefäße im Herzen, sondern auch elektrische Leitungsbahnen, was zu Erregungsleitungsstörungen und damit verbundenen Herzrhythmusstörungen führen kann. Neue Evidenz hat hier nun die enge Verbindung zwischen diabetischen Stoffwechselstörungen und kardialen Erkrankungen bestätigt.
Sinustachykardie als Folge der Schädigung des autonomen Nervensystems
Eine Arrhythmie bezeichnet eine zu schnelle, zu langsame oder irreguläre Aktivität des Herzrhythmus. Eine der Arrhythmien, die bei Diabetespatienten am häufigsten dokumentiert wird, ist die Sinustachykardie. Als Sinustachykardie wird eine erhöhte Herzfrequenz, die vom primären Schrittmacherzentrum (Sinusknoten) ausgeht, bezeichnet. Bei Diabetes ist diese Herzrhythmusstörung Konsequenz der Schädigung des autonomen Nervensystems, wodurch die Herzfrequenz nicht mehr auf die Erfordernisse des Alltags adäquat eingestellt werden kann. Die Schädigung oder der Verlust dieser Nerven steht für die Entstehung der kardiovaskulären autonomen diabetischen Neuropathie (KADN). Der genaue Pathomechanismus ist jedoch weiterhin nicht genau geklärt. Vermutet wird, dass metabolische Beeinträchtigungen, eine neurovaskuläre Insuffizienz sowie Autoimmunschäden und ein Mangel an neurohormonellen Wachstumsfaktoren eine KADN begünstigen können (1). Die KADN betrifft bis zu 17% der Typ-1-Diabetiker und 22% der Patienten mit Typ-2-Diabetes. 40% der Patienten, die eine Insulintherapie benötigen, entwickeln im Verlauf eine KADN (2). Dies darf in der Betreuung von Diabetespatienten nicht außer Acht gelassen werden. In einer Metaanalyse von Chowdhury et al. aus dem Jahr 2021, in der 35 Studien mit einer Gesamtpatientenzahl von 16099 zusammengefasst wurde, konnte ein 3,16-fach erhöhtes gepooltes relatives Risiko für das zukünftige Erleiden von kardiovaskulären Ereignissen und eine 3,17-fach erhöhte Gesamtmortalität bei Patienten mit KADN nachgewiesen werden (2).
Die genauen Hintergründe, die bei KADN zu einer erhöhten Mortalität führen, sind bis heute nicht abschließend geklärt, wobei eine Prädisposition für maligne ventrikuläre Arrhythmien in Zusammenhang mit einer QT-Zeitverlängerung diskutiert wird (3). Bekannt ist bisher, dass ein Typ-2-Diabetes ein unabhängiger Prädiktor für das Auftreten von bösartigen Kammertachykardien ist und damit einen negativen Einfluss auf die Prognose der Patienten hat (4).
Struktureller Umbau des Vorhofs: Vorhofflimmern
Des Weiteren ist eine Assoziation zwischen Diabetes und Vorhofflimmern sehr gut nachgewiesen. Dabei geht die Erregung vom Vorhof aus und ist durch eine irreguläre und schnelle Herzfrequenz charakterisiert. Bei Patienten mit Diabetes ist der strukturelle Umbau des Vorhofs im Sinne einer Vorhoffibrose und Vorhofdilatation ein Hauptgrund für die Entstehung des Vorhofflimmerns (5). Diabetespatienten haben demnach ein 35 bis 40% höheres Risiko, im Laufe des Lebens Vorhofflimmern zu entwickeln. Ab einem HbA1c-Wert von 9% ist mit einem doppelten Risiko für das Auftreten von Vorhofflimmern zu rechnen (6). Die Zunahme des epikardialen und perikardialen Fettgewebes, die bei Menschen mit Diabetes ausgeprägt sein kann (7), steht dabei in einem engen Zusammenhang zu der Vergrößerung des linken Vorhofs, was wiederum ein bekannter Risikofaktor für das Entstehen eines Vorhofflimmerns ist (8).
Die meistgefährdete Altersgruppe umfasst die 40- bis 64-jährigen Patienten mit Diabetes, die ein um 50% höheres Risiko für Vorhofflimmern haben im Vergleich zu Patienten in diesem Alter ohne Diabetes. Wichtig für die behandelnden Ärzte ist, dass Patienten mit Vorhofflimmern und Diabetes eine weitaus höhere Symptomlast sowie geringere Lebensqualität haben und längere Krankenhausaufenthalte hinnehmen müssen (9).
Bei Unterbrechung der Überleitung vom Vorhof zur Kammer droht Herzstillstand
Der plötzliche Herztod repräsentiert eine der führenden Todesursachen bei jungen Patienten mit Diabetes. Obgleich mehrere Studien sich mit tachykarden Herzrhythmusstörungen beschäftigten, gab es bisher nur wenige Daten über die Korrelation zwischen Diabetes mellitus und bradykarden Herzrhythmusstörungen (10, 11). Eine der schwerwiegendsten bradykarden Herzrhythmusstörungen ist der atrioventrikulärer (AV) Block III. Grades, wo die Überleitung vom Vorhof zur Kammer komplett unterbrochen ist, was zum Herzstillstand führen kann. Nun liefern zuletzt veröffentliche Daten aus einer dänischen Registerstudie neue Evidenzen, welche die Verbindung zwischen Typ-2-Diabetes und AV Block III. Grades untermauern. Dafür wurden Daten aus dem dänischen nationalen Register mit insgesamt über 130 000 Patientendaten untersucht. Das mittlere Alter betrug 76 Jahre und 62% der Patienten waren männlich.
Typ-2-Diabetes als unabhängiger Faktor signifikant mit AV Block III. Grades verbunden
Die Ergebnisse der dänischen Registerstudie konnten den Nachweis erbringen, dass Patienten mit Typ-2-Diabetes ein 63% höheres Risiko haben, einen AV Block III. Grades zu entwickeln (12). Dafür wurden 25 995 Patienten mit AV Block III. Grades mit 130 004 Patienten aus der Kontrollgruppe verglichen. Die Gruppen waren nach Alter und Geschlecht (1:5-Matching) adjustiert. In der Cox-Regressionsanalyse nach Berücksichtigung der Komorbiditäten wie Bluthochdruck, Vorhofflimmern, Herzinsuffizienz und Myokardinfarkt war Diabetes mellitus Typ 2 als unabhängiger Faktor, signifikant mit einem atrioventrikulären Block III Grades verbunden. Nichtdestotrotz zeigte sich ebenso eine signifikante Verbindung in Bezug auf arterielle Hypertonie, Herzinsuffizienz, Vorhofflimmern sowie Myokardinfarkt, was jedoch vielmehr die enge Verflechtung von metabolischen Komponenten mit kardialen Erkrankungen unterstreicht (Abb. 1).
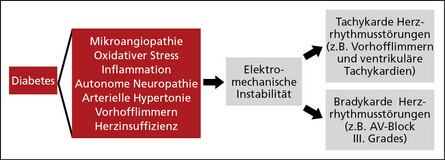
Verschiedene Mechanismen für Entstehung elektrischer Instabilität werden diskutiert
Obwohl die Pathophysiologie für die Entstehung der elektrischen Instabilität nicht geklärt ist, werden einige naheliegende Mechanismen diskutiert. Eine wesentliche Rolle könnte auch hier die KADN spielen, die sowohl auf das sympathische als auch auf das parasympathische Nervensystem wirkt. Hypoglykämien aktivieren zudem das sympathische Nervensystem, was durch proinflammatorische und pro-atherothrombotische Effekte sowie die Aktivierung des Renin-Angiotensin-Systems zu endothelialer Dysfunktion führen kann (13). Darüber hinaus können Elektrolytentgleisungen wie Hypo- oder Hyperkaliämien, die häufig aufgrund des Insulinmetabolismus bei Patienten mit Diabetes auftreten, zu Repolarisationsstörungen führen, was die elektrische Instabilität durch T-Wellen-Veränderungen und QT-Zeit-Verlängerungen zusätzlich erhöhen kann (14). Daneben können stille kardiale Ischämien sowie die diabetische Kardiomyopathie weitere mögliche Ursachen einer AV-Blockierung darstellen.
Regelmäßige kardiologische Kontrollen empfohlen
Mit der dänischen Studie gewinnt die Evidenz, die die enge Verbindung diabetischer Stoffwechselstörungen und kardialer Erkrankungen untermauert, beachtlich dazu. So konnte dargelegt werden, dass der Diabetes unabhängig von anderen kardiovaskulären Risikofaktoren eine übergeordnete Rolle nicht nur bei tachykarden Herzrhythmusstörungen, sondern auch bei der Entstehung von AV-Blöcken spielt. Damit könnten zumindest teilweise die Ursachen für das gehäufte Auftreten des plötzlichen Herztodes erklärt werden.
Die oben angegebenen Daten aus verschiedenen Studien zeigen, dass Patienten mit Diabetes mellitus zu einer sehr vulnerablen Population gehören, bei denen eine besondere Vorsicht geboten sein sollte, um zum Teil lebensbedrohliche Herzrhythmusstörungen nicht zu verpassen und das Risiko für diese zu minimieren. Regelmäßige kardiologische Kontrollen bei Patienten mit Diabetes mellitus einschließlich der Durchführung einer transthorakalen Echokardiographie sowie Elektrokardiographie sollten deshalb nicht vernachlässigt werden. Behandelnde Ärzte als auch Patienten sollten darauf sensibilisiert werden, um bei der Diagnose einer der Herzrhythmusstörung gegebenenfalls die entsprechende Behandlung einzuleiten. Ziel muss es sein, diese bei Diabetes auftretenden Komplikationen zu vermeiden.
|
|