Typ-2-Diabetes mellitus (T2DM) ist eine globale Epidemie. Es wird erwartet, dass 2035 weltweit 592 Mio. Personen betroffen sind [Guariguata 2014]. Im Jahr 2019 wurde in der Europäischen Union bei etwa 32,3 Millionen Erwachsenen Diabetes diagnostiziert. Schätzungen zufolge sind weitere 24,2 Millionen Menschen nicht diagnostiziert [Europäisches Parlament 2021]. T2DM kann die Lebenserwartung von Betroffenen in Abhängigkeit ihrer kardiovaskulären Komorbiditäten um bis zu 22 Jahre verkürzen[Schneider 2018].
Zusammenfassung
Epidemiologische Daten belegen einen engen, bidirektionalen Zusammenhang zwischen Diabetes mellitus und Herzinsuffizienz (HF). Liegen beide Erkrankungen in Kombination vor, ist die Prognose deutlich verschlechtert. Das Vorliegen eines Typ-2-Diabetes mellitus (T2DM) ist ein eigenständiger Risikofaktor für die Entwicklung von HF. Die Dunkelziffer ist hoch. Daher stellt sich die Frage, ob die Diagnose einer zuvor nicht bekannten HF mit einer jährlichen NT-proBNP-Screening-Strategie im Vergleich zu keinem Screening, d. h. einer Diagnose aufgrund von klinischen Zeichen, mit einem Zusatznutzen verbunden ist. Die analysierte Population umfasst T2DM-Patienten ≥ 60 Jahre mit zusätzlichen Risikofaktoren (Adipositas, Bluthochdruck, Hyperlipidämie, Niereninsuffizienz, koronare Herzkrankheit). Zur Beantwortung der Frage wurde ein Screening-Modell herangezogen, das dem Konzept einer Kosten-Nutzwert-Analyse entspricht. Die Ergebnisse zeigen, dass ein NT-proBNP-Screening mit Vorteilen sowohl für den einzelnen Patienten als auch für die gescreente Kohorte verbunden ist und für den Zahler kosteneffektiv ist. Für einen 60-Jährigen, der mit dem Screeningprogramm startet, ergibt sich eine inkrementelle Kosten-Nutzwert-Relation (ICUR) pro gewonnenem qualitäts-adjustiertem Lebensjahr (QALY) von 15 954 Euro. Die Gesamtkosten in der Screeningkohorte erhöhen sich durch eine Screening-Strategie um 814 Mio. Euro. Auf der Outcomeseite führt die Implementierung zu 12 449 gewonnen Lebensjahren und 31 494 gewonnenen QALYs.
Schlüsselwörter
Herzinsuffizienz, Diabetes, Kosteneffektivität, NT-proBNP
Type 2 diabetes: cost-effectiveness of NT-proBNP heart failure screening in high-risk patients in Germany
Summary
Epidemiological data show a close, bidirectional association between diabetes mellitus and heart failure (HF). If both diseases are present in combination, the prognosis is significantly worse. The presence of type 2 diabetes mellitus (T2DM) is an independent risk factor for the development of HF. The number of unreported cases is high. Therefore, the question arises as to whether the diagnosis of a previously unknown HF with an annual NT-proBNP screening strategy compared to no screening; i. e. diagnosis based on clinical signs, is associated with an added benefit. The analyzed population includes T2DM patients ≥ 60 years of age with additional risk factors (obesity, hypertension, hyperlipidemia, kidney disease and coronary artery disease). To answer this question, a screening model was used, which corresponds to the concept of a cost-utility analysis. The results show that NT-proBNP screening is associated with benefits for both the individual patient and the screened cohort and that it is cost-effective for the payer. For a 60-year-old starting the screening program, the incremental cost-effectiveness ratio (ICER) per quality adjusted life year (QALY) amounts to 15 954 euros. The total costs in the screening cohort increase by 814 million euros as a result of a screening strategy. On the outcome side, the implementation leads to 12 449 years of life gained and 31 494 quality-adjusted years of life gained.
Keywords
Heart failure, diabetes, cost-effectiveness, NT-proBNP
T2DM ist ein Risikofaktor, der eine wichtige Rolle beim Auftreten von Herzinsuffizienz (HF) spielt, sowohl direkt, indem er die Herzfunktion beeinträchtigt, als auch indirekt durch Begleiterkrankungen wie Bluthochdruck, Nierenfunktionsstörungen, Adipositas und andere Stoffwechselstörungen [Palazzuoli 2023]. Das kardiovaskuläre Risiko entwickelt sich bereits viele Jahre vor der Diagnose von T2DM. Eine zunehmende Insulinresistenz, die mit einer Zunahme des viszeralen Körperfetts einhergeht, ist mit einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen verbunden [Forst 2012]. Daher kann T2DM per se die koronare und systemische Atherosklerose, die Gefäßveränderung, die autonome Dysfunktion und die Kollagenablagerung beschleunigen [Duckworth 2009]. Ein frühes Detektieren einer HF in einer Hochrisikogruppe oder bei Patienten ohne Symptome, aber mit einer strukturellen/funktionellen Herzanomalie bzw. erhöhten Biomarkern wie NT-proBNP, kann eine frühere Umsetzung wirksamer Strategien ermöglichen und die Progression zur fortgeschrittenen HF bei Personen mit Diabetes verhindern oder verzögern. Hier besteht die Möglichkeit des frühen Einsatzes von Inhibitoren des Renin-Angiotensin-Aldosteron-Systems (RAAS) und Betablockern oder Hemmern des Natrium-Glukose-Cotransporter 2 (SGLT2). Die Umsetzung der verfügbaren Strategien zur Erkennung einer asymptomatischen HF ist gegenwärtig jedoch suboptimal und unterstreicht die Notwendigkeit für ein breiteres Bewusstsein für das Thema sowie einer sorgfältigeren Anwendung nützlicher Therapien bei Risikopersonen [Pop-Busui 2022].
Die Symptome einer akuten HF sind oft unspezifisch. Die European Society for Cardiology (ESC)-Leitlinien empfehlen daher mit höchstem Evidenzgrad und Empfehlungslevel die Messung der B-Typ-natriuretischen Peptide BNP und NT-proBNP, um eine akute HF von nicht-kardialen Ursachen der Atemnot zu unterscheiden. Liegen die Werte unterhalb des festgelegten Grenzwerts, kann auf eine Echokardiografie zur Ausschlussdiagnose verzichtet werden [Westphal 2018]. Als initialer diagnostischer Test hilft die Bestimmung von BNP oder NT-proBNP, die eingeschränkte Sensitivität und Spezifität klinischer Zeichen und Symptome zu verbessern. Dadurch unterstützt sie die frühzeitige Erkennung und das Management einer HF. Europäische und amerikanische Leitlinien empfehlen die Messung von BNP oder NT-proBNP ausdrücklich bei allen Patienten, die Symptome und/oder klinische Zeichen aufweisen, die auf eine HF hinweisen könnten. In dieser Indikation ist eine Kostenübernahme gewährleistet [Michou 2019].
Die wirtschaftliche Belastung durch die HF ist erheblich. Die Kosten für HF variieren von weniger als 1000 US-Dollar (USD) pro Patient in Ländern mit niedrigem Einkommen bis zu 5000 bis 15 000 Euro in Europa und zwischen 17 000 und 30 000 USD in den USA [Hessel 2021]. In mehreren Veröffentlichungen schätzt man die Krankheitskosten auf 1 % bis 2 % des gesamten Gesundheitsbudgets [Lesyuk 2018].
Ziel der vorliegenden ökonomischen Analyse ist es, die Kosteneffektivität einer NT-proBNP-unterstützten Diagnose im Vergleich zur Diagnose aufgrund klinischer Zeichen bei Patienten über 60 Jahre mit einem T2DM und Komorbiditäten aus Sicht des deutschen Gesundheitssystems zu bewerten. Die Screeningpopulation umfasst alle T2DM-Patienten mit den Komorbiditäten Adipositas, Bluthochdruck, Hyperlipidämie, Niereninsuffizienz und koronarer Herzkrankheit ohne eine bekannte HF.
Im Kontext dieser Analyse wird Screening als eine Vorsorgeuntersuchung oder ein Screeningtest definiert, der innerhalb einer scheinbar gesunden Bevölkerung gezielt jene identifiziert, die ein erhöhtes Risiko für gesundheitliche Probleme oder Erkrankungen aufweisen. Dadurch kann ihnen frühzeitig eine geeignete Behandlung angeboten werden, was wiederum ihre Gesundheitsprognose und den Krankheitsverlauf positiv beeinflussen kann [Weltgesundheitsorganisation 2020].
BMI: Body-Mass-Index
BNP: B-Typ-natriuretisches Peptid
HF: Herzinsuffizienz
HFmrEF: HF mit mäßiggradig eingeschränkter Ejektionsfraktion
HFpEF: HF mit erhaltener Ejektionsfraktion
HFrEF: HF mit reduzierter EjektionsfraktionICER inkrementelles Kosten-Effektivitäts-Verhältnis
ICUR: inkrementelle Kosten-Nutzwert-Relation
LY: Lebensjahr
NYHA: New York Heart Association
QALY: qualitäts-adjustiertes Lebensjahr
RAAS: Renin-Angiotensin-Aldosteron-System
SGLT2: Natrium-Glukose-Cotransporter 2
T2DM: Typ-2-Diabetes mellitus
Methodisches Vorgehen
Screeningpopulation
Zur Ermittlung der Sceeningpopulation wurde eine systematische Literatursuche durchgeführt (siehe Anhang).
In der erwachsenen Bevölkerung sind 7,5 % oder rund 5,2 Mio. Deutsche von T2DM betroffen [Tönnies 2019, Schmidt 2021]. In der Altersgruppe "älter als 60 Jahre" leiden rund 4,3 Mio. Personen an T2DM [Tönnies 2019, Schmidt 2021]. In dieser Gruppe weisen 95,1 % eine zusätzliche Komorbidität auf [Schmidt 2021, Boehme 2015, Safeddine 2021]. Die in der vorliegenden Analyse betrachteten Komorbiditäten umfassen Adipositas, Bluthochdruck, Hyperlipidämie, Niereninsuffizienz und die koronare Herzkrankheit. Aus den Daten kann gefolgert werden, dass Personen mit T2DM durchschnittlich 2,4 Komorbiditäten aufweisen. Für die Schätzung der Komorbiditäten wurden ausschließlich deutsche Kohortenstudien herangezogen.
Laut Störk (2017) sind 34,7 % der HF-Patienten auch von einem T2DM betroffen; d. h. umgekehrt weisen 22,2 % oder 959 549 der T2DM-Patienten eine HF auf. Aufgrund mangelnder deutscher Daten wurde die New York Heart Association (NYHA)-Stadien-Verteilung aus der prospektiven schwedischen Registerstudie von Johansson (2018) entnommen. Bei 40,7 % der Patienten mit T2DM lag ein Stadium III bzw. IV vor. Siehe dazu Abbildung 1.
Basierend auf diesen Zahlen befinden sich 2,99 Mio. Personen in der Screeningpopulation; diese umfassen T2DM-Patienten mit Komorbiditäten und keiner diagnostizierten HF.
 Abb. 1: Patientenpopulation mit T2DM und Komorbiditäten.
Abb. 1: Patientenpopulation mit T2DM und Komorbiditäten.
Screeningmodell
Um die langfristigen Folgen einer unerkannten HF in der Screeningpopulation abbilden zu können, wurde ein Simulationsmodell mit einem Lebenszeithorizont herangezogen. Im Modell wird die Krankheitsprogression über ein Fortschreiten der NYHA-Stadien dargestellt. Der Ansatz wurde gewählt, da es sich bei der HF sowohl um eine HF mit reduzierter Ejektionsfraktion (HFrEF) als auch um eine HF mit mit erhaltener Ejektionsfraktion (HFpEF) handeln kann. Das Simulationsmodell entspricht einem Markov-Kohortenmodell, welches als Diagnostikmodell für die Population mit HF bereits publiziert wurde [Walter 2023].
Im Screeningarm werden alle Patienten mit einem diagnostizierten T2DM plus Komorbiditäten mit NT-proBNP auf eine HF gescreent. Die Patienten können keine oder bereits eine nicht erkannte HF aufweisen, d. h. dass diese in Folge der Testung entweder diagnostiziert wird oder unerkannt bleibt. Patienten ohne oder mit einer unerkannten HF werden im nächsten Jahr wieder gescreent. Somit laufen nicht erkannte sowie später erkannte HF-Patienten erneut durch das Modell, wobei ihnen unterschiedliche NYHA-Übergangswahrscheinlichkeiten zugewiesen werden.
Nicht erkannte Fälle werden bei Modellbeginn gemäß der Grundverteilung der NYHA-Stadien "unerkannt" verteilt und befinden sich in den Gesundheitszuständen NYHA I, NYHA II oder NYHA III (siehe Tabelle S1). Das Modell sieht vor, dass die HF fortschreitet, Gesundheitszustände sich aber auch verbessern können oder Patienten im gegenwärtigen Gesundheitszustand verbleiben. Erkannte Fälle verteilen sich gemäß den NYHA-Klassen "erkannt". Patienten mit einer bekannten HF weisen eine langsamere Krankheitsprogression auf als Patienten mit einer unbekannten HF. Es werden somit unterschiedliche NYHA-Übergangswahrscheinlichkeiten herangezogen. Das Modelldesign ist in Abbildung 2 dargestellt.
Das Modell wird mithilfe eine deterministischen One-way-Sensitivitätsanalyse und einer probabilistischen Sensitivitätsanalyse hinsichtlich Unsicherheiten überprüft.
 Abb. 2: Design des Screeningmodells.
Abb. 2: Design des Screeningmodells.
Klinische Dateninputs
Die Detektierungsraten gemäß den NYHA-Funktionsklassen infolge eines NT-proBNP-Screenings wurden aus einer niederländischen ökonomischen Analyse von van Giessen (2016) entnommen. In der Publikation wurden verschiedene Screening-Strategien auf der Grundlage einer Real-World-Evidenzstudie bei Patienten mit T2DM und einer nicht-detektierten HF dokumentiert [Boonman-de Winter 2015]. Das Auftreten einer HF im Nicht-Screening-Arm entspricht der Inzidenzrate. Darüber hinaus wird eine Spezifität von 1 in der NYHA-Klasse IV angenommen. Die Krankheitsprogression einer erkannten bzw. unerkannten HF entwickelt sich entsprechend der zugewiesenen Übergangswahrscheinlichkeiten der NYHA-Gesundheitszustände (siehe Tabelle S1).
Zu den Übergangswahrscheinlichkeiten zwischen den NYHA-Funktionsklassen gibt es wenig Literatur. Die für diese Analyse herangezogene Übergangsmatrix wurde in den meisten Kosten-Effektivitäts-Analysen angewendet und basiert auf den Daten der SENIORS-Studie (Study of the Effects of Nebivolol Intervention on Outcomes and Rehospitalization in Seniors With Heart Failure) [King 2016, Ford 2012, Yao 2008, Flather 2005, Walter 2023]. Da diese Übergänge nicht aus einer T2DM-Kohorte stammen und ein T2DM, sowie eine unerkannte HF zu einer schnelleren Krankheitsprogression führen, mussten die Übergangswahrscheinlichkeiten angepasst werden. Analog zu der ökonomischen Analyse von van Giessen (2016) erfolgt dies entsprechend des relativen Anstiegs der Sterbewahrscheinlichkeit. Die Übergangswahrscheinlichkeiten sind in Tabelle S2 dargestellt.
Die jährliche Mortalitätsrate der Gruppe mit einem T2DM und einer HF gemäß NYHA-Klassen stammt aus der Kohortenstudie von Boonman-de Winter (2012) und wurde ebenso in der Analyse von van Giessen (2016) sowie Walter (2023) angewendet.
Ressourcenverbrauch und Kosten
Die Kostenbewertung beruht auf der Zuordnung von Ressourcenverbräuchen multipliziert mit den Kosten der definierten Gesundheitszustände. In der Analyse werden nur direkte medizinische Kosten berücksichtigt. Dazu gehören Screening- und Monitoringkosten, NYHA-Kosten (Krankheitskosten der HF) und Medikamentenkosten. Die Kosten wurden somit aus der Sicht des Kostenträgers für das Jahr 2023 erhoben.
Das HF-Screening wird im Rahmen eines Arztkontakts durchgeführt. Da T2DM-Patienten regelmäßige Konsultationen aufweisen, wird nur der NT-proBNP-Test kostenmäßig bewertet, um Doppelzählungen zu vermeiden. Wird ein Wert NT-proBNP ≥ 125 pg/ml festgestellt, wird zur Bestätigung eine Echokardiografie durchgeführt.
Bei allen Patienten mit HF soll regelmäßig der klinische Status anhand der folgenden Parameter im Rahmen des Monitorings überprüft werden [NVL Chronische Herzinsuffizienz 2023]: funktionale Kapazität (NYHA-Klasse), psychosozialer Status und Lebensqualität, Volumenstatus (Gewichtsverlauf, klinische Untersuchung, Blutdruckmessung), Herzrhythmus und -frequenz (Echokardiographie, EKG), eingenommene Medikation (Erfassung – Kontrolle – ggf. Anpassung, unerwünschte Arzneimittelnebenwirkungen) und eine Laborkontrolle. Kostenwirksam werden allerdings nur Leistungen, die üblicherweise auch Teil des Leistungskatalogs sind. Die sonstigen angeführten Abklärungen werden im Rahmen der Konsultationspauschale abgegolten. Zusätzlich notwendige Monitoringleistungen ergeben sich aufgrund von Arzneimitteltherapien gemäß den Fachinformationen.
Die NYHA-Kosten setzten sich aus ambulanten, abzüglich der oben genannten, und stationären Kosten zusammen. Die ambulanten Krankheitskosten aufgrund der HF nach NYHA-Klassen stammen aus einer Publikation von Biermann (2012). Die Autoren analysierten Daten von insgesamt 2710 Personen mit HF (mittleres Alter 62,9 Jahre ± 13,6; 25,2 % weiblich, NYHA I – IV) aus dem deutschen Kompetenznetzwerk HF. Die stationären Kosten aus dieser Publikation wurden im Rahmen von Validierungsgesprächen zur Kosten-Nutzwert-Analyse von Walter (2023) von klinischen Experten als unplausibel eingestuft. Die Kosten für die NYHA-Klasse I wurden als zu hoch und die Kostensteigung bis NYHA IV als zu flach eingestuft. Daher wurde eine Literaturrecherche durchgeführt, welche sich auf die durchschnittliche Anzahl von Krankenhausaufenthalten in der jeweiligen NYHA-Klasse bezog. Eine PubMed-Suche wurde mit folgenden Suchbegriffen durchgeführt: (((heart failure) AND (ressource use)) AND (hospitalisation)) AND (NYHA). Dieser Suchlauf brachte 25 Ergebnisse, wobei drei detaillierte Ressourcenverbrauchsdaten enthielten. Für die vorliegende Analyse wurden die Daten von Cowper (2004) und Ford (2012) herangezogen. Die Anzahl der Hospitalisierungen wurden mit den aktuellen Kosten (G-DRG 2023) multipliziert. Dafür wurden folgende Fallpauschalen herangezogen: F62A, F62B, F62C, F49A, F49B, F49C, F49D, F49E, F49F.
Die Darstellung der Arzneimittelkosten erfolgt auf Basis des Erstattungsbetrages oder Festbetrags, wenn der Apothekenverkaufspreis den Festbetrag übersteigt bzw. Apothekenverkaufspreis, wenn dieser unter dem Festbetrag liegt.
Alle Kosten sind in Tabelle S3 dargestellt.
Outcome Dateninputs
Im Rahmen der vorliegenden Analyse wird die Lebensdauer sowie die Lebensqualität in Form von Nutzwerten bzw. qualitäts-adjustierten Lebensjahren (QALYs) als Outcomemaß herangezogen.
Der Nutzwert für einen T2DM der Patienten mit zusätzlichen Risiken stammt aus der Publikation von Sullivan (2016). Das Ziel der Arbeit war die Schätzung der EQ-5D-Werte (European Quality of Life 5 Dimensions) für diabetesbedingte chronische Erkrankungen. Die Analyse ermittelte einen Baseline-Score von 0,719, welcher für die vorliegende Analyse herangezogen wurde.
Die Nutzwerte der NYHA-Klassen wurden aus der Publikation von King (2016) entnommen, welche aus der CARE-HF (Cardiac Resynchronization in Heart Failure)-Studie stammen und auf Basis des EQ-5D-Fragebogens generiert wurden [Blomström 2008].
Für das Vorhandensein eines T2DM in Kombination mit einer HF wird eine Disutility abgezogen. Dieser Wert wurde aus einer ökonomischen Analyse entnommen, die sich ebenfalls auf die Studie von Sullivan (2016) bezog [Isaza 2021]. Daraus ergibt sich eine Disutility in Höhe von -0,035. Dieser Wert wurde für die Ermittlung der Nutzwerte der NYHA-Stadien mit T2DM angewendet.
Alle Nutzwerte sind in Tabelle S4 dargestellt.
Ergebnisse
Kosteneffektivität eines 60 Jährigen Patienten
Die durchschnittlichen Gesamtkosten pro Patient mit T2DM plus Komorbiditäten betragen aus der Perspektive des Gesundheitswesens in der NT-proBNP-Gruppe 22 376,43 Euro über die Restlebenszeit. Ohne NT-proBNP-Testung müssen Gesamtkosten von 21 356,97 Euro aufgewendet werden. Die Kostendifferenz beträgt 1019,46 Euro.
Die NT-proBNP-Screening-Strategie generiert 7,708 QALYs vs. 7,644 QALYs für kein Screening, d. h. dass jeder T2DM-Patient mit einem NT-proBNP-Screening durchschnittlich 0,064 QALYs oder rund einen Monat in vollkommener Gesundheit gewinnt. Dies ergibt eine inkrementelle Kosten-Nutzwert-Relation (ICUR) von 15 953,91 Euro für die NT-proBNP-Screening-Strategie vs. keinem Screening. Die NT-proBNP-Screening-Strategie führt zusätzlich zu einem Überlebensvorteil (11,176 LYs vs. 11,118 LYs; siehe Tabelle 1).
Der ICUR einer Screening-Strategie mit NT-proBNP vs. keinem Screening kann aus der Perspektive des deutschen Gesundheitswesens als kosteneffektiv angesehen werden.
 Tab. 1: Ergebnisdarstellung.
Tab. 1: Ergebnisdarstellung.
Kosteneffektivität der gesamten Screeningpopulation
Die Neuerkrankungen von HF in der Gruppe mit T2DM betragen 192 327 Personen, davon werden 161 379 erkannt und 30 948 weisen eine nicht detektierte HF auf. Wieder wird die Kosteneffektivität der Screeningstrategie mit NT-proBNP im Vergleich zu keinem Screening über den Betrachtungszeitraum der Restlebenszeit in der Gruppe mit T2DM plus Komorbiditäten ermittelt. Die Altersstruktur der Kohorte mit HF entspricht den Altersgruppen ≥ 60 Jahre im Altersquerschnitt.
Die Ergebnisse zeigen, dass sich die Gesamtkosten der Kohorte mit T2DM plus Komorbiditäten durch eine Screening-Strategie mit NT-proBNP um 813,6 Mio. Euro im Vergleich zu keinem Screening erhöhen. Auf der Outcome-Seite führt die Implementierung eines NT-proBNP-Screenings zu 12 449 gewonnen Lebensjahren und 31 494 gewonnenen qualitäts-adjustierten Lebensjahren oder Jahren in vollkommener Gesundheit.
Unter Berücksichtigung der gesamten Screeningkohorte ergibt sich ein ICUR von 25 832,71 Euro.
Sensitivitätsanalyse
Es wurde eine one-way deterministische Sensitivitätsanalyse durchgeführt, um den Einfluss von Inputparametern auf das inkrementelle Kosten-Nutzwert-Verhältnis von NT-proBNP im Vergleich zu keinem Screening zu bewerten. Die Ergebnisse wurden als inkrementelle Kosten pro gewonnenem QALY ausgedrückt. Zur Darstellung der Ergebnisse wurde ein Tornadodiagramm gewählt. Die Ergebnisse zeigen, dass folgende Inputs den größten Einfluss auf das Ergebnis haben: der Diskontsatz von Outcomes und Kosten, die NYHA IV-Kohortenverteilung der nicht detektierten HF, die Sensitivität von NT-proBNP in NYHA II und die Dunkelziffer von HF. Alle weiteren Informationen sind der Abbildung 3 zu entnehmen.
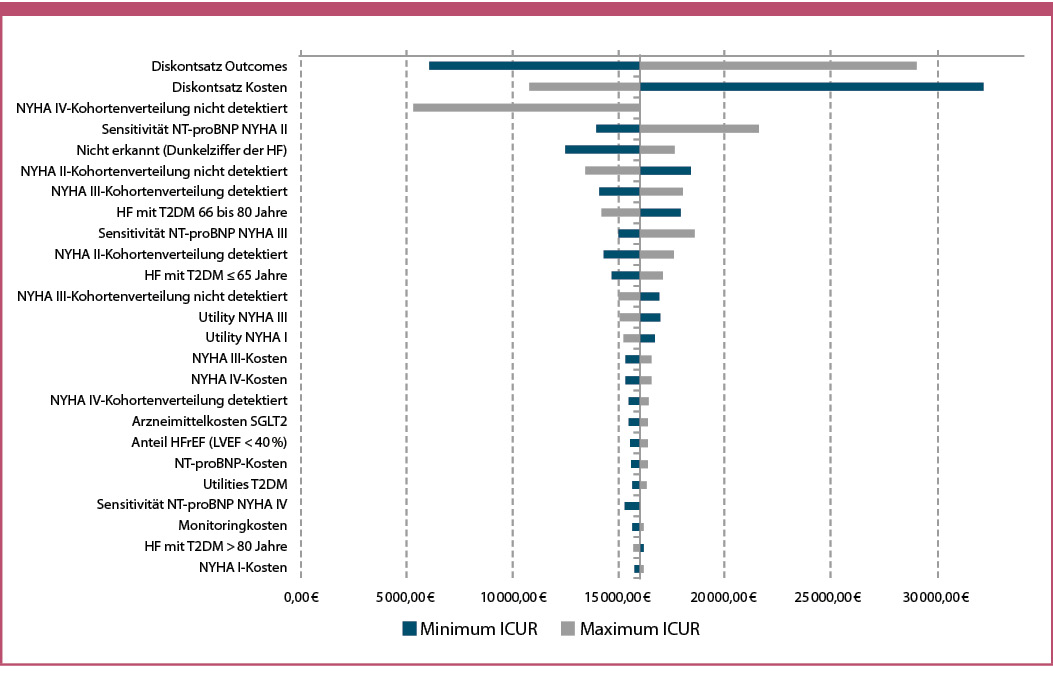 Abb. 3: Tornadodiagramm der deterministischen One-way-Sensitivitätsanalyse (25 Variationen mit dem größten Einfluss auf das ICUR).
Abb. 3: Tornadodiagramm der deterministischen One-way-Sensitivitätsanalyse (25 Variationen mit dem größten Einfluss auf das ICUR).
Des Weiteren wurde eine probabilistische Sensitivitätsanalyse durchgeführt. Die Ergebnisse werden für 1000 Monte-Carlo Simulationen gezeigt, mit der Annahme, dass alle Kosten gammaverteilt und die Wahrscheinlichkeiten sowie Nutzwerte betaverteilt sind. Die Simulation zeigt, dass die Punkte im rechten oberen Quadranten liegen; also, dass zusätzliche Kosten mit verbesserten Outcomes einhergehen. Die Akzeptanzkurve zeigt, dass bei einer Zahlungsbereitschaft von 25 000 Euro pro gewonnenem QALY in 94,3 % der Simulationen das NT-proBNP-Screening eine kosteneffektive Strategie darstellt (siehe Abbildung 4).
 Abb 4: Probabilistische Sensitivitätsanalyse.
Abb 4: Probabilistische Sensitivitätsanalyse.
Diskussion
Die volkswirtschaftliche Bedeutung der HF ist immens. Die chronische HF ist derzeit eine der häufigsten und kostenintensivsten Erkrankungen. Charakteristisch für die HF ist dabei eine hohe Morbidität und Letalität verbunden mit hohen Versorgungskosten. Zur Verbesserung der Betreuung werden zunehmend neue Behandlungs- und Betreuungsprogramme für HF konzipiert. In Deutschland sind rund 4 % oder 2 765 272 erwachsene Personen von HF betroffen [Störk 2017]. Das Vorliegen eines T2DM stellt einen wichtigen Risikofaktor für die Entwicklung einer HF dar. So entwickeln Patienten mit T2DM ca. zwei- bis fünfmal häufiger und in bereits jüngerem Lebensalter eine HF [Schütt 2022]. Die Dunkelziffer ist erheblich.
Das 2022 publizierte Positionspapier der Deutschen Gesellschaft für Kardiologie (DGK) und der Deutschen Diabetes Gesellschaft (DDG) soll den gegenwärtigen Erkenntnisstand widerspiegeln und allen Ärzten und ihren Patienten eine Hilfestellung zur Entscheidungsfindung bei Diagnostik und Therapie bieten [Schütt 2022].
Mit der Analyse konnten wir zeigen, dass das NT-proBNP-Screening in der Kohorte der T2DM-Patienten mit zusätzlichen Risikofaktoren kosteneffektiv ist und gleichzeitig geeignet ist, die klinischen Ergebnisse im Vergleich zu keinem Screening zu verbessern. Kosten, die in direktem Zusammenhang mit der NT-proBNP-Messung standen, machten < 1 % der Gesamtkosten aus, und eine Änderung der Kosten der NT-proBNP-Messung verändert das Ergebnis nur marginal zum gegenwärtigen Base Case (ICUR zwischen 15 540,65 Euro und 16 367,17 Euro).
Wie kann der ICUR interpretiert werden? Grundsätzlich gibt er die zusätzlichen Kosten pro gewonnenem QALY an und dient als Bezugsgröße im Kontext eines Kosten-Nutzen-Schwellenwertes. Untersuchungen, die in Europa und lateinamerikanischen Ländern mit höherem und mittlerem Einkommensniveau durchgeführt wurden, ermittelten eine Kosten-Nutzen-Schwelle unter dem nationalen Pro-Kopf-Bruttoinlandsprodukt (ca. 24 000 bis 40 000 USD) pro QALY als Maß für Opportunitätskosten [Woods 2017, ICER 2017]. Diese Schwellenwerte belegen die hohe Kosteneffektivität des NT-proBNP-Screenings in der vorliegenden Analyse.
Basierend auf diesen Ergebnissen konnte gezeigt werden, dass ein NT-proBNP-Screening in einer Risikopopulation einerseits mit einer geringen Kostensteigerung verbunden ist, andererseits aber durch eine frühzeitige Diagnose die Krankheitsprogression der HF verzögert und den Patientennutzen erhöht. Die vorliegenden Daten stimmen mit früheren Studien überein. Eine von van Giessen (2016) verfasste Kosten-Effektivitäts-Analyse untersuchte die Kosteneffektivität von fünf Screening-Strategien bei Patienten mit T2DM ab 60 Jahren. Die Diagnose einer HF infolge von Zeichen und Symptomen plus NT-proBNP ergab einen ICUR von 6288 Euro für Männer und 6408 Euro für Frauen verglichen mit keinem Screening. Eine Analyse für Österreich und die Schweiz, welche eine Subpopulation von Patienten mit T2DM analysierte, konnte zeigen, dass ein NTproBNP-Screening hoch kosteneffektiv ist. In der Subgruppe der Patienten mit unerkannter HF und T2DM wurde für Österreich ein ICUR von 3218 Euro ermittelt, für die Schweiz waren es 661 250 Schweizer Franken [Walter 2023]. Laramée (2013) stellte fest, dass die serielle BNP-Messung der klinischen Beurteilung überlegen ist und zudem die kostengünstigste Option darstellt. Daraus ergab sich ein inkrementelles Kosten-Effektivitäts-Verhältnis (ICER) von 3304 Britischen Pfund. Dieser Ansatz erwies sich jedoch als nicht kosteneffektiv für Personen ab 75 Jahren. Diese Analyse bezog sich nicht auf T2DM-Patienten. In einer ähnlichen Untersuchung wies Mohiuddin (2016) darauf hin, dass bei jüngeren Patienten mit HF und reduzierter Ejektionsfraktion die BNP-gesteuerte Versorgung ein höheres Maß an Kosteneffektivität aufwies als die klinische Standardversorgung (ICER 9840 Britische Pfund).
Die wesentliche Stärke des vorliegenden Modells besteht darin, dass die Analyse auf der Grundlage von Real-World-Evidenzdaten entwickelt wurde, einerseits in Bezug auf die ausgewählte Kohorte und andererseits in Bezug auf die diagnostischen Daten. Die betrachtete Kohorte wurde auf Basis deutscher Kohortenstudien abgeleitet, die bevölkerungsrepräsentative Stichproben beschrieben. Die Analyse bezieht sich auf T2DM-Patienten mit zusätzlichen Risikofaktoren und entspricht nicht dem Patientenkollektiv der bereits publizierten Studien. Boonman-de Winter (2015) generierte Sensitivitäten von NT-proBNP in Kombination mit körperlicher Untersuchung von 21 Hausarztpraxen in den Niederlanden. Die ermittelten Sensitivitäten sind in der Regel geringer als in publizierten diagnostischen Studien zu NT-proBNP [Zaphiriou 2005] und stellen somit eine konservative Annahme dar. Die Inputdaten wurden von klinischen Experten vor Ort hinsichtlich der Übertragbarkeit zwischen den Landkreisen validiert.
Als Limitation der Analyse muss berücksichtigt werden, dass die Übergangswahrscheinlichkeiten auf Basis von NYHA-Klassen nicht für unterschiedliche Risikoprofile von HF-Kohorten zur Verfügung stehen. Daher war es notwendig, eine Anpassung nach Risikostratifizierung (T2DM und HF sowie erkannt und nicht erkannt) mithilfe der Mortalitätsraten vorzunehmen. Der Ansatz wurde bereits in der ökonomischen Analyse von van Giessen (2016) beschrieben und umgesetzt. Die herangezogenen Sensitivitätswerte von NT-proBNP basieren auf einer T2DM-Kohorte aus den Niederlanden [Boonman-de Winter 2015, Boonman-de Winter 2012]. Diese umfasste 581 Patienten mit T2DM und zusätzlichen Komorbiditäten, jedoch nicht ausschließlich Personen mit einem hohen Erkrankungsrisiko. So litten beispielsweise 65,5 % der Patienten an Bluthochdruck, während dieser Anteil in unserer Hochrisikokohorte mit 85,7 % deutlich höher liegt. Zudem wiesen 31 % unserer Patienten eine koronare Herzerkrankung auf, verglichen mit 18,6 % in der niederländischen Kohorte. 30,9 % der Hochrisikopatienten waren adipös. Ein hoher Body-Mass-Index (BMI) steht in Zusammenhang mit niedrigeren NT-proBNP-Werten – sowohl bei Gesunden als auch bei Erkrankten. Dies weist auf einen inversen Zusammenhang zwischen BMI und NT-proBNP hin [Müller 2019, Wester 2025]. Aufgrund dieser Wechselwirkung wurden die Sensitivitätswerte im Rahmen einer Sensitivitätsanalyse analysiert. Dadurch variiert der ICUR zwischen 13 887,52 Euro und 21 651,64 Euro (siehe Abbildung 3). Eine Validierung war in Bezug auf die NYHA-Kosten erforderlich, die nach NYHA-Klassen differenziert werden. Eine weitere Limitation dieser Analyse ist, dass indirekte Kosten nicht berücksichtigt wurden. Komplikationen im Zusammenhang mit einer HF haben erhebliche wirtschaftliche Auswirkungen, die nicht nur direkte, sondern auch indirekte Kosten wie Einkommensverluste, verminderte Produktivität und die Belastung von Pflegekräften und Familienmitgliedern umfassen. Aufgrund des Datenmangels zu indirekten Kosten ist deren Integration in die Analyse mit einem erheblichen Maß an Unsicherheit verbunden. Daher wurde entschieden, die indirekten Kosten für die Basisfallanalyse nicht zu integrieren.
Insgesamt kommt die Analyse zu dem Ergebnis, dass es sich bei der Screening-Strategie mit NT-proBNP um eine kosteneffektive Diagnosemöglichkeit der Herzinsuffizienz in der Patientengruppe mit T2DM plus Komorbiditäten handelt.
- Das Kosten-Nutzwert-Modell bestätigt einen Zusatznutzen der Anwendung des NT-proBNP-Screenings bei Diabetespatienten mit Risikofaktoren ohne eine bekannte HF.
- Rund 95 % der über 60-jährigen Menschen mit Diabetes weisen zusätzlich Risikofaktoren auf.
- Der Zusatznutzen ist definiert als Lebensqualitätsverbesserung und -verlängerung sowie als ein kosteneffektiver Ressourceneinsatz.
Anhang
Literatursuche
Für die Beantwortung der ersten Forschungsfrage zur Wirksamkeit und Kosteneffektivität wurde im September 2023 eine umfangreiche Literatursuche in fünf Datenbanken (PubMed, Cochrane, Handsuche) durchgeführt.
Die systematische Suche ergab 407 Treffer. Bei der Literaturauswahl wurden ausschließlich Kohortenstudien (prospektiv und retrospektiv, sowie auf Basis von Verordnungsdaten) sowie Registerstudien berücksichtigt. Entsprechend der Einschlusskriterien konnten insgesamt acht Publikationen eingeschlossen werden.
Die Tabelle A1 bietet einen Überblick über die angewendeten Einschlusskriterien.
Bei der Durchsicht der Titel bzw. Abstracts wurden Publikationen zur Epidemiologie aus folgenden Gründen ausgeschlossen:
- Mehrfachpublikationen
- nur Abstract verfügbar
- Patienten mit Typ-1-Diabetes
- nicht repräsentativ für Gesamtdeutschland (nur Bundesländer des ehemaligen Ostens)
- nicht übertragbare europäische Länder (z. B. Süden)
 Tab. A1: Einschlusskriterien der Literatursuche.
Tab. A1: Einschlusskriterien der Literatursuche.
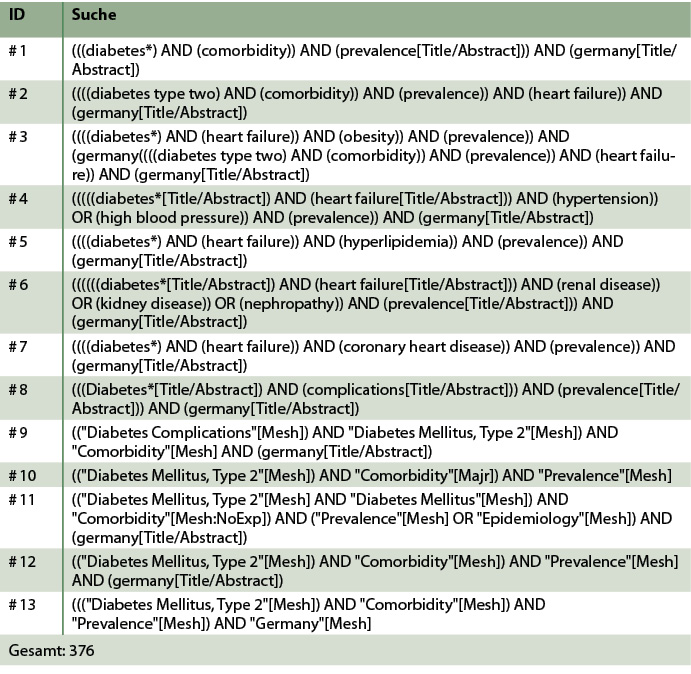 Tab. A2: Suchstrategie für PubMed.
Tab. A2: Suchstrategie für PubMed.
 Tab. A3: Suchstrategie für Cochrane.
Tab. A3: Suchstrategie für Cochrane.
 Abb. A1: PRISMA-Diagramm der systematischen Literatursuche.
Abb. A1: PRISMA-Diagramm der systematischen Literatursuche.
 Tab. S1: Klinische Dateninputs.
Tab. S1: Klinische Dateninputs.
 Tab. S2: Übergangswahrscheinlichkeiten.
Tab. S2: Übergangswahrscheinlichkeiten.
 Tab. S3: Kostendaten.
Tab. S3: Kostendaten.
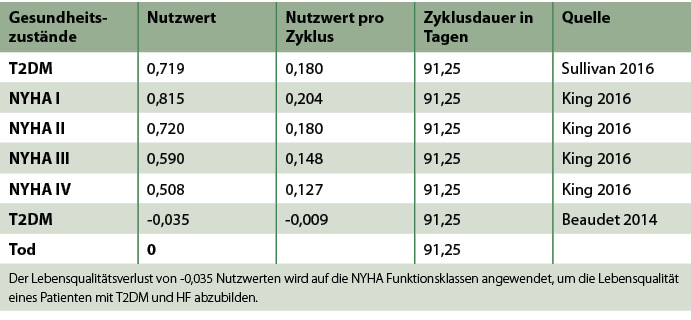 Tab. S4: Nutzwerte.
Tab. S4: Nutzwerte.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2025; 34 (3) Seite 133-143


