In den letzten zehn Jahren hat der Einsatz von Systemen zur kontinuierlichen Glukosemessung (Continuous Glucose Monitoring, CGM) deutlich zugenommen, da sich die Performance der Geräte verbessert hat, ihr klinischer Nutzen nachgewiesen und sie nachfolgend in Leitlinien für die Diabetestherapie integriert wurden [Elbalshy 2022, American Diabetes Association 2024, Holt 2021]. In der Folge werden zahlreiche innovative CGM-Systeme entwickelt und neue Anbieter drängen auf den Markt. Das Unternehmen Roche Diabetes Care (RDC) blickt auf eine lange Geschichte in der Blutzucker (BZ)-Messung zurück und hat nun eine neue CGM-Lösung entwickelt.
Zusammenfassung
Einleitung: In dieser multizentrischen Studie wurde die Leistungsfähigkeit (Performance) eines neuen Systems zur kontinuierlichen Glukosemessung (Continuous Glucose Monitoring, CGM) untersucht.Methoden: In die Studie wurden Erwachsene mit Diabetes mellitus eingeschlossen. Sie trugen jeweils drei Sensoren des CGM-Systems für bis zu 14 Tage an den Oberarmen. Bei vier stationären Aufenthalten am Studienzentrum wurden hochfrequente vergleichende Blutzucker (BZ)-Messungen mit Kapillarblutproben durchgeführt. Der primäre Endpunkt war die 20/20-Übereinstimmungsrate (Agreement Rate, AR): der Prozentsatz der CGM-Messwerte, die innerhalb eines Bereichs von ± 20 mg/dl (bei BZ-Werten < 100 mg/dl) oder ± 20 % (bei BZ-Werten ≥ 100 mg/dl) des Vergleichswerts lagen. Zu den weiteren Analysen gehörten die mittlere absolute relative Differenz (MARD) sowie die 20/20-AR in verschiedenen BZ-Bereichen und über die Tragedauer.
Ergebnisse: Es wurden die Daten von 48 Teilnehmenden und 139 Sensoren analysiert. Während der stationären Aufenthalte am Prüfzentrum lag die 20/20-AR bei 90,5 % und die MARD bei 9,2 %. Für die BZ-Bereiche < 70, 70 – 180 und > 180 mg/dl betrug die jeweilige 20/20-AR 94,3 %, 89,0 % beziehungsweise 92,5 %. Zu Beginn, in der Mitte und am Ende der Tragezeit des Sensors betrug die jeweilige 20/20-AR 92,8 %, 91,5 % beziehungsweise 85,9 %. Die Wahrscheinlichkeit, dass der Sensor 14 Tage funktionsfähig blieb, lag bei 82,4 %. Schmerzen und Blutungen nach der Applikation des Sensors waren im erwarteten Bereich. Auf Grundlage der Studienergebnisse wird die Verwendung des Systems als sicher angesehen.
Schlussfolgerungen: Das System zeigte eine gute Performance im Vergleich zu BZ-Messungen aus Kapillarblut. Dieses Genauigkeitsniveau konnte über den gesamten Messbereich, insbesondere im niedrigen glykämischen Bereich, und über die gesamte Tragedauer der Sensoren nachgewiesen werden. Die Ergebnisse dieser Studie unterstützen einen alleinigen (nicht-adjunktiven) Einsatz des kontinuierlichen Glukosemesssystems für Therapieentscheidungen.
Schlüsselwörter
Genauigkeit, kontinuierliche Glukosemessung, MARD, Performance, Leistungsfähigkeit
Das CGM-System ist für die Anwendung durch Erwachsene mit Diabetes mellitus bestimmt. Der Sensor verwendet ein glukosespezifisches Enzym in Kombination mit einem amperometrischen Verfahren, um ein von der Glukosekonzentration abhängiges Signal zu erhalten. Das System besteht aus dem Sensor, der in einem Applikator vormontiert ist, und einer Smartphone-Anwendung. Der Sensor kann bis zu 14 Tage lang auf der Rückseite des Oberarms getragen werden. Das System hat eine Aufwärmzeit von einer Stunde und erfordert eine initiale Kalibrierungsroutine.
In dieser multizentrischen Studie wurden die Sicherheit und Performance des CGM-Systems bei Erwachsenen mit Diabetes mellitus untersucht.
Methoden
Studiendesign
In dieser offenen, einarmigen, prospektiven, nicht randomisierten, multizentrischen Studie wurden die Sicherheit und Performance des Accu-Chek® SmartGuide CGM-Systems (RDC) untersucht. Die Studie wurde an drei Studienzentren in Deutschland und Österreich durchgeführt. Sie wurde von den jeweiligen lokalen Ethikkommissionen und der zuständigen Behörde genehmigt und im International Standard Randomised Controlled Trial Number (ISRCTN)-Register registriert (ISRCTN89358739).
Der primäre Endpunkt der Studie war der Anteil von CGM-Messwerten innerhalb von ± 20 mg/dl oder ± 20 % (bei BZ-Werten von < 100 mg/dl beziehungsweise ≥ 100 mg/dl) des mit dem Accu-Chek Guide BZ-Messgerät (RDC) bestimmten BZ-Vergleichswerts während der Aufenthalte am Studienzentrum. Dieser Endpunkt wird im Folgenden 20/20-AR (Agreement Rate, Übereinstimmungsrate) genannt. Das verwendete Messgerät für BZ-Vergleichswerte hat in einer Leistungsstudie nach ISO 15197:2013 eine hohe Genauigkeit mit über 99,7 % der Messwerte innerhalb von ± 10 mg/dl oder ± 10 % der Laborreferenzwerte gezeigt [Brazg 2016].
Die Studie wurde vom Hersteller initiiert und konzipiert, und die Daten wurden von ihm verarbeitet. Die Analyse der Endpunkte wurde vom Hersteller und dem Institut für Diabetes-Technologie, Ulm, Deutschland, durchgeführt.
AR: Agreement Rate (Übereinstimmungsrate)
BZ: Blutzucker
CG-DIVA: Continuous Glucose Deviation Interval and Variability Analyse
CGM: kontinuierliches Glukose-Monitoring
CSII: kontinuierliche subkutane Insulininfusion
MAD: mittlere absolute Differenz
MARD: mittlere absolute relative Differenz
MDI: mehrfache tägliche Injektionen
RDC: Roche Diabetes Care
RoC: Rate of Change (Änderungsrate)
Studienpopulation
In die Studie wurden Erwachsene eingeschlossen, bei denen mindestens 12 Monate zuvor ein Typ-1- oder Typ-2-Diabetes diagnostiziert worden war und von denen mindestens 95 % mit einer intensivierten Insulintherapie behandelt wurden. Die wichtigsten Ausschlusskriterien waren: HbA1c-Wert > 9,5 % (80 mmol/mol), bestehende Schwangerschaft oder Stillzeit, schwere akute oder chronische Begleiterkrankungen oder diabetesbedingte Komplikationen, die ein Risiko für den Teilnehmenden darstellen könnten, frühere schwere Hypoglykämien oder eine beeinträchtigte Hypoglykämie-Wahrnehmung, Pflasterallergien oder -unverträglichkeiten sowie die Einnahme von potenziell störenden Substanzen (Hydroxyharnstoff, Levodopa, Methyldopa, Ascorbinsäure und Acetylsalicylsäure).
Die Berechnung der Stichprobengröße unter Berücksichtigung einer erwarteten 20/20-AR von ≥ 84 %, einer statistischen Power von 90 % und einem einseitigen Konfidenzniveau von 0,025 ergab eine erforderliche Anzahl von 14 517 Messpaaren. Unter Berücksichtigung einer erwarteten Anzahl von 384 Messpaaren pro Teilnehmenden und einer Drop-out-Rate von 20 % wurde geplant, 48 Teilnehmende in die Studie einzuschließen.
Studiendurchführung
Alle Teilnehmenden unterzeichneten vor der Durchführung der Studie eine Einverständniserklärung. Die Studie wurde über 15 Kalendertage in einem gemischten Setting aus Tagen im Studienzentrum und zu Hause durchgeführt. Nach dem Screening und Einschluss in die Studie wurden die Teilnehmenden im Anbringen der Sensoren geschult, wobei die Sensoren an Tag 1 im Studienzentrum gesetzt wurden. Die Teilnehmenden wurden in zwei Gruppen mit geringfügig unterschiedlichen Visitenplänen eingeteilt, um ein breiteres Spektrum an Tagen im Studienzentrum abzudecken.
In dieser Studie wurde die App im verblindeten Modus verwendet und die Sensoren speicherten nur Rohsignale. Es wurden drei verschiedene Sensorchargen getestet.
Jede und jeder Teilnehmende erhielt drei Sensoren (aus zwei verschiedenen Chargen), die nach einem vordefinierten Applikationsschema auf der Rückseite der Oberarme angebracht wurden. Jeweils ein Sensor wurde von den Teilnehmenden selbst angebracht, die beiden anderen vom Studienpersonal. Nach dem Anbringen wurden die Sensoren mit der App gekoppelt und in den nächsten 5Stunden wurden alle 30Minuten kapillare BZ-Messungen durchgeführt. An Tag1 konnten die Sensoren ersetzt werden, falls das Anbringen der Sensoren fehlschlug oder es Schwierigkeiten mit der Smartphone-Anwendung gab. Alle BZ-Vergleichsmessungen wurden in Doppelbestimmung durchgeführt und gemittelt. An Tag2, etwa 12 bis 16Stunden nach Anbringen des Sensors, wurden im Studienzentrum über einen Zeitraum von 8Stunden alle 15Minuten BZ-Vergleichsmessungen durchgeführt. An drei weiteren Tagen (Tag5, 9 und 13 für Gruppe A; Tag6, 10 und 14 für Gruppe B) besuchten die Teilnehmenden die Studienzentren für hochfrequente Vergleichsmessungen, während der BZ-Spiegel manipuliert wurde, um Werte von <70 und um 300mg/dl zu erreichen. Abhängig vom BZ-Wert (< bzw. >150mg/dl) und dem morgendlichen Trend entschieden die Prüfärzt:innen bei jedem Teilnehmenden, ob niedrige oder hohe BZ-Werte angestrebt werden sollten. Niedrige BZ-Werte wurden durch eine Insulinverabreichung mit einem Zielwert von 70mg/dl auf Basis der individuellen Insulinsensitivität der Teilnehmenden erzielt. Hohe BZ-Werte wurden durch den Verzehr einer Mahlzeit mit einer vorher festgelegten Kohlenhydratmenge und einer verzögerten Insulingabe induziert. Die Mahlzeiten wurden je nach Ausgangs-BZ-Wert aus einer Auswahl von Lebensmitteln zusammengestellt, die zwischen 10 g und 25g Kohlenhydrate pro Portion enthielten. Gegenmaßnahmen (Verabreichung von Kohlenhydraten bzw. Mahlzeiteninsulin) wurden eingeleitet, wenn absehbar war, dass der BZ-Spiegel der Teilnehmenden für circa eine Stunde im angestrebten Bereich liegen würde. Die Vergleichsproben wurden alle 15Minuten über einen Zeitraum von etwa 8Stunden abgenommen. Fielen die Blutzuckerwerte unter 70mg/dl oder stiegen sie über 250mg/dl wurde die Häufigkeit der BZ-Messung auf alle 10Minuten erhöht und die Teilnehmenden konnten bis zu einer Stunde lang in diesem Bereich gehalten werden, bevor Gegenmaßnahmen eingeleitet wurden. Alle Interventionen konnten nach Ermessen der Prüfärzt:innen angepasst werden.
An den anderen Tagen (Messungen zu Hause) gingen die Teilnehmenden ihrem gewohnten Tagesablauf nach und wurden gebeten, mindestens 8 BZ-Messungen in Doppelbestimmung pro Tag durchzuführen (nach dem Aufwachen, vor und etwa 2 Stunden nach jeder Mahlzeit, vor der Insulingabe und vor dem Schlafengehen).
Die Teilnehmenden kehrten an Tag 15 in die Studienzentren zurück, um alle Sensoren nach einer Tragedauer von 14 Tagen zu entfernen. Bei jedem Besuch im Studienzentrum wurden die CGM- und BZ-Daten heruntergeladen, die Tragestellen der Sensoren untersucht sowie unerwünschte Ereignisse und Gerätedefekte erfasst.
Datenanalyse
Die Umwandlung der Sensor-Rohsignale in Glukosekonzentrationen erfolgte retrospektiv. Der Algorithmus umfasst die anfängliche Kalibrierung an Tag1 (je 12 und 14Stunden nach dem Setzen des Sensors) sowie die programmatische Sicherheitslogik im Falle eines Sensorfehlers (Failsafes). Wenn eine solche Maßnahme einen Sensorausfall feststellte, wurden keine Werte mehr erzeugt. Die Kalibrierungswerte wurden nicht für die Performance-Analyse verwendet. CGM-Werte außerhalb des Messbereichs von 40 bis 400mg/dl wurden ausgeschlossen. Die Daten aller Sensoren und Chargen wurden zusammengefasst.
Wenn zum Zeitpunkt der BZ-Messung kein passender CGM-Messwert verfügbar war, wurden die CGM- und BZ-Datenpunkte durch lineare Interpolation von CGM-Messwerten aus 5-Minuten-Intervallen gepaart. Für die primäre Performance-Analyse wurden nur Daten aus den hochfrequenten Messungen während der stationären Aufenthalte am Studienzentrum verwendet. Die 20/20-AR wurde berechnet, indem die Anzahl der CGM-Messwerte innerhalb von ±20mg/dl (für BZ-Werte <100mg/dl) oder ±20% (für BZ-Werte ≥100 mg/dl) der gepaarten BZ-Werte bestimmt wurde. Die Grenze von 100mg/dl wurde nach den Empfehlungen der POCT05-Leitlininie [Clinical Laboratory Standards Institute 2020] festgelegt, und um einen kontinuierlichen Übergang zwischen absoluten und relativen (prozentualen) Differenzen zu ermöglichen.
Zu den sekundären Endpunkten gehörten die AR mit anderen Grenzwerten und für verschiedene BZ-Bereiche, die mittlere absolute relative Differenz (MARD) oder die mittlere absolute Differenz (MAD), der relative Bias, die Genauigkeit bei verschiedenen CGM-Änderungsraten (Rate of Change, RoC) und über die Sensortragezeit, die sensorspezifische MARD, die Continuous Glucose Deviation Interval and Variability Analysis (CG-DIVA) [Eichenlaub 2024b], die Consensus-Error-Grid-Analyse [Parkes 2000], die Sensorüberlebenszeit [Kaplan 1958] und die Verfügbarkeit der Sensordaten. Die Schmerzen während des Anlegens des Sensors wurden anhand einer numerischen Skala bewertet (0: keine Schmerzen, 10: maximale Schmerzen). Blutungen wurden entweder als keine, leichte, moderate oder starke Blutungen eingestuft.
Ergebnisse
Studienpopulation
Nach dem Screening von 61 potenziellen Teilnehmenden wurden 51 als geeignet eingestuft. Bei drei von ihnen wurde kein Sensor angebracht (eine Person zog ihre Zustimmung zurück und zwei wurden als potenzielle Ersatzteilnehmende rekrutiert. Insgesamt wurden 166 CGM-Sensoren (einschließlich Ersatzsensoren) bei 48 Teilnehmenden angebracht. Ein Teilnehmender verlor alle drei Sensoren während der Aufwärmphase, und ein Teilnehmender konnte die Studie aufgrund eines unerwünschten Ereignisses, das nicht mit dem zu testendem Messgerät zusammenhing, nicht abschließen. Daher schlossen 46 Teilnehmende die Studie ab.
Die eingeschlossenen Teilnehmenden waren 44,4 ± 15,3 Jahre alt, 42 % waren weiblich, 58 % waren männlich und 83 % hatten Typ-1-Diabetes. Bei allen Teilnehmenden bestand eine Insulintherapie. Einige nahmen zusätzliche antidiabetische Medikamente ein (Tabelle 1).
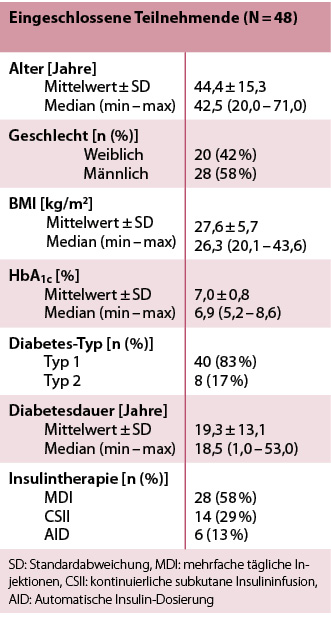 Tab. 1: Baseline-Charakteristika der Studienteilnehmenden.
Tab. 1: Baseline-Charakteristika der Studienteilnehmenden.
Genauigkeitsanalyse
In die Analyse wurden 139 Sensoren eingeschlossen, die erfolgreich gestartet wurden und mindestens einen gültigen Wert geliefert hatten. Nach der Anwendung des Algorithmus und den sich daraus ergebenden Datenausschlüssen auf der Grundlage von Failsafe-Maßnahmen, standen 15 993 gepaarte BZ-CGM-Werte (von 132 Sensoren) aus stationären Aufenthalten am Studienzentrum und 11 187 Werte aus der Anwendung zu Hause für die Performance-Analyse zur Verfügung.
Die Genauigkeit während der Messungen in den Studienzentren sowie kombiniert während der Messungen in den Studienzentren und bei der Anwendung zu Hause sind in Tabelle 2 dargestellt. Der primäre Endpunkt, die 20/20-AR während der stationären Aufenthalte am Studienzentrum, betrug 90,5 % und die Gesamt-MARD (stationär) 9,2 %. Während der gesamten Studie lag die 20/20-AR bei 89,8 % und die Gesamt-MARD (stationäre Aufenthalte und zu Hause) bei 9,6 %. Die höchste Genauigkeit, anhand der 20/20-AR, wurde im glykämischen Bereich unter 70 mg/dl beobachtet. In Abbildung 1 sind die Ergebnisse der CG-DIVA dargestellt, die den Bias und die Präzision in verschiedenen Glukosebereichen sowie die Sensor-zu-Sensor-Variabilität anhand der Daten der stationären Aufenthalte zeigen.
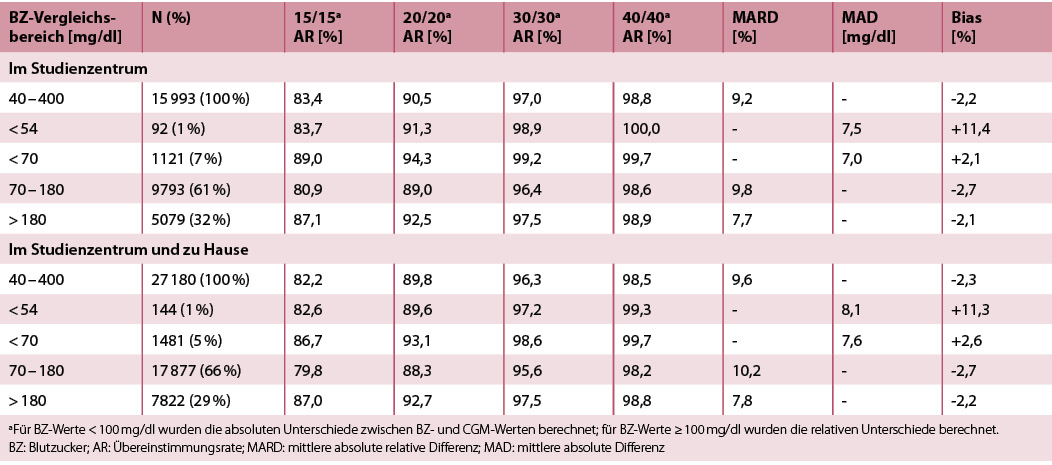 Tab. 2: Genauigkeitsergebnisse für Messungen in den Studienzentren (132 Sensoren) sowie für die kombinierte Verwendung in den Studienzentren und zu Hause (139 Sensoren).
Tab. 2: Genauigkeitsergebnisse für Messungen in den Studienzentren (132 Sensoren) sowie für die kombinierte Verwendung in den Studienzentren und zu Hause (139 Sensoren).
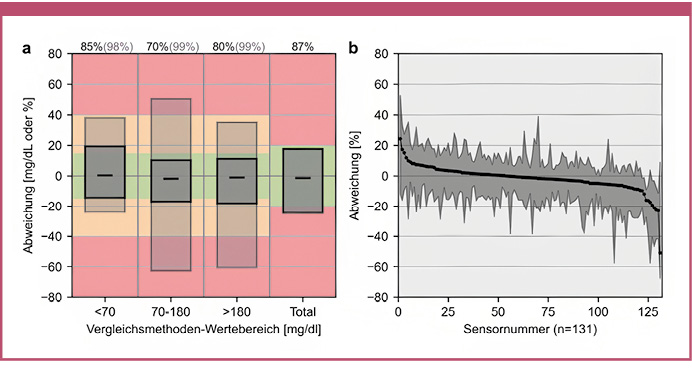 Abb. 1: Ergebnisse der Continuous Glucose Deviation Interval and Variability-Analyse (CG-DIVA) von Daten aus Messungen in den Studienzentren. (a) Abweichungsintervalle in verschiedenen Glukosebereichen, die die iCGM-Kriterien der Food and Drug Administration abdecken: Die dunkelgrauen Kästen enthalten 85 %, 70 %, 80 % bzw. 87 % der erwarteten Abweichungen, und die hellgrauen Felder enthalten 98 %, 99 % bzw. 99 % der erwarteten Abweichungen. Schwarze Striche zeigen den Median der Abweichungen. (b) Sensor-zu-Sensor-Variabilität über den gesamten Glukosebereich. Jeder Sensor mit mindestens drei Werten ist durch den Median und den 90 %-Bereich dargestellt. Die Sensoren wurden nach Median geordnet.
Abb. 1: Ergebnisse der Continuous Glucose Deviation Interval and Variability-Analyse (CG-DIVA) von Daten aus Messungen in den Studienzentren. (a) Abweichungsintervalle in verschiedenen Glukosebereichen, die die iCGM-Kriterien der Food and Drug Administration abdecken: Die dunkelgrauen Kästen enthalten 85 %, 70 %, 80 % bzw. 87 % der erwarteten Abweichungen, und die hellgrauen Felder enthalten 98 %, 99 % bzw. 99 % der erwarteten Abweichungen. Schwarze Striche zeigen den Median der Abweichungen. (b) Sensor-zu-Sensor-Variabilität über den gesamten Glukosebereich. Jeder Sensor mit mindestens drei Werten ist durch den Median und den 90 %-Bereich dargestellt. Die Sensoren wurden nach Median geordnet.
Bei diesen Genauigkeitsparametern wurden keine relevanten Unterschiede zwischen den drei Sensorchargen festgestellt (unveröffentlichte Daten). Ergebnisse zur Genauigkeit des CGM-Systems bei unterschiedlichen Änderungsraten des Glukosespiegels sind in Tabelle 3 dargestellt. Die Genauigkeit war am höchsten, wenn sich die BZ-Werte nicht schneller als -1 bis +1 mg/dl/min veränderten. Die mittlere absolute BZ-RoC während der stationären Aufenthalte betrug 0,86 mg/dl/min.
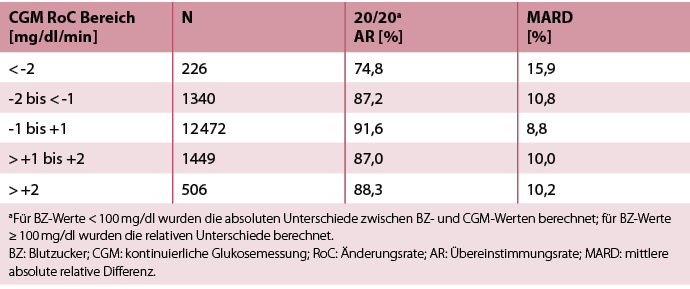 Tab. 3: Genauigkeit bei verschiedenen Veränderungsraten (RoC), ermittelt durch das CGM-System während der Messreihen in den Studienzentren.
Tab. 3: Genauigkeit bei verschiedenen Veränderungsraten (RoC), ermittelt durch das CGM-System während der Messreihen in den Studienzentren.
Während der Tragezeit des Sensors blieb die Genauigkeit relativ stabil mit einer 20/20-AR von mehr als 85 % und MARDs zwischen 8,3 % und 10,8 % während der Messtage am Studienzentrum (Tabelle 4).
 Tab. 4: Genauigkeit bei verschiedenen Sensor-Tragezeiten während der Messreihen in den Studienzentren.
Tab. 4: Genauigkeit bei verschiedenen Sensor-Tragezeiten während der Messreihen in den Studienzentren.
Die Verteilung der sensorspezifischen MARDs ist in Abbildung 2 dargestellt. Die mittlere sensorspezifische MARD betrug 9,8%.
 Abb. 2: Verteilung der sensorspezifischen mittleren absoluten relativen Differenzen (MARD) zwischen den Sensoren (n = 132) während der Messungen in den Studienzentren.
Abb. 2: Verteilung der sensorspezifischen mittleren absoluten relativen Differenzen (MARD) zwischen den Sensoren (n = 132) während der Messungen in den Studienzentren.
Die Consensus-Error-Grid-Analyse zeigte, dass 99,7% (stationär) und 99,8% (kombiniert aus stationär und zu Hause) der Werte in den Zonen A und B und keine Werte in den Zonen D und E lagen (Abbildung 3).
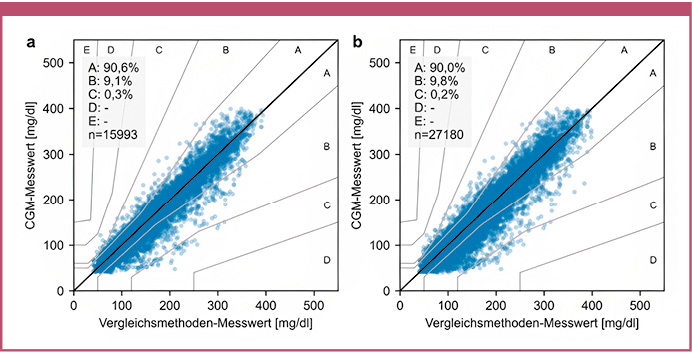 Abb. 3: Consensus-Error-Grid während der Messungen in den Studienzentren (a) und kombiniert während der Messungen in den Studienzentren und zu Hause (b).
Abb. 3: Consensus-Error-Grid während der Messungen in den Studienzentren (a) und kombiniert während der Messungen in den Studienzentren und zu Hause (b).
Laufzeit der Sensoren
Von 166 applizierten CGM-Sensoren wurden 26 (16 %) nicht gestartet und vor Ablauf der Aufwärmzeit entfernt. Zu den Gründen für die vorzeitige Entfernung gehörten offensichtliche oder vermutete Applikationsfehler, Versagen des Pflasters oder Verbindungsfehler. Ein Sensor lieferte nach der Aufwärmzeit keine gültigen Werte. Daher wurden 139 (84 %) Sensoren, die mindestens einen gültigen Wert lieferten, in die Laufzeitanalyse einbezogen (Abbildung 4). Wenn die Aufzeichnung der Sensordaten aufgrund einer technischen Störung abbrach, wurde dies als Sensorausfall gewertet. Im Gegensatz dazu wurden Sensoren, die versehentlich (z. B. Herausziehen des Sensors beim Umziehen) vorzeitig, und Sensoren, die aufgrund des Studienendes entfernt wurden, im Rahmen der Kaplan-Meier-Analyse als zensiert betrachtet. Insgesamt lieferten 109 Sensoren während der gesamten 14-tägigen Tragezeit Werte. Die geschätzte 14-tägige Überlebenswahrscheinlichkeit betrug 82,4 %. Die Datenverfügbarkeit in Bezug auf die tatsächliche Laufzeit (erster aufgezeichneter Wert bis zum Entfernen oder Ausfall des Sensors) jedes Sensors betrug 92,7 ± 3,7 %.
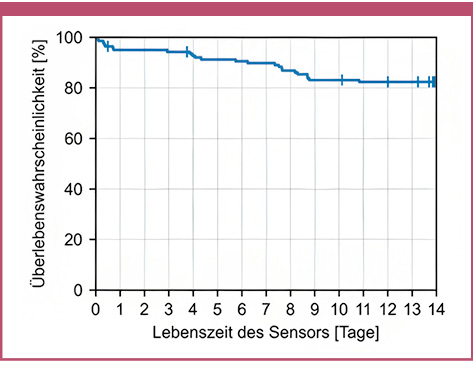 Abb. 4: Kaplan-Meier-Kurve unter Einbeziehung aller Sensoren, die mindestens einen gültigen Wert lieferten (n = 139). Zensierte Sensoren werden als vertikale Striche dargestellt.
Abb. 4: Kaplan-Meier-Kurve unter Einbeziehung aller Sensoren, die mindestens einen gültigen Wert lieferten (n = 139). Zensierte Sensoren werden als vertikale Striche dargestellt.
Sicherheit
Während der Studie wurden 15 unerwünschte Ereignisse im Zusammenhang mit dem CGM-System registriert. Diese Ereignisse bezogen sich alle auf die Sensortragstelle/Einstichstelle und beinhalteten z. B. Juckreiz, Rötungen, Entzündungen, Blutungen oder Hämatome. Von diesen Ereignissen wurden zehn als leicht, zwei als mäßig und drei als schwer eingestuft. Keines der Ereignisse wurde als schwerwiegend eingestuft, und alle Ereignisse klangen ohne Folgeerscheinungen ab. Der Schmerz beim Anbringen des Sensors wurde auf einer Skala von 0 (kein Schmerz) bis 10 (stärkster vorstellbarer Schmerz) bewertet. Der Mittelwert der Bewertung betrug 1,7 ± 1,6, wobei 88 % der 166 Applikationen keine bis leichte Schmerzen verursachten (Bewertung von 0 – 3). Blutungen wurden bei 28 % der Applikationen dokumentiert, wobei 20 % leicht, 7 % mäßig und 1 % schwer waren (zwei der drei schweren unerwünschten Ereignisse waren Fälle von Blutungen, die länger als 5 Minuten andauerten).
Diskussion
In dieser zulassungsrelevanten Studie wurden 14Tage lang die Performance und Sicherheit eines CGM-Systems bei Erwachsenen mit Diabetes mellitus untersucht. Das System zeigte eine gute Genauigkeit mit einer 20/20-AR von 90,5 % (stationär), einer Gesamt-MARD von 9,2 % und einem geringen systematischen Bias im Vergleich zu kapillaren BZ-Messungen. Dieses Genauigkeitsniveau konnte über den gesamten Messbereich, insbesondere im niedrigen glykämischen Bereich, und über die gesamte Tragedauer der Sensoren nachgewiesen werden. Die bei der Berechnung der Stichprobengröße zugrunde gelegte erwartete 20/20-AR von mindestens 84 % wurde bei weitem übertroffen. Die MARDs der einzelnen Sensoren zeigten jedoch, dass es sechs deutlich ungenauere Sensoren mit einem MARD > 20 % gab. Fünf dieser Sensoren hatten eine kurze Überlebenszeit, was für eine effektive Fehlererkennung und anschließende Abschaltung fehlerhafter Sensoren durch das System spricht. Die CG-DIVA zeigt grafisch den geringen Bias und ausreichende Präzision der CGM-Messwerte innerhalb verschiedener Glukosebereiche und verdeutlicht die geringe Sensor-zu-Sensor-Variabilität. Die Genauigkeit der Messungen während stationärer Aufenthalte im Studienzentrum und zu Hause war sehr ähnlich, wodurch die Robustheit des Systems belegt wird.
Die erfolgreich applizierten Sensoren wiesen in dieser Studie eine Überlebensrate von mehr als 80 % und eine Datenverfügbarkeit von über 90 % auf. Es gab keine Sicherheitsbedenken hinsichtlich der Verwendung des CGM-Systems, und die Schmerzen und Blutungen beim Anbringen des Systems lagen im Rahmen der Erwartungen. Da eine in silico-Studie zu dem Schluss kam, dass CGM-Systeme mit einem MARD < 10 % für therapeutische Entscheidungen (einschließlich Insulindosierung) verwendet werden können [Kovatchev 2015], kann das getestete CGM-System aufgrund dieser Studiendaten als sicher für die nicht-adjunktive Anwendung angesehen werden.
Es gibt zahlreiche aktuelle Performance-Studien zur Bewertung anderer CGM-Systeme. Aufgrund der jeweils unterschiedlichen Studienprozeduren ist die Vergleichbarkeit der Ergebnisse zwischen den Studien jedoch nur eingeschränkt möglich. In Bezug auf die Glukose- und RoC-Verteilung, die Vergleichsmethoden und die Berechnung der Endpunkte (z. B. ohne eine Abgrenzung zwischen absoluten und relativen Unterschieden in den ARs) gibt es große Unterschiede. Wie in einer aktuellen Veröffentlichung beschrieben wurde, sind harmonisierte Studienprozeduren zur Untersuchung der Performance von CGM-Systemen wünschenswert [Eichenlaub 2024a].
Alva et al. berichteten eine ähnliche 20/20-AR von 93,1 % (jedoch mit einer Grenze von 80 mg/dl zwischen absoluten und relativen Werten) und eine MARD von 9,2 % für das FreeStyle Libre 2-System von Abbott im Vergleich zu venösen Labormessungen bei Erwachsenen [Alva 2022]. Aus den Zulassungsunterlagen für dieses System kann die mittlere absolute Änderungsrate als ähnlich hoch abgeschätzt werden wie für das System, das in dieser Studie untersucht wurde [Food and Drug Administration 2022, Freckmann 2023]. Ähnliche Ergebnisse wurden auch für das Dexcom G6 System beschrieben, wobei eine 20/20-AR von 92,3 % (Grenze von 80 mg/dl) und eine MARD von 10,0 % berichtet wurden. Die geschätzte mittlere absolute RoC war dabei etwas höher als in dieser Studie [Food and Drug Administration 2021, Wadwa 2018]. Zulassungsstudien für die Systeme der aktuellen Generation dieser beiden Hersteller wurden offenbar mit Studienprozeduren durchgeführt, die zu niedrigeren RoCs führten, aber eine höhere Genauigkeit zeigten [Alva 2023, Garg 2022].
Bei der Interpretation der Ergebnisse dieser Studie sind einige Limitationen zu beachten. Erstens lag die mittlere absolute Vergleichs-RoC bei 0,86 mg/dl/min. Dieser Wert ist ähnlich wie bei den Zulassungsstudien für die oben erwähnten anderen CGM-Systeme, liegt aber im Vergleich zu anderen Studien zur Performance von CGM-Systemen im Mittelfeld [Freckmann 2023]. Im Allgemeinen wären in klinischen Studien strengere Verfahren zur Glukosemanipulation wünschenswert, um eine Dynamik zu induzieren, die eine ausreichende Anzahl höherer RoCs abdeckt, um die CGM-Leistungsfähigkeit insgesamt zu analysieren. Zweitens wurden viele Sensoren direkt nach dem Anbringen wegen vermuteter Applikationsfehler verworfen. Für diese Sensoren liegen keine Leistungsdaten vor und sie konnten nicht in die Überlebensanalyse einbezogen werden. Diese Studie schloss deutlich weniger Teilnehmende ein als andere Zulassungsstudien. Dies wurde durch die Verwendung von drei Sensoren pro Teilnehmenden teilweise kompensiert. Eine statistische Unabhängigkeit kann so jedoch nur für sensorspezifische Faktoren wie Sensorrauschen oder Chargenvariabilität angenommen werden. Mögliche andwenderspezifische Einflüsse lassen sich nicht vollständig ausschließen.
In dieser Studie wurden Proben aus Kapillarblut mit einem BZ-Messgerät als Vergleichswerte gemessen. Obwohl in vielen Zulassungsstudien venöse Proben verwendet werden, wurden kapillare Vergleichswerte in dieser Studie aus mehreren Gründen als angemessen erachtet [Freckmann 2023]. Erstens wird das CGM-System manuell anhand der kapillaren BZ-Werte kalibriert, sodass die CGM-Werte mit Proben desselben Ursprungs wie bei der Kalibrierung verglichen werden. Zweitens sind die Messwerte des CGM-Systems als Schätzung der kapillaren BZ-Werte gedacht, da die Anwender mit kapillaren BZ-Werten vertraut sind und alle Therapieleitlinien auf diesen Werten basieren. Darüber hinaus ist die Kapillarblutentnahme, für die nur kleine Volumina benötigt werden, für die Studienteilnehmenden über längere Zeiträume weniger belastend als das Legen eines Venenkatheters und die hochfrequente Entnahme von venösem Blut.
Zusammenfassend lässt sich sagen, dass diese Studienergebnisse die vorhergesehene nicht-adjunktive Anwendung des untersuchten CGM-Systems (nach der anfänglichen Kalibrierungsroutine) unterstützen und ähnliche Ergebnisse wie die werkseitig kalibrierten CGM-Systeme Dexcom G6 und FreeStyle Libre 2 zeigen.
Über die vorgestellten Eigenschaften und Ergebnisse hinaus sollte das CGM-System als Teil einer umfassenden Lösung betrachtet werden, in diesem Fall in Kombination mit der kürzlich eingeführten Accu-Chek SmartGuide Predict App und der cloudbasierten Accu-Chek Care Plattform. Die App zeigt das Risiko einer Hypoglykämie in den nächsten 30Minuten und während der Nacht an, liefert Menschen mit Diabetes mellitus Glukosevorhersagen für die nächsten zwei Stunden und bietet Einblicke in Glukosemuster. Eine Übertragung der CGM-Daten an die Plattform ermöglicht dem medizinischen Fachpersonal den sofortigen Zugriff auf die Glukosedaten der von ihnen betreuten Menschen mit Diabetes mellitus, um sie bei ihrem Diabetesmanagement zu unterstützen.
Schlussfolgerungen
In dieser Studie trugen 48 Teilnehmende 14 Tage lang jeweils drei Sensoren des CGM-Systems. Die Genauigkeit des CGM-Systems war gut und vergleichbar mit jener von CGM-Systemen der vorherigen Generation von etablierten Herstellern. Insgesamt wurden sehr vielversprechende 14-tägige Performance-Ergebnisse des CGM-Systems bei Menschen mit Diabetes mellitus nachgewiesen.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2025; 34 (2) Seite 87-94


