Die Kommission für Labordiagnostik hat in einem vor zehn Jahren publizierten Positionspapier zum Analyt HbA1c Aussagen zu einer „Störung“ durch einen längeren Transport von Blutproben bis zur Analytik gemacht, demnach soll es zu einer „Nachglykierung“ kommen, d. h. einem klinisch relevanten Anstieg des Messwertes bei der Lagerung und dem Versenden der Proben [Kerner 2015]. Bei der Aktualisierung der Praxisempfehlung der Kommission im Jahr 2024 wurde die Validität dieser Aussage kritisch diskutiert und nach Belegen für oder gegen diese gesucht. Die Frage ist, schreitet die Glykierung des Hämoglobins weiter fort, wenn das Blut in dem Probenröhrchen weiter mit Glukose in Kontakt steht? Es kommt nach aktuellen Daten und der Literatur nicht zu einer relevanten „Nachglykierung“ von Blutproben bei deren Lagerung und deren Probenversand bei Umgebungstemperatur. Die „Nachglykierung“ hat daher für die klinische Praxis keine Bedeutung.
Biochemische Grundlagen
Im Blut verläuft unter physiologischen Bedingungen (37 °C, pH = 7,4, phosphat-gepufferte 154 mM NaCl-Lösung) die Glykierungsreaktion beim HbA1c nicht-enzymatisch wie folgt (Abb. 1) [Higgins 1981]:
- Bildung des Glukose-Addukts (Schiff’sche Base, labiles HbA1c), dabei ist diese Reaktion schnell und reversibel
- Umlagerung (nach Amadori, stabiles HbA1c), diese Reaktion ist langsam und irreversibel
- langsame Weiterreaktion zu "Advanced glycation endproducts"
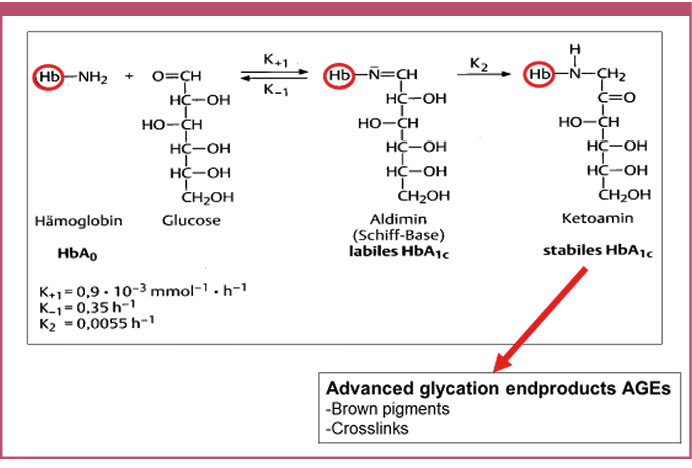 Abb. 1: Die nicht-enzymatische Glykierung von Proteinen (Hämoglobin).
Abb. 1: Die nicht-enzymatische Glykierung von Proteinen (Hämoglobin).
Insgesamt betrachtet verläuft die physiologische Glykierung langsam, d. h. bei 37 °C und einer 120-tägigen Überlebenszeit der Erythrozyten kommt es zu einem Anstieg von ca. 30 mmol/mol Hämoglobin (Hb) bei Nichtdiabetikern über diese Zeit.
Da für die HbA1c-Messung als Probenmaterial EDTA-Blut ohne Zusatz eines Glykolyse-Inhibitoren verwendet wird, läuft die Glykolyse weiter und die entstehende Milchsäure (Laktat) senkt den pH-Wert in der Probe. Ein niedriger pH-Wert vermindert die Bildung der Schiff’schen Base [Higgins 1981]. Zusätze bei den Teströhrchen, wie z. B. EDTA (Ethylendiamintetraessigsäure), sind ohne Einfluss auf den HbA1c-Messwert, da die Erythrozyten vor der Messung lysiert werden und deren "Inhalt" gemessen wird.
Bei HPLC-Trennungsmethoden (Hochleistungsflüssigkeitschromatographie), wird das labile HbA1c-Addukt abgetrennt und kann separat ausgewertet werden. Bei den anderen analytischen Methoden der HbA1c-Messung wird das labile HbA1c durch Reagenzien-Zusätze "eliminiert", sodass nur noch Methoden in Verwendung sind, bei denen das labile HbA1c keine analytische Relevanz hat.
Ergebnisse einer aktuellen Studie und von Ringversuchen
Aktuelle Auswertungen der Ergebnisse der NAKO-Gesundheitsstudie, bei der das Intervall von Abnahme der Blutproben bis zum Zeitpunkt der Analytik erfasst wird, sprechen gegen einen "Nachglykierungs"-Effekt [Hanneman 2024]. Diese Daten basieren auf mehr als 110 000 HbA1c-Messungen, die im Labor der Universitätsmedizin Greifswald in den Jahren 2014 bis 2019 analysiert wurden. Die EDTA-Proben wurden deutschlandweit in den Studienzentren der NAKO-Gesundheitsstudie bei den teilnehmenden Probanden abgenommen und per Post nach Greifswald gesendet. Es zeigte sich kein Unterschied bei den HbA1c-Werten, unabhängig davon, ob sie am nächsten Tag oder erst nach fünf Tagen im Labor analysiert wurden (Abb. 2). Die HbA1c-Bestimmungen erfolgten mittels HPLC an einem Tosoh G8 (Tosoh Bioscience, Inc., San Francisco, USA).
 Abb. 2: HbA1c-Boxplots für die Verteilung der Messwerte nach Probenalter der NAKO-Gesundheitsstudie. Von den 112 359 Messwerten des HbA1c konnte für 70 Messwerte kein Probenalter ermittelt werden. Diese sind im unteren Teil der Abbildung nicht enthalten [Hanneman 2024].
Abb. 2: HbA1c-Boxplots für die Verteilung der Messwerte nach Probenalter der NAKO-Gesundheitsstudie. Von den 112 359 Messwerten des HbA1c konnte für 70 Messwerte kein Probenalter ermittelt werden. Diese sind im unteren Teil der Abbildung nicht enthalten [Hanneman 2024].
Bei Ringversuchen, die von INSTAND betreut wurden, konnte nach Lagerung der Proben für 24 Stunden bei Raumtemperatur und höher keine "Nachglykierung" beobachtet werden, d. h. die Messergebnisse unmittelbar nach der Anlieferung und nach der Lagerung waren praktisch identisch [persönliche Kommunikation Patricia Kaiser]. Zu beachten ist, dass die Glukosekonzentration in den Probenröhrchen über die Zeit hinweg absinkt (z. B. in 24 Stunden über die Hälfte), da die Glykolyse nicht gehemmt wird (s. o.) [Chan 1989]. Ebenfalls wurde keine Veränderung des HbA1c-Messwertes bei Ringversuchsproben beobachtet, die 48 Stunden bei 30 °C aufbewahrt wurden [persönliche Kommunikation Patricia Kaiser]. Weiterhin wurde nie eine Erhöhung oder Verminderung der HbA1c-Messwerte der Ringversuchsproben bemerkt, die den Labors zugeschickt wurden; dabei sind diese Proben bis zur Messung länger unterwegs, vor allem, wenn sie ins Ausland verschickt werden. Diese Ringversuchsproben werden ins Ausland mit Kühlpacks versendet.
Allerdings wurde bei EDTA-Vollblutproben, die bei 37 °C aufbewahrt wurden, nach mehr als 12 Stunden ein "Alterungspeak" beobachtet, der mit einer geringen Verminderung des HbA1c-Messwertes einherging [persönliche Kommunikation Patricia Kaiser].
Aussagen in der Literatur
Eine Durchsicht der Literatur anhand von mehr als 600 Abstracts ergab, dass bei Lagerung der Blutproben bei Raumtemperatur keine signifikante Glykosylierungsrate beobachtet wurde. Um sicher zu gehen, sollten die Blutproben nicht bei Temperaturen > 30 °C gelagert bzw. transportiert werden [Duanginta 2023, Rohlfing 2012, Voss 1993]. Eine "Deglykierung", d. h. eine Abnahme des HbA1c-Wertes unter In-vitro-Bedingungen spielt wohl ebenfalls keine Rolle [Landgraf 2021].
Zusammenfassung
Bei der Lagerung und dem Versenden von Blutproben für die HbA1c-Messung kommt es zu keiner praktisch relevanten "Nachglykierung". Bei Versendung von Proben innerhalb von Deutschland können diese ungekühlt verschickt werden. Dies ist auch für die Durchführung von klinischen Studien von Bedeutung, da dabei Proben über weite Strecken versandt werden. Idealerweise sollte dies unter kontrollierten und definierten Temperaturbedingungen erfolgen, wenn Ländergrenzen überschritten werden und längere Transportzeiten zu erwarten sind.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2025; 34 (3) Seite 160-162


