In den letzten Jahren hat die Nutzung von kontinuierlichen Glukose-Monitoring (CGM)-Systemen durch Menschen mit Diabetes (MmD) deutlich zugenommen [Braune 2022]. Die breite Akzeptanz und wachsende Nutzung von CGM-Systemen beruht auf offensichtlichen Vorzügen gegenüber der kapillären Blutglukosemessung (BGM). CGM-Systeme reduzieren die Notwendigkeit des Fingerstechens und liefern nicht nur einzelne Messpunkte wie BGM sondern eine quasi kontinuierliche Glukosekurve. Weiterhin ermöglichen die Trendpfeile eine Vorhersage des kurzfristigen Glukoseverlaufes und Alarme warnen bei oder vor Überschreiten von Grenzwerten. Moderne Systeme bieten die Möglichkeit CGM-Daten sowohl mit Angehörigen als auch medizinischen Fachpersonal teilen zu können. Die durch die Anwendung von CGM erreichte Optimierung der Versorgungsqualität zeigt sich in einer Steigerung der Lebensqualität, einer HbA1c-Verbesserung [Battelino 2012, Beck 2009, Beck 2017, Lind 2017, Maiorino 2020] sowie einer Prävention von Hypoglykämien [Bolinder 2016, Heinemann 2018, van Beers 2016].
Die Nutzung von CGM-Systemen macht daher auch vor Krankenhäusern (KH) und Pflegeeinrichtungen (PE) nicht halt [Galindo 2020]. Während ihres Aufenthalts dort wollen MmD ihr CGM-System für die Kontrolle ihres Glukoseverlaufes und die Anpassung der Diabetestherapie weiter nutzen, vorausgesetzt sie sind dazu in der Lage. Zudem zeigen Studien, dass die Anwendung von CGM-Systemen durch das medizinische Personal zur Glukoseüberwachung bei MmD dem Pflegepersonal die Arbeit erleichtern, das Glukosemonitoring verbessern und die Anzahl von Point-of-Care-Blutglukosemessungen (POC-BGM) reduzieren kann [Davis 2021, Davis 2021, Longo 2022]. Anfangs besteht hier jedoch ein nicht unerheblicher Organisations- und Schulungsbedarf.
Die Corona-Pandemie hat der Nutzung von CGM-Systemen im stationären Bereich einen erheblichen Schub gegeben; um das Infektionsrisiko des Personals zu reduzieren, wurde vielfach diese kontaktlose diagnostische Option eingesetzt [Jecht 2022]. Die Entscheidung der "Food and Drug Administration" (FDA) in den USA, die Verwendung von CGM-Systemen bei Krankenhauspatienten auch ohne Zulassung für diesen Einsatzzweck nicht zu widersprechen, um dadurch das Personal während der Pandemie zu unterstützen, hat außerdem dazu beigetragen, dass eine Reihe von Studien zum Einsatz von CGM-Systemen im stationären Bereich durchgeführt wurden [Agarwal 2021, Davis 2021, Longo 2022, Nair 2020, Perez-Guzman 2021, Reutrakul 2020, Sweeney 2022].
In der letzten Zeit häufen sich Anfragen von verantwortlichen Mitarbeitern in Krankenhäusern bei AGDT und Kommission Labordiagnostik in der Diabetologie, denen Informationen zu den Vorgaben beim CGM-Einsatz im Krankenhaus fehlen. Daher versuchen wir mit diesem Beitrag die Möglichkeiten und Herausausforderungen beim CGM-Einsatz in Krankenhaus und Pflegeeinrichtung zu betrachten.
Zur Einschätzung des Stellenwerts von CGM-Systemen im Krankenhaus sind Unterschiede in der Population (MmD, die mit ihrem eigenen CGM-System ins Krankenhaus kommen oder MmD, bei denen das CGM erst im und durch das Krankenhaus initiiert wird) und des Krankenhausbereichs (periphere, Überwachungs-, Intensivstation) zu berücksichtigen und potentiell die Genauigkeit beeinflussende Faktoren wie Medikation und Komorbiditäten, sowie die notwendigen Rahmenbedingungen (Qualifikation des Personals, strukturierte Prozesse, notwendiges technisches Setting, juristische Situation) zu beleuchten.
CGM: Kontinuierliches Glukosemonitoring
iscCGM: intermittent-scanning-CGM
KH: Krankenhaus
KIS: Krankenhaus-Informationssystem
KLD: Kommission Labordiagnostik in der Diabetologie
MmD: Menschen mit Diabetes
MARD: Mean Absolute Relative Difference
PE: Pflegeeinrichtung
POC: Point-of-Care
PmD: Patienten mit Diabetes
rtCGM: real-time-CGM
Rili-BÄK: Richtlinien der Bundesärztekammer
T1D: Typ-1-Diabetes
T2D: Typ-2-Diabetes
Glukosemonitoring in KH und PE
MmD mit Hyper- oder Hypoglykämien weisen unter den Bedingungen im KH ein erhöhtes Risiko für eine Zunahme der Morbidität, Mortalität und der Gesundheitskosten auf [Cardona 2018, van den Berghe 2001]. Bei älteren MmD, die den Hauptanteil der in KH oder PE zu versorgenden Menschen ausmachen, ist neben der Therapieverbesserung die Verringerung der Häufigkeit von Hypoglykämien ein vorrangiges Therapieziel.
Üblicherweise erfolgen diagnostische Glukosemessungen im KH oder PE aus einer venös entnommenen Blutprobe, die zur Plasmagewinnung zentrifugiert wird. Auf "Diabetesstationen" (oder solchen, in denen Glukosemessungen vor Ort durchgeführt werden) gilt diese Aussage in der Regel nur im Rahmen des Aufnahmeprogramms und beim oralen Glukosetoleranztest. Bei den zur Therapiekontrolle durchgeführten Glukose-Bestimmungen auf diesen Stationen erfolgt die Messung in kapillären Blutproben mithilfe von Point-of-Care (POC)-Messsystemen. Diese werden durch das Pflegepersonal durchgeführt und die Messwerte dienen als Grundlage zur Anpassung der Diabetestherapie.
Aus regulatorischer Sicht handelt es sich bei diesen Glukosemesssystemen um in-vitro-Diagnostika, deren Messgüte nach den Qualitätskontrollvorgaben der Richtlinien der Bundesärztekammer (Rili-BÄK) systematisch überwacht werden. Als "State of the Art" gilt dies als Basis für professionelle Therapieempfehlungen, wie Insulindosierungen. Dies ist zulässig, da die zugrundeliegende Glukosemessung auf einer qualitätsgesicherten Messmethode basiert.
Viele MmD (insbesondere solche mit Typ-1-Diabetes (T1D)) sind jedoch langjährig daran gewöhnt, ihre Diabetestherapie eigenständig durchzuführen. Wenn ihnen nach der Aufnahme ins KH oder die PE das CGM-System (und System zur Insulinapplikation) von dem Pflegepersonal auf der jeweiligen Station abgenommen wird oder dessen Messergebnisse vom Pflegepersonal nicht für Therapieentscheidungen genutzt werden, verunsichert dies viele MmD erheblich. Sie zweifeln an der Kompetenz der Behandler bei Anpassungen der Diabetestherapie, was zu Problemen in der Betreuung führen kann. Gründe für die bisher fehlende Nutzung von CGM durch medizinisches Fachpersonal im KH und PE ist nicht nur die Schulung des Personals, sondern sind auch Qualitätskontroll- und regulatorische Vorgaben, die im weiteren Text erläutert werden.
Kontinuierliches Glukosemonitoring
CGM-Systeme messen kontinuierlich die Glukosekonzentration in der interstitiellen Flüssigkeit des subkutanen Fettgewebes im ein- bis fünfminütlichen Intervall. Die Glukose-Daten werden auf ein Empfangsgerät (Lesegerät oder kompatibles Smartphone) übermittelt und dort angezeigt. Es werden Informationen zum aktuellen Glukosewert, zum Glukoseverlauf und als Trendpfeil zur Änderungsrichtung und -geschwindigkeit der Glukosekonzentration sowie ein Alarm-System zur Verfügung gestellt [Freckmann 2020]. Je nach Ausführung bei dem gegebenen CGM-System werden bei Über- oder Unterschreiten definierter Glukosewerte Schwellenwertalarme oder bei vorausgesagtem Erreichen dieser Grenzwerte Änderungsratenalarme ausgelöst.
Der therapeutische Nutzen von CGM-Systemen wurde in den letzten zwei Jahrzehnten in unterschiedlichen Populationen (Erwachsene, Kinder, Schwangere oder Menschen mit Hypoglykämie-Wahrnehmungsstörung) im ambulanten Setting und im direkten Vergleich zur BGM durch eine Vielzahl klinischer Interventionsstudien und Real-World-Daten belegt [Aleppo 2017, Heinemann 2018, Tamborlane 2008, van Beers 2016]. Damit die Möglichkeiten der CGM-Systeme im Alltag genutzt werden und es zu einer Verbesserung der Glukosekontrolle kommt, ist eine umfassende, geeignete Schulung der MmD zur Nutzung der CGM-Daten essentiell [Schlueter 2022]. Zur Anwendbarkeit und zum Nutzen von CGM-Systemen im stationären Bereich ist die verfügbare Evidenz deutlich limitierter und basiert derzeit vorwiegend auf Studien mit niedriger Fallzahl, im COVID-19- und Intensivstation-Setting.
Eine Herausforderung für die Nutzung von CGM-Systemen im Krankenhaus ist, dass CGM-Systeme vom Hersteller (zumeist) für die Nutzung durch die Patienten selbst vorgesehen sind. Wie ausgeführt ist keine Möglichkeit zur Qualitätskontrolle (QC) wie bei Blutzuckermessgeräten vorgesehen. Fehlende entsprechende Zweckbestimmung und Möglichkeiten zur QC stellen hohe Hürden für den professionellen Einsatz im Krankenhaus dar.
Angaben zum CGM-Einsatz im Krankenhaus sind in aktuellen deutschen Praxisempfehlungen und Leitlinien kaum zu finden. In aktuellen amerikanischen Leitlinien findet sich folgendes dazu: Patienten, die mit CGM ins Krankenhaus kommen, sollen das CGM weiter nutzen dürfen, sofern der Patient dazu in der Lage ist und das Krankenhaus die notwendige Erfahrung hat sowie die Betreuung sicherstellen kann. Weiterhin wird klargestellt, dass CGM-Nutzung im Krankenhaus derzeit nicht FDA-zugelassen ist und POC-BG Messungen für die Insulindosierung erforderlich sind [Blonde 2022, ElSayed 2023, Korytkowski 2022]. Die österreichischen Leitlinien stellen dar, dass keines der aktuellen Systeme für die Nutzung im Krankenhaus zugelassen ist. Einer Nutzung durch den Patienten stehe allerdings nichts entgegen; ergänzende Messungen durch hauseigene POC-Systeme zu definierten Zeitpunkten werden jedoch empfohlen [Mader 2023].
Die Endocrine Society, USA, empfiehlt darüber hinaus für Erwachsene mit insulinbehandeltem Diabetes, die wegen einer Erkrankung ins Krankenhaus eingeliefert werden und bei denen ein hohes Hypoglykämierisiko besteht, zur Bestätigung die Verwendung von CGM mit POC-BG-Monitoring für Anpassungen der Insulindosierung, sofern Ressourcen und Schulungen verfügbar sind [Korytkowski 2022].
Studienlage zum Nutzen von CGM-Systemen in KH und PE
Beim Einsatz von CGM-Systemen im KH und PE gilt es eine ganze Reihe von besonderen Anforderungen zu beachten, die die Übertragbarkeit von Studienergebnissen unter Alltagsbedingungen deutlich erschweren. Bei solchen klinischen Studien wird die Nutzung von CGM-Systemen vielfach als Ersatz von BGM evaluiert [Aleppo 2017, Heinemann 2018, Tamborlane 2008, van Beers 2016]. Es liegen jedoch nur eine beschränkte Anzahl von solchen Vergleichsstudien unter den spezifischen und ausgesprochen heterogenen Bedingungen in den verschiedenen Abteilungen und Bereichen im KH oder PE vor, die im Folgenden getrennt voneinander betrachtet werden.
Genauigkeit
Ob sich CGM-Systeme prinzipiell für den Einsatz in KH und PE eignen, hängt unter anderem von der analytischen Messgüte der Systeme ab, d.h. der Zuverlässigkeit, mit der diese die Glukosekonzentration messen. Zur Bewertung dieser Frage wird üblicherweise von den Herstellern der CGM-Systeme der sogenannte MARD-Wert angegeben. Die Abkürzung MARD steht für "Mean Absolute Relative Difference", auf Deutsch "mittlere absolute relative Abweichung". Beim MARD wird der Mittelwert der Absolutwerte der Differenzen zwischen CGM-Wert und Vergleichsglukosewert berechnet.
Allerdings weist dieser Wert eine Reihe von bekannten Schwächen auf, so kann durch die Wahl des Studienprotokolls/der Studienpopulation die MARD erheblich beeinflusst werden, ohne dass dies von der eigentlichen Messtechnik abhängt [Freckmann 2023, Heinemann 2020, Pleus 2022]. Aktuell verfügbare CGM-Systeme weisen – vor allem in Studien, die von den Herstellern dieser Systeme initiiert werden – MARD-Werte <10 % auf. Die Unterschreitung dieses Grenzwertes wird als Voraussetzung für die Verwendung des jeweiligen CGM-Systems als Ersatz der BGM betrachtet, wobei es keine regulatorischen Vorgaben oder andere Belege aus klinischen Studien dafür gibt. Die Evaluierung der Genauigkeit von CGM-Systemen erfolgt üblicherweise bei Studien, an welchen MmD teilnehmen, die ansonsten aber gesund sind.
Wenn es um den professionellen Einsatz von CGM-Systemen im KH oder PE geht, dann gilt es Informationen zur Genauigkeit und Zuverlässigkeit der Glukosemessung über die Tragedauer der Systeme (bis zu 14 Tage) und die Einflussfaktoren unter diesen Bedingungen zu haben [Bellido 2023]. In den letzten 20 Jahren hat sich die Genauigkeit der CGM-Systeme, häufig charakterisiert durch den oben beschriebenen MARD-Wert, deutlich verbessert [Bailey 2021]. Es stellt sich die Frage, in wie weit Daten aus Studien mit ambulanten Probanden auf den Einsatz im KH und PE übertragbar sind. Es gibt wenige systematische CGM-Untersuchungen zur Genauigkeit von CGM-Systemen im KH-Setting, insbesondere zur Genauigkeit bei Patientengruppen mit weiteren Erkrankungen. Die Genauigkeit der Glukosemessung durch CGM-Systeme sollte hierfür nach einem standardisierten Verfahren evaluiert werden [Schlueter 2022].
Bisher gibt es keine etablierten internationalen Standards – wie die ISO-Norm für BG-Messsysteme – für die Evaluation der Genauigkeit von CGM-Systemen. Eine Arbeitsgruppe der "International Federation of Clinical Chemistry and Laboratory Medicine" befasst sich mit den für die Entwicklung eines derartigen Standards notwendigen Verfahren [International Federation of Clinical Chemistry and Laboratory Medicine 2019]. Die FDA hat Vorgaben für die Messgenauigkeit von interoperablen CGM-Systemen etabliert [Garg 2018]. Inwieweit die Akzeptanzkriterien für den Einsatz im KH anwendbar sind, ist derzeit in der Diskussion. Des Weiteren erscheint die Definition von Studienprozeduren erforderlich.
CGM auf der Intensivstation
Ein systematisches Review, welches 32 Studien aus den Jahren 2006 bis 2016 berücksichtigt und die Messgüte von CGM-Systemen beim Einsatz auf der Intensivstation untersucht hat, zeigt eine große Variabilität in den Studienprozeduren und keine befriedigende Messgüte der recht unterschiedlichen Systeme in der Mehrzahl der betrachteten Studien [van Steen 2017]. Dabei erfolgte die Glukosemessung mit dem CGM-System bei 60 % der Studien in der subkutanen interstitiellen Flüssigkeit; bei 31 % der Studien erfolgte die Messung intravaskulär oder es wurden keine Angaben dazu gemacht. Die berichteten Genauigkeitswerte differierten massiv zwischen den Studien, wobei die Genauigkeit der Glukosemessung bei der intravaskulären Messung generell höher war als bei der Messung in der subkutanen interstitiellen Flüssigkeit.
Auf Intensivstationen erhalten die vielfach schwer erkrankten Patienten (dies können auch Menschen sein, die nicht an Diabetes erkrankt sind, aber aktuell erhöhte Glukosewerte aufweisen) eine ganze Reihe von verschiedenen Medikamenten und Substanzen in teilweise hohen Konzentrationen, was zu falschen Messwerten führen kann ("Interferenzen"). Weiterhin kommt es zu erheblichen Flüssigkeitsverschiebungen zwischen den verschiedenen Kompartimenten im Körper je nach Krankheitssituation und Therapie. All diese Faktoren können Gründe für erhebliche Differenzen zwischen CGM-Messwerten und parallel durchgeführten BGM sein, auf denen sonst die Glukoseüberwachung und damit die glukosesenkende Therapie beruht.
Ein hybrider Ansatz, d.h. die parallele Nutzung eines CGM-Systems und eines hochqualitativen POC-Blutglukosemesssystems (welches die regulatorischen Vorgaben erfüllt, s.u.), stellt bei kritisch kranken Patienten mit COVID-19 nach einer aktuellen Publikation eine pragmatische Alternative für den sicheren Einsatz von CGM-Systemen auf der Intensivstation dar [Davis 2021]. Bei dieser Untersuchung wurde die Überwachung von 9 künstlich beatmeten und unter anderem mit Cortison behandelten Patienten mit einem CGM-System (Dexcom G6) durchgeführt und alle 6 Stunden die Glukosekonzentration im Blut durch eine POC-Messung validiert (plus initiale CGM-Messung mit Validierung nach 2 Stunden). Wenn vorher definierte Validierungskriterien durch die POC-Messung bestätigt wurden, wurden die Messwerte des CGM-Systems als vertrauenswürdig betrachtet und in der Folgezeit bis zur nächsten Validierungsmessung genutzt. Falls die CGM-Werte außerhalb der Kriterien lagen, es eine Änderung in der klinischen Situation gab oder Glukosemesswerte <100 mg/dl (bei BGM oder CGM) auftraten, wurden die BGM-Messwerte für die Therapieanpassung verwendet. Nach den Ergebnissen dieser Studie kann die CGM-Nutzung BGM-Messungen nicht vollständig ersetzen, aber es konnte eine durchschnittliche Verringerung der BGM-Messungen um 63 %, und somit eine Verringerung des Krankenpflegeaufwands am Krankenbett erreicht werden, bei Etablierung und Aufrechterhaltung einer angemessenen Glukosekontrolle.
CGM auf der Normalstation
Bei einer Untersuchung mit 97 Menschen mit Typ-2-Diabetes (T2D) mit einer Basal-Bolus-Insulintherapie, die in einem KH behandelt wurden, wurde der mittlere MARD-Wert eines iscCGM-Systems von 14,8 % als akzeptabel betrachtet [Galindo 2020]. Es zeigte sich allerdings im Vergleich zu einem POC-Glukosemesssystem in kapillären Blutproben ein deutlich negativer Bias und die MARD-Werte lagen bei Glukosewerten von 51-69 mg/dl bei 27,9 %, von 70-180 mg/dl bei 16,7 %, von >180 mg/dl bei 12,1 % und bei >250 mg/dl bei 11,4 %.
Bei einer Untersuchung mit 218 hospitalisierten MmD (die nicht auf einer Intensivstation behandelt wurden) ergab die Analyse von gepaarten Messungen mit einem POC-Glukosemesssystem in kapillären Blutproben und einem rtCGM-System (Dexcom G6) einen mittleren MARD von 12,8 % [Davis 2021]. Die Messgüte war bei dem rtCGM-System bei niedrigen Glukosewerten und bei Patienten mit einer Anämie eingeschränkt.
Ältere Patienten
Besonders bei älteren MmD stellt die Verringerung oder Vermeidung von Hypoglykämien in KH oder PE ein vorrangiges Therapieziel dar. Die Nutzung von CGM-Systemen ermöglicht eine frühzeitigere und schnellere Detektion von Hypoglykämien als dies bei BGM möglich ist [Deutsche Diabetes Gesellschaft 2018, Pratley 2020]. Pratley et al. untersuchten die Effektivität von CGM im Vergleich zu BGM bei älteren Menschen (≥60 Jahre) mit T1D. Es zeigte sich eine signifikante Verringerung von Hypoglykämien um 27 Minuten pro Tag über 6 Monate bei Nutzung von CGM [Pratley 2020]. Systematische klinische Studien zur Messgüte von CGM-Systemen bei älteren MmD gibt es jedoch kaum, wobei diese den Hauptanteil von Patienten im KH und insbesondere in PE darstellen.
Komorbiditäten
In KH und PE gibt es neben "Sondersituationen", wie der Intensivstation, auch Patienten die eine spezielle Therapie, wie z.B. eine Hämodialyse, erfahren [Toyoda 2021]. Bei der Untersuchung von Toyada et al. wurde die Genauigkeit der Messung eines CGM-Systems (Abbott FreeStyle Libre) bei 41 MmD mit T2D evaluiert, während eine Hämodialyse durchgeführt wurde. Die CGM-Messwerte lagen signifikant niedriger als kapilläre Blutglukosewerte, die parallel dazu gemessen wurden. Die MARD-Werte über 14 Tage hinweg betrugen im Mittel 23,4%, vor der Hämodialyse lagen sie bei 21,7% und danach bei 25,8% (p<0,05 im Vergleich zu den Werten vor der Hämodialyse).
Bei einer beim ATTD 2021 vorgestellten Untersuchung wurden relevante Unterschiede zwischen zwei CGM-Systemen (iscCGM; Abbott FreeStyle Libre vs. rtCGM; Dexcom G5) beobachtet, wenn diese simultan ambulant bei Menschen mit T1D oder T2D eingesetzt wurden, die eine fortgeschrittene diabetische Nephropathie aufwiesen [Ólafsdóttir 2022]. Die Messungen mit dem iscCGM-System lagen deutlich niedriger als die mit dem rtCGM-System im Vergleich zu kapillären POC-BG (kapPOC-BG), auch die MARD-Werte unterschieden sich signifikant (20,9 % vs. 15,2 %). Eine aktuelle Studie mit Hämodialyse-Patienten ergab eine MARD für Dexcom G6 von 22,7 % und von 11,3 % für den Libre 1 im Vergleich zu venösen Blutglukosewerten [Avari 2023]. In einer anderen Studie zeigte der Dexcom G6 im Vergleich zu venösen Blutglukosewerten einen MARD von 14,7 % und zu kapPOC-BG einen MARD von 13.8 % [Villard 2022]. Diese Untersuchungen weisen auf eine zumindest zum Teil unzureichende Messgenauigkeit von CGM-Systemen bei dialysepflichtigen Patienten hin, sowie auf klinisch relevante Unterschiede in den Messergebnissen je nach verwendetem CGM-System; geeignete weitere klinische Studien sollten durchgeführt werden.
Interferenzen und interferierende Prozeduren
Ein erhebliches Problem bei der Nutzung von CGM-Systemen im KH und in PE stellen Interferenzen dar, d.h. die Gabe von bestimmten Medikamenten oder Zufuhr von Substanzen, aber auch hohe Konzentrationen von körpereigenen Substanzen, können zu klinisch relevanten Fehlmessungen der CGM-Systeme führen [Heinemann 2022]. Bei der elektrochemischen Reaktion an der Spitze des Nadelsensors im subkutanen Gewebe kommt es – unterschiedlich je nach verwendeter enzymatischer Reaktion, Membranen an der Sensorspitze und verwendeter elektrischer Spannung – zu falsch-hohen oder -niedrigen Glukosemesswerten. So weist ein bisher vielfach verwendetes iscCGM-System (FreeStyle Libre 2 von Abbott) eine ausgeprägte Interferenz mit Ascorbinsäure (Vitamin C) auf und andere (Dexcom G6 und Guardian Sensor 3 von Medtronic) mit Hydroxyurea. Ein implantierbares CGM-System (Eversense von Senseonics/Ascensia) weist eine Interferenz mit Mannitol und Tetrazyklinen auf [Galindo 2020, Heinemann 2022]. Es kann nicht ausgeschlossen werden, dass die CGM-Systeme Interferenzen mit weiteren Substanzen aufweisen, die bisher noch nicht bekannt sind.
Bildgebung
Laut Herstellerangaben sollen CGM-Systeme vor Röntgenaufnahmen, CT-Scans oder MRTs abgenommen werden. Interessanterweise zeigt eine Studie, bei der 49 Patienten vor und nach radiologischen Prozeduren mit einem CGM-System (Dexcom G6) untersucht wurden, keine Unterschiede in Bezug auf die Glukosemessgenauigkeit [Migdal 2020].
Sonstige Prozeduren
Bei einer bereits beschriebenen Studie wurden in besonderen Situationen deutlich diskrepante Messwerte zwischen den beiden Glukosemessmethoden beobachtet, so bei Hypothermie oder nach längerem Druck auf die Hautstelle, wo der Sensor des CGM-Systems eingestochen war [Davis 2021]. In anderen Studien wurden deutliche Abweichungen der CGM-Werte bei folgenden Prozeduren gezeigt: Lagerung auf dem Sensor, Gewebeperfusion, Elektrokauterisation, Hypothermie, Sauerstofftherapie, Prozeduren während einer Operation, etc. [Buschur 2022, Davis 2021, Herzig 2023, Perez-Guzman 2021]. Ebenfalls dürfen CGM-Systeme nicht bei Bestrahlungen oder Diathermie am Körper verbleiben [Migdal 2020, Thomas 2023].
Regulatorische Vorgaben
Qualitätskontrolle für die Glukosemessung
Für die Qualitätskontrolle sind die grundlegenden Regelungen in der Medizinprodukte-Betreiber-Verordnung (MPBetreibV) [MPBetreibV] aufgeführt: In §9 MPBetreibV wird für alle laboratoriumsmedizinischen Untersuchungen mit in-vitro-Diagnostika ein Qualitätssicherungssystem gefordert und auf die Rili-BÄK verwiesen [Bundesärztekammer 2023]. Für die Nutzung von laboratoriumsmedizinischen Untersuchungen in der Heilkunde legt diese Richtlinie grundsätzliche Anforderungen zur Qualitätssicherung fest. Demnach muss bei qualitätskontrollierten Laborparametern, wozu die BGM gehört, zweimal pro Tag zur internen Qualitätskontrolle die Messung eines Kontrollmaterials erfolgen, sowie einmal im Vierteljahr an einer externen Qualitätskontrolle durch Vermessen einer zugesandten Referenz-Probe im Rahmen eines Ringversuches teilgenommen werden. Die Messergebnisse müssen innerhalb vorgegebener Bestehensgrenzen liegen
Messsysteme für die Blutglukosemessung fallen als in-vitro-Diagnostika unter die Regelungen der Rili-BÄK. Da die Sensoren von CGM-Systemen die Glukosekonzentration im Körper messen und nicht in einer Blutprobe, handelt es sich um Medizinprodukte und nicht um in-vitro-Diagnostika. Somit ist die Rili-BÄK für CGM nicht anwendbar. Weiterhin besteht bei CGM-Systemen keine praktikable Möglichkeit, Probenmaterial, d.h. interstitielle Flüssigkeit, für die Qualitätskontrolle zu gewinnen. Daher sind die bei BGM-Messungen verwendeten Ansätze zur Qualitätskontrolle bei CGM-Systemen nicht durchführbar.
Für die verschiedenen CGM-Systeme gibt es also weder Standards noch etablierte Kontrollmethoden zur Qualitätskontrolle, d.h. diese diagnostische Option kann (und darf) nicht als qualitätskontrolliert betrachtet werden. Diese Problematik stellt für den Einsatz von CGM-Systemen in KH oder PE eine erhebliche rechtliche Hürde dar. Es erscheint also notwendig für den CGM-Einsatz im Krankenhaus eine angemessene Möglichkeit der Qualitätskontrolle zu etablieren. Diese könnte z.B. durch eine zu definierende Anzahl von Blutglukosemessungen in kapillären Blutproben erreicht werden.
Zweckbestimmung – Intended Use
Aus haftungsrechtlicher Sicht ist es eine kritische Frage, wer unter stationären Bedingungen die Glukosemessung mit CGM-Systemen durchführen und nutzen darf: Nur die MmD oder auch das Fachpersonal? Nach MPBetreibV [MPBetreibV], dürfen die Medizinprodukte nur entsprechend der Zweckbestimmung eingesetzt werden. Die Zweckbestimmung der CGM-Systeme wird nach §4(1) der MPBetreibV vom jeweiligen Hersteller festgelegt und kann den Unterlagen bzw. Bedienungsanleitungen der verschiedenen CGM-Systeme entnommen werden ("Intended Use").
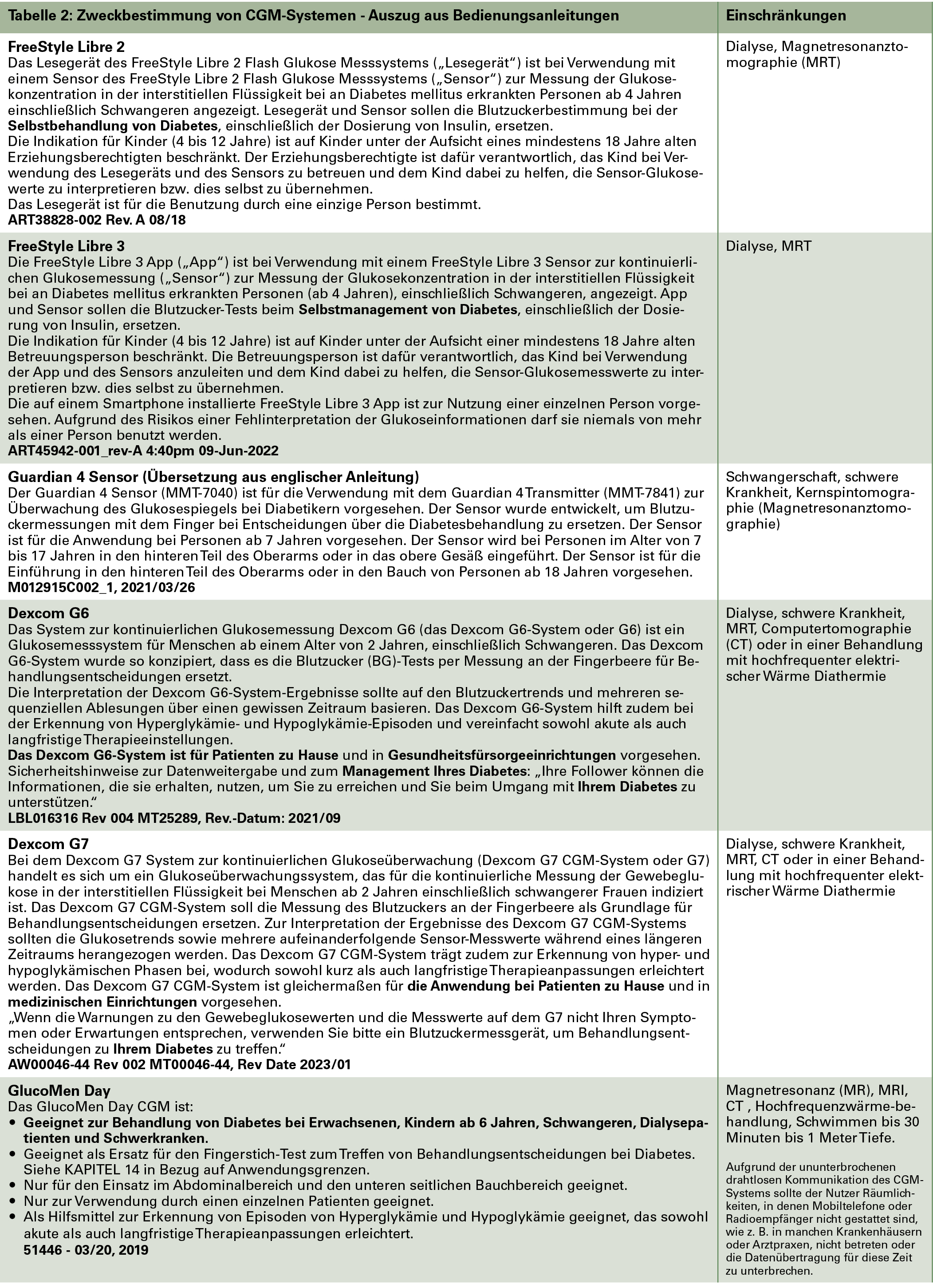
Laut ihrer Zweckbestimmung dürfen einige Geräte für die BGM durch Fachpersonal in KH oder PE verwendet werden. Von den derzeit verfügbaren CGM-Systemen weist allerdings kein einziges eine eindeutige Zweckbestimmung für den Einsatz und Nutzung der Werte durch Fachpersonal in KH oder PE auf. Die Formulierungen in den Zweckbestimmungen der CGM-Systeme sind teilweise nicht zutreffend oder eine unzureichende Beschreibung (Tab. 2). Daher stellt die Nutzung von CGM-Systemen in KH oder PE (also eine "professionelle" Nutzung) im strengen Sinne einen "off-label"-Use dar, was bei Medizinprodukten, im Gegensatz zu Medikamenten, nach §4(1) in der MPBetreibV nicht zulässig ist. Bei einem "off-label"-Use übernimmt der Anwender nach MDR: Art 16 Abs. 1b die Herstellerverantwortung [2017]. Diese Problematik ist den Anwendern in KH oder PE (und der Leitung der Einrichtung, die rechtlich haftend ist) vielfach nicht bekannt, stellt aber ein erhebliches rechtliches Risiko dar.
Haftung
Wenn ein MmD während seines Aufenthaltes in KH oder der PE bewusst auf die Durchführung einer Rili-BÄK-gesicherten BGM verzichtet oder diese verweigert, weil er weiterhin seine Diabetes-Therapie basierend auf den Werten "seines" CGM-Systems durchführen will, ergeben sich haftungsrechtliche Fragen. Aus zivilrechtlicher Sicht besteht ein Behandlungsvertrag, der das Verhältnis zwischen KH/PE und Patient regelt (§ 630a Abs. 1 BGB) und an den sogenannten Facharztstandard bindet. Der Patient soll sich darauf verlassen können, dass er gemäß dem aktuellen Stand der Wissenschaft und Technik in der jeweiligen Einrichtung behandelt wird.
Da für CGM-Systeme die in diesen Einrichtungen vorgeschriebene Qualitätskontrolle für Glukosemessungen nicht anwendbar ist, und da zumindest ein Teil der CGM-Systeme laut jeweiliger Bedienungsanleitung oft nicht als vollständiger Ersatz von BGM für Therapieentscheidungen verwendet werden darf und in der Zweckbestimmung auch nicht für den Einsatz durch professionelles Personal vorgesehen ist, ist die Verwendung solcher CGM-Systeme für Behandlungsentscheidungen im KH/PE eigentlich ausgeschlossen (Tab. 2). Diese CGM-Systeme dürfen also aus haftungsrechtlicher Sicht auch auf ausdrücklichen Wunsch der MmD im klinischen Rahmen nicht als Ersatz für BGM eingesetzt werden.
Bei CGM-Systemen, die laut Angaben der Hersteller ("Zweckbestimmung"; s.o.) unter Berücksichtigung der Vorgaben in der Bedienungsanleitung in KH und PE genutzt werden dürfen, muss auf das "Kleingedruckte" in der Bedienungsanleitung geachtet werden: Ist die Nutzung auf Selbstbehandlung beschränkt? Muss dann nicht für jede Therapieentscheidung eine BGM erfolgen? CGM sollte nur nach einer ausführlichen Aufklärung über das CGM und die notwendigen weiteren BGM sowie mit ausdrücklicher Zustimmung des Patienten eingesetzt werden.
Es ist nicht eindeutig klar, ob KH und PE als juristisch gleichgestellte Einrichtungen zu betrachten sind und ob und in welchem Umfang in welcher Einrichtung CGM-Systeme zur Therapieentscheidung durch medizinisches Personal eingesetzt werden dürfen. Erfolgt eine Insulindosierung durch das Pflegepersonal, nachdem ein Glukosemessverfahren zur Anwendung gekommen ist, das nicht hätte verwendet werden dürfen, liegt unter Umständen ein "grober Behandlungsfehler" vor. Gemäß § 630h BGB wird bei einem groben Behandlungsfehler angenommen, dass der Behandlungsfehler für die Fehldosierung ursächlich war. Diese Vermutungswirkung ist in der Praxis kaum zu widerlegen ("Beweislastumkehr"). Weiterhin könnte auch das Haftungsrecht gem.§823 BGB für das Personal eine Rolle spielen.
Dokumentation des Glukosemonitorings
Grundsätzlich müssen alle gemessenen Glukosewerte in der Patientenakte dokumentiert und archiviert werden, insbesondere wenn dadurch Therapieentscheidungen initiiert wurden. Bei speziell für den hier betrachteten Einsatzbereich entwickelten POC-BGM-Systemen ist das üblich und die Dokumentation der Messwerte erfolgt weitgehend digital und automatisch. Im Gegensatz hierzu werden Daten, die bei der Nutzung von CGM-Systemen erhalten werden, in Deutschland bislang nicht automatisch in das Krankenhaus-Informationssystem (KIS) übernommen. Die Dokumentation und Archivierung der erheblichen Datenmengen, die bei der Nutzung von CGM-Systemen anfallen, ist bei diesen Dokumentationssystemen in Deutschland nicht vorgesehen und stellt daher für diese eine erhebliche Herausforderung in verschiedener Hinsicht dar.
Die Hersteller der CGM-Systeme sind zum Teil darum bemüht, die notwendigen strukturellen Voraussetzungen zu etablieren, um die Daten von CGM-Systemen in KIS-Systeme einspielen zu können. Der konkrete Stand der Dinge und woran dies im Alltag in Deutschland scheitert, ist unklar, im Ausland ist man da deutlich weiter [Espinoza 2022]. Ein Aspekt hierbei ist anscheinend, dass die Kostenübernahme hierfür nicht geklärt ist. Da die Daten von CGM-Systemen bisher herstellerspezifisch in unterschiedlichen Formaten ausgegeben werden, stellt eine verpflichtende Standardisierung des Datenformates und Öffnung der Schnittstellen (für die es in anderen Ländern entsprechende Vorschläge gibt) die einzige Option dar, um perspektivisch die CGM-Daten im KIS dokumentieren zu können.
Anforderungen an das Pflegepersonal
Eine weitere wesentliche Problematik im Zusammenhang der Nutzung von CGM-Systemen in KH oder PE stellt das in vielen Einrichtungen limitierte Know-how hinsichtlich moderner Diabetes-Therapie des Pflegepersonals insgesamt und zur Nutzung von CGM-Systemen im Besonderen dar. Nach §4(2) der MPBetreibV muss eine geeignete Einweisung des Pflegepersonals in die Nutzung der Messsysteme erfolgen, dies gilt für BGM-Systeme wie auch für CGM-Systeme [MPBetreibV]. Aus den CGM-Daten adäquate therapeutische Entscheidungen abzuleiten, erfordert ein weitergehendes Training und Schulung des pflegerischen und ärztlichen Personals. Die Verwendung von CGM-Systemen spart zwar Zeit und Aufwand für konventionelle BGM, andererseits bedeuten Schulung und Fehlersuche und -behebung bei den verschiedenen CGM-Systemen – zumindest anfangs – einen erhöhten Aufwand.
Zusammenfassung:
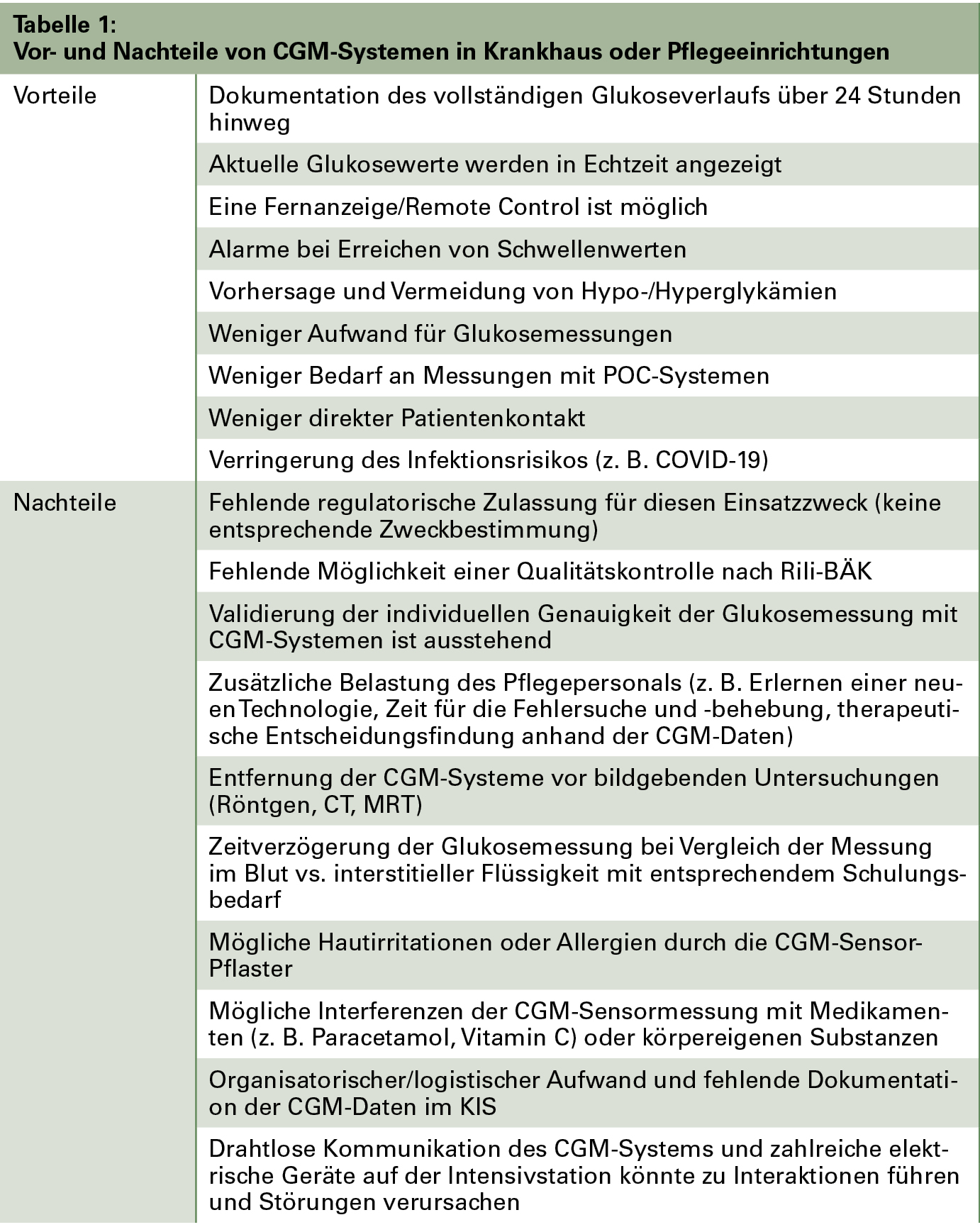
Die Frage, ob CGM-Systeme in KH oder PE von Menschen mit Diabetes und dem ärztlichen Personal/Pflegepersonal genutzt werden können oder dürfen, kann derzeit nicht eindeutig beantwortet werden. Die Vor- und Nachteile beim Einsatz von CGM-Systemen im stationären Bereich sind in Tabelle 1 zusammengefasst. Für den Einsatz von CGM-Systemen sprechen eine Verringerung des Krankenpflegeaufwands, die Möglichkeit der Glukose-Fernüberwachung in Echtzeit und weniger Unannehmlichkeiten durch kapilläre Blutglukosemessungen für die Patienten. Gegen den Einsatz von CGM-Systemen in diesen Einrichtungen spricht, dass nur wenige Studien zur Zuverlässigkeit von CGM-Systemen unter den doch recht speziellen Bedingungen in diesem Einsatzgebiet vorliegen; hier gibt es einen erheblichen Bedarf an weiteren Studien. Ebenfalls unzureichend ist die Datenlage zur Messgenauigkeit der CGM-Systeme bei unterschiedlichen Patientengruppen und klinischen Einsatzbereichen/-situationen (Intensivstation – Nicht-Intensivstation, Interferenzen, Prozeduren, Anämie, Hämodialyse, eingeschränkte Nierenfunktion), die intolerable Diskrepanzen bei den Glukosemessergebnissen zwischen Gewebs- und Blutglukose induzieren können.
Eine Hauptproblematik in diesem Themenkomplex stellen die rechtlichen Anforderungen dar. Diese sind für den Einsatz von CGM-Systemen im stationären Bereich (noch) nicht ausreichend geklärt, hier besteht eine "Grauzone". Da CGM-Systeme die Anforderungen der Rili-BÄK nicht erfüllen (kein Kontrollmaterial = keine Qualitätskontrolle) und als Medizinprodukt nicht die Vorgaben der Rili-BÄK erfüllen müssen, gilt es alternative Regelungen zur Qualitätskontrolle zu etablieren [International Federation of Clinical Chemistry and Laboratory Medicine 2019]. Neben der Schaffung der regulatorischen Voraussetzungen müssen für den Einsatz in KH oder PE die Hersteller der CGM-Systeme die Zweckbestimmung ihrer Produkte entsprechend erweitern. Sowohl die Nutzung der CGM-Systeme in Hinsicht auf deren Bedienung wie auch die Nutzung der Daten für Therapieentscheidungen verlangt geschultes Personal.
Es gilt ein Dilemma zu konstatieren: Ein großer Teil von Menschen mit T1D nutzt CGM-Systeme in ihrem therapeutischen Alltag; dies gilt auch für eine zunehmende Anzahl von Menschen mit T2D. Der Einsatz von Systemen für die automatisierte Insulin-Dosierung wird diese Entwicklung noch verstärken. Gleichzeitig stellt der Einsatz von CGM-Systemen im stationären Bereich ein "Minenfeld" dar. Es gibt eine ganze Reihe von rechtlichen und organisatorischen Hürden. Im Sinne einer pragmatischen Lösung, die für die MmD von erheblicher Bedeutung ist, müssen hier von allen Beteiligten Schritte gegangen werden. Ein möglicher Ansatz, um eine gewisse Qualitätskontrolle bei Nutzung von CGM-Systemen im KH und PE zu ermöglichen, ist die parallele Blutglukosemessung mit einem qualitätskontrollierten BGM-Messsystem in definierten Abständen.
Hier sind dringend eindeutige Regelungen, notwendig!
Basierend auf den beschriebenen Vor- und Nachteilen ergeben sich für die Autoren die folgenden Hauptanforderungen für einen sicheren Einsatz von CGM-Systemen im stationären Bereich:
- Erstellung eines Rechtsgutachtens zum Einsatz von CGM in stationären Einrichtungen durch medizinisches Personal
- Fachgesellschaften sollten sich bei der Bundesärztekammer für eine Etablierung von Regelungen und Qualitätskontrollen für CGM-Systeme einsetzen
- CGM-Hersteller sollten eine Erweiterung der Zweckbestimmung der CGM-Systeme vornehmen
- Fachgesellschaften sowie Krankenhäuser und Pflegeeinrichtungen sollten die Etablierung von Standardvorgehensweisen (SOPs) zur Nutzung von CGM-Systemen vorantreiben
- - durch Patienten, die vorher ein CGM-System hatten (+ BGM (QC und Therapieentscheidung))
- - durch Fachpersonal (+ BGM (QC und Therapieentscheidung))
|
Arbeitsgemeinschaft Diabetes & Technologie der Deutschen Diabetes Gesellschaft e.V.
Mitwirkende Autoren: G. Freckmann, S. Schlüter, R. Ziegler, S. Buck, A. Beltzer, B. Gehr, M. Nauck, L. Heinemann
Lise-Meitner-Str. 8/2
D-89081 Ulm
E-Mail: buero@diabetes-technologie.de
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2024; 33 (1) Seite 26-37