Zusammenfassung
Patienten mit Diabetes mellitus haben bekanntermaßen ein erhöhtes Risiko für die Entwicklung einer nicht-alkoholischen Lebererkrankung und einer Leberzirrhose. Potenziert wird dieses Problem bei gleichzeitigem Alkoholabusus, da eine zusätzliche alkoholische Lebererkrankung auch ein erhöhtes Krebsrisiko nach sich zieht. Für die Prävention von alkoholischen Leberschäden werden in Apotheken und Reformhäusern probiotische Nahrungsergänzungsmittel angeboten, die grundsätzlich auch für Menschen mit Diabetes geeignet sind. In dieser Übersicht werden die postulierten Wirkmechanismen vorgestellt und besprochen. Die eingesetzten Probiotika sind überwiegend Milchsäurebakterien und haben z. B. eine antioxidative Wirkung, verbessern die Barriere der Darmschleimhaut, wirken anti-inflammatorisch, verbessern den alkohol-induzierten Lipidstoffwechsel und regulieren die Darmflora. Ein neu entwickeltes probiotisches Produkt führt zur bakteriellen Metabolisierung des Alkohols bereits im Darm. In zwei placebo-kontrollierten klinischen Studien wurde nach einwöchiger Einnahme eine Reduktion der Alkoholspiegel im Blut um 70 % beobachtet (Einmaldosis 1 h vorher: −10 %). Es erscheint sinnvoll dafür zu sorgen, dass es trotz Alkoholkonsum gar nicht erst zu Veränderungen der Darmflora und zu chronischen Leberschäden kommen kann. Hierfür steht erstmals ein präventiver probiotischer Interventionsansatz zur Verfügung. Schlüsselwörter
Diabetes mellitus, probiotische Nahrungsergänzungsmittel, Prävention, alkoholische Lebererkrankung
Probiotic germs and dietary supplements for adjunctive therapy in alcoholic liver disease
Summary
Patients with diabetes mellitus are known to have an increased risk of developing non-alcoholic liver disease and cirrhosis. This problem is potentiated in the case of simultaneous alcohol abuse, since an additional alcoholic liver disease results in an increased risk of cancer. For the prevention of alcoholic liver damage, probiotic food supplements are offered in pharmacies and health food shops, which are basically also suitable for people with diabetes. In this review, the postulated mechanisms of action are presented and discussed. The probiotics used are predominantly lactic acid bacteria and have, for example, an antioxidant effect, improve the barrier of the intestinal mucosa, have an anti-inflammatory effect, improve the alcohol-induced lipid metabolism and regulate the intestinal flora. A newly developed probiotic product leads to the bacterial metabolisation of alcohol already in the intestine. In a placebo-controlled clinical study, a 70 % reduction of alcohol levels in the blood was observed after one week of regular uptake (-10% with a single dose). It seems to make sense to ensure that changes in the intestinal flora and chronic liver damage do not occur in the first place despite alcohol consumption. For the first time, a preventive probiotic intervention approach is available. KeywordsDiabetes mellitus, probiotic supplements, prevention, alcoholic liver disease
Einleitung
Mit der wirtschaftlichen Entwicklung, und der Globalisierung der Weltwirtschaft und dem Anstieg von sozialen Interaktionen nimmt der Alkoholkonsum weltweit stetig zu. Die berauschende Wirkung des Alkohols ist seit dem Altertum bekannt. Ethanol wurde von den Menschen seit der Vorgeschichte als berauschende Zutat in alkoholischen Getränken verwendet. Getrocknete Rückstände auf 9 000 Jahre alten Töpferwaren, die in China gefunden wurden, deuten darauf hin, dass schon die Menschen der Jungsteinzeit alkoholische Getränke konsumierten. Heutzutage wird das Trinken in Gesellschaft in vielen Kulturen der Welt toleriert. Es wird als legitimes Mittel akzeptiert, um besondere Anlässe zu feiern oder einfach nur, um sich nach einem harten Arbeitstag zu entspannen [Khaderi 2019, Stettler 1990]. Als Konsequenz leiden immer mehr Patienten an einer alkoholischen Lebererkrankung (Alcoholic Liver Disease, ALD). Laut Statistik weisen 80 % der Trinker Merkmale einer alkoholischen Leberschädigung auf, 10 - 35 % entwickeln eine alkoholische Hepatitis und bei 10 - 20 % wird eine alkoholische Leberzirrhose diagnostiziert [Gao 2011].
Alkoholabstinenz kann zur Remission leichter alkoholischer Leberschäden führen, eine Zirrhose ist jedoch in der Regel irreversibel. Die genaue Pathogenese der alkoholischen Leberschädigung ist immer noch ungeklärt. Zu den postulierten Pathomechanismen, die zu alkoholbedingten Organschäden und -erkrankungen führen, gehören unter anderem die direkte Toxizität von Ethanol und seinem Hauptmetaboliten Acetaldehyd, alkoholbedingter oxidativer Stress, die Akkumulation von Fettsäureethylestern und die Veränderung von Lipoprotein- und Apolipoproteinpartikeln [Gu 2019, Hannuksela 2002]. Fettsäureethylester tragen beispielsweise nachweislich zu Schäden an Herz, Leber und Bauchspeicheldrüse bei [Vonlaufen 2007, Ren 2008].
Das wichtigste Organ für den Alkoholstoffwechsel ist die Leber [Zakhari 2006], aber auch andere Organe wie das Herz, die Bauchspeicheldrüse, der Magen-Darm-Trakt und das Gehirn sind am Ethanolabbau und -stoffwechsel zu Acetaldehyd beteiligt [Vonlaufen 2007, Ren 2008, Zakhari 2006, Edenberg 2007]. Acetaldehyd verursacht eine mitochondriale Dysfunktion und beeinträchtigt den Acetaldehyd-Stoffwechsel, was wiederum zu einer Anhäufung von Acetaldehyd führt – ein Teufelskreis. Darüber hinaus reagiert es mit Amino-, Hydroxyl- und Sulfhydrylgruppen und beeinträchtigt oder verändert die Struktur und Funktion von Proteinen und Enzymen im Körper [Ren 2008, Lieber 1975].
Bei Patienten mit Diabetes mellitus besteht bekanntermaßen ohnehin bereits ein hohes Risiko für die Entwicklung einer nicht-alkoholischen Fettleber (NAFLD), Steatohepatitis (NASH) oder einer Leberzirrhose. Daher hat die Vermeidung einer zusätzlichen alkoholischen Lebererkrankung bei Menschen mit Diabetes eine noch größere Bedeutung als bei Menschen ohne Diabetes, zumal durch die Kombination zusätzlich noch ein erhöhtes Krebsrisiko induziert wird [Lam 2021].
Wirksame Medikamente zur Behandlung der ALD sind nicht vorhanden. Welche Möglichkeiten verbleiben, um die möglichen Folgen eines regelmäßigen Alkoholkonsums abzumildern? Strikte Alkoholverbote z. B. auf religiöser oder staatlicher Grundlage scheinen nicht zum Erfolg zu führen bzw. haben historisch versagt (Prohibition, USA). Es gibt jedoch Hinweise darauf, dass eine regelmäßige Substitution mit Probiotika z. B. durch Nahrungsergänzungsmittel über unterschiedliche Wirkmechanismen zur Abmilderung einer alkoholischen Lebererkrankung und zur Verbesserung der Leberfunktion führen können [Gu 2019, Ewaschuk 2007, Chávez-Tapia 2015, Kirpich 2008].
AMPK: AMP-aktivierte Proteinkinase (AMP: Adenosinmonophosphat)
HIF: Hypoxie-induzierbarer Faktor
ITF: intestinaler Trefoil-Faktor
LDL: Low-Density-Lipoprotein
MAPK: Mitogen-aktivierte Proteinkinase
NF-κB: Kernfaktoren κB
NAFLD: nicht-alkoholische Fettleber
NASH: Steatohepatitis
ROS: Reaktive Sauerstoff Spezies (Reactive Oxidative Species)
P-gp: P-Glykoprotein
SREBP-1: Sterol regulatory element-binding protein 1
PPARα: Peroxisom-Proliferator-aktivierter Rezeptor-α
TNF-α: Tumornekrosefaktor-alpha
IL-1β: Interleukin 1β
GPT: Glutamat-Pyruvat-Transaminase
Probiotika
Der Begriff "Probiotikum" bezeichnet Substanzen, die von einem Organismus abgesondert werden und das Wachstum eines anderen Organismus stimulieren. Probiotika sind lebende Mikroorganismen (Bakterien oder Hefen), die oral eingenommen werden und dosisabhängig [Neish 2009] das Gleichgewicht der intestinalen Mikrobiota positiv beeinflussen können [Lambert 2003]. Es kommt zu einer Veränderung der Zusammensetzung der Darmflora, zur Aktivierung der endogenen mikrobiellen Keimpopulation und zur Regulierung des Immunsystems [Lata 2011]. Probiotika haben sich bei verschiedenen klinischen Zuständen als wirksam erwiesen – von kindlicher Diarrhöe, nekrotisierender Enterokolitis, antibiotikaassoziierter Diarrhöe, rezidivierender Clostridium-difficile-Kolitis, Helicobacter-pylori-Infektionen, Laktoseintoleranz, entzündlichen Darmerkrankungen bis hin zu Krebs, urogenitalen Infektionen bei Frauen und chirurgischen Infektionen [Gupta 2009].
Erste Berichte über den Einsatz von Probiotika zur Behandlung von ALD-Patienten zeigten, dass Probiotika die Anzahl von Lactobacillus und Bifidobacterium in menschlichen Fäkalien signifikant erhöhten. Gleichzeitig verbesserten sich die Serumwerte von GPT, Low-Density-Lipoprotein (LDL) und Gesamtbilirubin [Kirpich 2008]. In der Folge begannen viele Forscher sich mit der möglichen Rolle von Probiotika bei der alkoholischen Lebererkrankung zu beschäftigen.
Die alkoholische Lebererkrankung
Die alkoholische Lebererkrankung (ALD) ist eine schwere chronische Organerkrankung, die durch übermäßigen Alkoholkonsum verursacht wird. Bei erhöhtem chronischen Alkoholkonsum entwickelt sich zunächst eine Fettleber, die in der Folge zu einer Hepatitis, Leberfibrose und Leberzirrhose führen kann und final oft zu Leberkrebs führt [Beier 2010, Frazier 2010, McClain 2004]. Obwohl die Abstinenz die alkoholbedingten Leberschäden lindern kann, kann sie die durch übermäßigen Alkoholkonsum verursachten Leberschäden nicht vollständig rückgängig machen. Es gibt nur wenig Behandlungsmöglichkeiten für alkoholische Leberschäden. Daher ist es dringend notwendig, eine wirksame Methode zur Therapie von alkoholbedingten Leberschäden zu finden.
Die Alkohol-Exposition beeinträchtigt die Funktion der Darmbarriere, was zu einer erhöhten Darmdurchlässigkeit für Endotoxine führt, die akute Leberschäden verursachen können [Mutlu 2012, Bajaj 2012]. Langfristiger oder starker Alkoholkonsum stört die Leberfunktion durch Schädigung der Mitochondrien und Anreicherung von Acetaldehyd in der Leber. Acetaldehyd verbindet sich mit verschiedenen Proteinen in der Leber und verursacht eine funktionelle Proteindenaturierung und Antigenexposition. Dadurch wird das Immunsystem zur Produktion von leberschädigenden Autoantikörpern verleitet [Tuma 2003, Teare 1993].
Wirkung von Probiotika bei alkoholischen Leberschäden
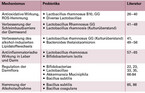
In den letzten Jahren sind die Wirkmechanismen von Probiotika zur Linderung von alkoholbedingten Leberschäden untersucht worden. Wir haben dahingehend eine Literaturrecherche mit den Suchbegriffen "alcoholic liver disease", "bacteria", "probiotics" und "probiotic supplements" durchgeführt. Die für uns wichtigsten Ergebnisse sind ohne Anspruch auf Vollständigkeit in Tabelle 1 zusammengefasst. Die genaue Wirkweise der aufgelisteten Species auf das Krankheitsbild der ALD ist in vielen Fällen noch nicht abschließend geklärt. Die Wirkung ist weitestgehend indirekt und wird mutmaßlich über den Darm vermittelt, da die Bakterien in der Regel nicht die Leber selbst erreichen. Das jeweils charakteristische Enzymprofil ist sicherlich entscheidend für die entsprechende Wirkung. Erklärungsansätze für die einzelnen postulierten Wirkmechanismen werden im Folgenden weiter ausgeführt.
Anti-oxidative Wirkung/ROS-Hemmung
Reaktive Sauerstoff Spezies ("Reactive Oxidative Species", ROS) sind hochreaktive sauerstoffhaltige Moleküle, Ionen oder Gruppen, die miteinander interagieren und zelluläre Molekülkomplexe insbesondere in der Leber schädigen.
In-vitro und in tierexperimentellen in-vivo Studien führen ROS durch Oxidation von ungesättigten Fettsäuren zu Lipidhydroperoxiden, Lipidperoxiden, und Malondialdehyd, die durch Schädigung anderer biologischer Makromoleküle (inkl. Proteine und DNA) zu Beeinträchtigungen von Zellstrukturen und Zellfunktionen führen, und den physiologischen Stoffwechsel beeinträchtigen [Lin 1999, Halliwell 1984, Toyokuni 1999].
Ob die hierbei gebildeten kurzkettigen Fettsäuren ausschließlich als Nährstoff für Darmzellen dienen oder über weitere spezifische rezeptorvermittelte Effekte zusätzliche Wirkungen entfalten, ist noch nicht abschließend geklärt. Alkoholkonsum führt zu einer Überproduktion von ROS, hemmt den Fettsäuremetabolismus in der Leber und führt dadurch zu speziellen ROS-vermittelten Leberschäden [Pan 2017, Cederbaum 2009, García-Villafranca 2008, You 2008, Albano 2008, Lluis 2003].
Tierstudien an Ratten haben gezeigt, dass Probiotika die antioxidative Aktivität verstärken und die Menge der alkoholinduzierten ROS im Illeum vermindern [Wang 2011]. Ein Lactobazillus-Kulturüberstand ist in der Lage, die ROS-Bildung zu unterdrücken und Leber und Ileumzellen vor oxidativem Stress zu schützen [Wang 2012]. Andere Gruppen zeigten in tierexperimentellen Studien eine Reduktion von GPT, Lipoperoxiden und Malondialdehyd sowie Verbesserungen der durch Alkohol gestörten mRNA-Expression zahlreicher Signaltransduktionsproteine [Albano 2008, Wang 2012, Parola 2001, Wang 2013, Lee 2021, Fan 2021]. Diese Ergebnisse legen nahe, dass Probiotika oxidativen Stress reduzieren und die Produktion von Antioxidantien fördern, um Schäden in der Leber zu lindern.
Probiotika verbessern die Funktion der Darmbarriere und modulieren das intestinale Immunsystem
Probiotika stärken laut eines Reviews über tierexperimentelle Untersuchungen und Humanstudien aus dem Jahr 2006 direkt und indirekt die Barrierefunktion der Schleimhautepithelien des Darms und können das Immunsystem regulieren [Ewaschuk 2006]. Hierdurch kommt es zur vermehrten Bildung von kurzkettigen Fettsäuren, dem Energieträger des Darms, wodurch die Proliferation der Darmzellen, das Wachstum der Darmschleimhaut und die Natriumabsorption gefördert werden [Cani 2013, Flint 2012].
Eine kürzlich durchgeführte Studie mit Mäusen ergab, dass das Probiotikum Akkermansia muciniphila die Integrität der Darmbarriere fördert, indem es die Expression der Tight Junction Proteine Claudin-3 und Occludin fördert und dadurch die Leberschädigung durch Alkohol reduziert [Grander 2018]. Alkoholkonsum verringerte die Expression des Hypoxie-induzierbaren Faktors (HIF). HIF ist ein Haupttranskriptionsfaktor, der an der Aufrechterhaltung der Barrierefunktion beteiligt ist. Er erhöht die Expression des intestinalen Trefoil-Faktors (ITF), die Xenobiotika Ausscheidung durch P-Glykoprotein (P-gp) und verschiedene andere Nukleotid-Signalwege [Colgan 2010]. Alkohol (EtOh) beeinträchtigt die epitheliale Integrität, und Probiotika bewahren die Barrierefunktion durch Aufrechterhaltung der Aktivität von HIF und anderer Schleimhautmoleküle.
Probiotika verhindern und mildern in Mäusen auch die durch Alkohol verursachte Unterbrechung der Tight Junctions des Kolonepithels, eine Endotoxämie, und Leberschäden durch andere von epidermale Wachstumsfaktorrezeptor-abhängigen Mechanismen [Shukla 2018, Yan 2013, Zhu 2022].
Probiotika verbessern den Alkoholinduzierten Fettstoffwechsel
Die AMP-aktivierte Proteinkinase (AMPK) ist ein wichtiger Energiestoffwechselfaktor, der den Katabolismus aktiviert und einen Anabolismus deaktiviert [Winder 1999]. AMPK reguliert den Lipidstoffwechsel durch Manipulation verschiedener Transkriptionsfaktoren, darunter Peroxisom-Proliferator-aktivierter Rezeptor-α (PPARα) und Sterol regulatory element-binding protein 1 (SREBP-1), die eine wichtige Rolle bei der Lipogenese und Fettsäureoxidation spielen [Li 2011, You 2004]. Tierexperimentelle Studien haben gezeigt, dass eine erhöhte AMPK-Phosphorylierung bei der der Behandlung der alkoholischen Fettleber wirksam ist [Ajmo 2008, Shearn 2013].
Chronischer oder akuter Alkoholkonsum führt beim Menschen und bei Nagetieren durch Aktivierung von AMPK , Acetyl-CoA-Carboxylase Phosphorylierung und erhöhte Malonyl-Co-A-Produktion zu einem abnormalen Lipidstoffwechsel in der Leber [You 2004, Purohit 2009]. Zhang et al. beobachteten, dass der Kulturüberstand von L. rhamnosus in der Lage ist, die Adiponectin-Sekretion zu stimulieren und dadurch die Insulinempfindlichkeit zu erhöhen [Zhang 2015]. Sangineto et al. konnten kürzlich auch mit Bacteroides thetaiotaomicron eine Verbesserung der Steatohepatitis in einem experimentellen Tiermodell zeigen [Sangineto 2022]. Zusammenfassend lässt sich sagen, dass Probiotika in der Lage sind, die Fettsäureoxidation zu erhöhen und dadurch die chronische alkoholinduzierte Lebersteatose und Leberschädigung zu verhindern.
Probiotika reduzieren die Expression proinflammatorischer Zytokine in Leber und Darm
Die Alkohol-induzierte Dysfunktion der Immunbarriere im Darm führt zu einer lokalen und systemischen Produktion von proinflammatorischen Zytokinen wie TNF-α und IL-1β [Segawa 2008, Hong 2015, Inokuchi 2011]. Wie Tierexperimente und klinische Humanstudien zeigen können Bakterien und ihre Toxine dadurch leichter ins Blut gelangen und in den Kupffer-Zellen akkumulieren, wodurch es zu einer Aktivierung der Mitogen-aktivierten Proteinkinase (MAPK) und der Kernfaktoren κB (NF-κB) kommt. Diese produzieren proinflammatorische Zytokine, wie z. B. TNF-α und Interleukin (IL-6, IL-1β) [Inokuchi 2011, Gao 2012, Bajaj 2014a].
In zahlreichen weiteren humanen und tierexperimentellen Studien konnte gezeigt werden, das Probiotika die Expression und Sekretion dieser proinflammatorischen Zytokine reduzieren können [Ewaschuk 2006, Inokuchi 2011, Miyauchi 2009, Yoda 2014]. Durch Probiotika fermentierte Milch enthält zwei lösliche Proteine, p40 und p75, die das Überleben und Wachstum von Darmepithelzellen durch Aktivierung des epidermalen Wachstumsfaktor-Rezeptors fördern [Cesaro 2011]. Auch Bifidobakterium kann nach einer neuen klinischen Studie anti-inflammatorische Wirkungen entfalten [He 2022].
Probiotika regulieren die Darmflora
Es besteht eine enge Beziehung zwischen der Darmmikrobiota und der menschlichen Gesundheit. Die Darmflora ist ein entscheidender Akteur bei der Pathogenese von Lebererkrankungen [Wang 2011, Loguercio 2005, McLoughlin 2011]. Chronischer Alkoholkonsum führen zu einer Dysbiose des Darms und zu pathogenen bakteriellen Überwucherungen [Albano 2008, Canesso 2014, Bajaj 2014b, Gabbard 2014, Hendrikx 2018, Bäckhed 2012]. Einer der wichtigsten Mechanismen der probiotischen Funktion ist die Veränderung der Darmflora. Die Darmflora spielt eine Schlüsselrolle im Immunsystem. Ein Ungleichgewicht der Darmflora stimuliert das Immunsystem und fördert chronische Leberentzündungen [Mutlu 2012, Bajaj 2012]. Bifidobakterien und Lactobacillus sind die vorherrschenden Gattungen und verhindern das Wachstum von unphysiologischen gram-positiven anaeroben Bakterien [Tap 2009, Zhang 2010, Bode 1984]. Die Supplementierung mit Probiotika fördert die Produktion von IL-22, was die alkoholinduzierte Leberschädigung verbessert und eine Störung der Darmflora verhindert [Bäckhed 2012].
Bei regelmäßigem Alkoholkonsum ist die Zahl von gramnegativen anaeroben Bakterien im Vergleich zu einer Kontrollgruppe signifikant erhöht [Mutlu 2009]. In einem ALD Rattenmodell konnte gezeigt werden, dass diese Alkohol-induzierten Veränderungen der Darmflora durch probiotische Substitution verhindert werden können [Bull-Otterson 2013]. Alkoholkonsum verringerte die Anzahl von Bacteroides und Firmicutes und erhöhte die Zahl der Proteobacteria, Actinobacteria, Corynebacteria und Alcaligenes im Darm, wodurch sich der pH-Wert erhöht und Überwucherungen durch pathogene Keime auftreten können [Collado 2007]. Normalerweise macht Akkermansia muciniphila 1 bis 4 % der fäkalen Mikrobiota bei gesunden Menschen aus [Derrien 2008, Kim 2022]. Alkoholexposition verringert das Vorkommen von A. muciniphila im Darm sowohl bei Mäusen und Menschen, und eine Supplementierung mit A. muciniphila ist in der Lage, Alkohol-vermittelte Leberschäden und Dysbiose der Darmmikrobiota rückgängig zu machen [Grander 2018]. Neue tierexperimentelle Studien des letzten Jahres belegen, dass die Modulation der Darmflora eine besondere Bedeutung für die beobachteten positiven Effekte von Probiotika bei ALD hat [Liu 2022, Ding 2022, Jiang 2022, Zhao 2021].
Hemmung der Alkohol-Absorption im Darm
Ein einfach zu verstehender Ansatz ist die Hemmung der Absorption des Alkohols im Darm. Einem schwedischen Unternehmen (de Faire Medical AB, Stockholm, Schweden) ist es gelungen, ein probiotisches Nahrungsergänzungsmittel zu entwickeln, das im Wesentlichen aus Bacillus subtilis und Bacillus coagulans besteht (AB001). Die Bakterien werden aus säurefesten Kapseln freigesetzt und siedeln sich im oberen Teil des Darmtrakts an. Dort bleiben sie etwa einen Tag lang, bevor sie mit dem Stuhl ausgeschieden werden.
Die Bakterien wurden so ausgewählt, dass sie Ethylalkohol vorzugsweise und effektiv in CO2 und Wasser umwandeln, und so die Resorption von Alkohol aus dem Darmtrakt verhindern. Infolgedessen wird weniger Alkohol vom Körper aufgenommen, um die Schädigung von Organen durch Alkoholabbauprodukte zu verringern. In den Körper gelangen praktisch nur noch die Alkohol Mengen, die bereits von der Mundschleimhaut, im Ösophagus und im Magen absorbiert werden.
In zwei prospektiven, doppelblinden und placebo-kontrollierten Cross-over Studien mit jeweils 24 Teilnehmern konnten wir zeigen, dass bereits eine einmalige Einnahme von AB001 die Alkoholmenge im Blut signifikant um 10 % reduzieren kann [Pfützner 2023], während die chronische Einnahme über eine Woche zu einer substantiellen Reduktion der Blutalkoholspiegel im Mittel um mehr als 70 % führt (s. Abb. 1) [Pfützner 2022]. Hintergrund für diese Unterschiede ist wahrscheinlich, dass die chronische Substitution von AB001 zu einer substantiellen und dauerhaften Besiedlung des Darms mit den Bakterien führt und dass diese ihre Wirkung somit besser entfalten können. Wie praktisch alle Probiotika ist auch AB001 sehr gut verträglich. In beiden Studien wurden keine unerwünschten Ereignisse beobachtet [Pfützner 2022, Pfützner 2023].
Zukunftsperspektiven
Die alkoholinduzierte Lebererkrankung steht im Zusammenhang mit der Zusammensetzung der Keimbesiedlung im Darm. Die Wiederherstellung mikrobieller Stoffwechselprodukte ist daher ein logischer Behandlungsansatz. Die Modulation der mikrobiellen Zusammensetzung der Darmflora und der fäkale Austausch mit Keimen mit gesunden Personen (Mikrobiota-Transplantation) werden zwei der logischen Behandlungen in der Zukunft sein.
Eine US-amerikanische Studie konnte zeigen, dass die tägliche Mikrobiota-Transplantation von mehreren gesunden Spendern über 7 Tage die Leberfunktion bei ALD-Patienten verbesserte und pathogene Spezies bei den Empfängern reduzierte [Philips 2017]. Diese Vorgehensweise war in klinischen Studien allen anderen Interventionen bei schwerer alkoholischer Hepatitis, sowie bei hepatischer Enzephalopathie, nichtalkoholischer Fettlebererkrankung, Hepatitis-B-bedingter chronischer Lebererkrankung und primär sklerosierender Cholangitis überlegen [Sarin 2019].
Alternativ können auch Medikamente zur Veränderung und Modulation von bakteriellen Enzymen oder Stoffwechselwegen entwickelt werden. Obwohl wir ein gewisses Verständnis für die Wechselwirkungen zwischen dem Darmmikrobiom und dem Wirt haben, fehlt uns ein umfassendes ein umfassendes Verständnis der Funktion des Darmmikrobioms bei der alkoholischer Lebererkrankung.
Patienten mit Diabetes mellitus haben bei chronischem Alkoholkonsum ein besonders hohes Risiko Leberschäden zu entwickeln. In der Praxis ist es jedoch bekanntermaßen häufig schwierig und in vielen Fällen sogar unmöglich, Lebensstilveränderungen wie den Verzicht auf Alkohol dauerhaft zu induzieren. Daher erscheint es sinnvoll dafür zu sorgen, dass es trotz Alkoholkonsum gar nicht erst zu Veränderungen der Darmflora und zu chronischen Leberschäden kommt. Hier steht mit AB001 erstmals ein präventiver probiotischer Interventionsansatz zur Verfügung. Sollten sich die Ergebnisse der ersten Studien in adäquaten klinischen Langzeitstudien bestätigen lassen, dann könnte die regelmäßige Einnahme von AB001 tatsächlich dazu beitragen, Leber- und andere Organschäden zu verhindern und die negativen medizinischen und wirtschaftlichen Auswirkungen des sozialen Trinkens auf den Einzelnen und die Gesellschaft zu verringern.
Manuskript eingegangen: 1. Juni 2022
Manuskript angenommen: 10. Februar 2023
Interessenkonflikte
Die in diesem Artikel erwähnte Studie mit AB001 wurde von der Firma deFaire Medical, Stockholm, finanziert. Prof. Andreas Pfützner ist Berater von deFaire Medical und hat für die Durchführung der Studie Forschungsgelder erhalten. Die anderen Autoren haben keine Interessenkonflikte.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2023; 32 (2) Seite 82-88