In der September-Ausgabe des Diabetes-Forums drehte sich im Titelthema alles um AID-Systeme. Hier eine Zugabe von Dr. Andreas Thomas.
Die bekannte Berliner Diabetologin Frau Dr. Deiss erklärte in einem ihrer Vorträge: "Wir sehen heutzutage von den Anwendern von AID-Systemen Glukoseprofile, davon haben wir früher nicht zu träumen gewagt!"
Was wird mit AID-Systemen erreicht?
Ein durchaus nicht seltenes Beispiel soll diese Aussage unterstreichen (Abb. 1). Dabei zeigt sich, dass die Nutzung der automatisierten Insulinabgabe (Auto-Modus) zu einem hohen Anteil an Glukosewerten im Glukosezielbereich ("Time in Range"; TIR) von 70-180 mg/dl (3,9-10,0 mmol/l) führt.
Auch wenn es sich um ein Beispiel eines gut eingestellten Anwenders des AID-Systems handelt, es zeigt wie die automatische Regulierung der basalen Insulinabgabe die Glukosewerte immer im bzw. nahe des Zielbereichs hält. Dazu trägt bei diesem AID-System der 2. Generation auch bei, dass alle 5 min ein Korrekturbolus abgegeben wird, mit dem Ziel den Wert von 120 mg/dl (6,7 mmol/l) zu erreichen, falls die Glukosewerte darüber liegen. Bei dieser 2. Generation wird von einem Advanced-Hybrid-AID-System (AH-AID) gesprochen. Das heißt, die basale Insulinabgabe und, falls erforderlich, die Korrekturboli werden automatisch abgegeben, die Mahlzeitenboli muss der Anwender noch manuell abrufen.
Was verbessert sich bei Anwendung eines AID-Systems?
Bei der Evidenz der AID-Systeme und damit bei der Beurteilung von deren Leistungsfähigkeit muss unterschieden werden zwischen der 1. und 2. Generation. Bei der 1. Generation, repräsentiert durch die MiniMed 670G erfolgten nur die basale Insulinabgabe automatisch, die Gabe von Mahlzeitenboli und ggf. notwendigen Korrekturboli hingegen manuell (Hybrid-AID). Bei dem ersten System gab es noch einige Limitierungen, wie den schnellen Übergang in den manuellen Modus bei abweichenden Parametern (z.B., wenn die Glukosewerte länger als eine Stunde oberhalb von 300 mg/dl (16,7 mmol/l) lagen) oder in den Modus "Basal sicher", wenn z.B. die Glukosewerte von gemessenen Blutzuckerwerten mehr als 35% abwichen. Diese Limitierungen in der ersten Generation von Hybrid-AID existierten aus Gründen der Vorsicht, um auch zugelassen zu werden. Weil diese Übergänge mit häufigen Alarmmeldungen verbunden waren, führten die Limitierungen aber auch dazu, dass ein Teil der Anwender den Auto-Modus verlies und danach nicht wieder nutzte [1].
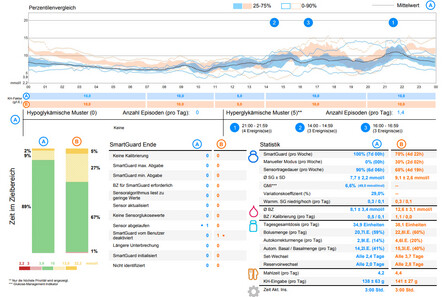
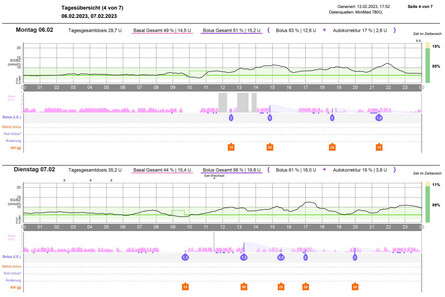
Abb.1: Darstellung der Glukosedaten eines Menschen mit Typ-1-Diabetes bei Verwendung des AID-Systems MiniMed 780G. In dem oberen Diagramm der linken Darstellung zeigt das ambulante Glukoseprofil (AGP) die Zusammenfassung der Glukosekurven über jeweils 14 Tage. In der orangefarbenen Kurve lagen 67% der Werte im Zielbereich von 70-180 mg/dl. In diesem Zeitraum wurde der Auto-Modus nur zu 70% der Zeit genutzt. Die blaue Kurve entstand bei 100%iger Nutzung des Auto-Modus und führte dazu, dass 89% der Glukosewerte im Zielbereich lagen. Rechts sind zwei typische konsekutive CGM-Tageskurven unter Nutzung des Auto-Modus bei diesem Anwender zu sehen, mit 88% bzw. 89% der Werte im Glukosezielbereich.
In der 2. Generation sind diese Limitierungen bedeutend moderater, wenn das AH-AID System MiniMed780G betrachtet wird. Vor allem aber werden die Grenzen des Systems durch die automatische Gabe von Korrekturboli seltener erreicht. Das betrifft letztendlich alle AH-AID-Geräte, also auch die t:slim X2 CONTROL IQ, das mylife Loop CAM APS FX und die seit der zweiten Jahreshälfte 2023 in Deutschland verfügbare OmniPod 5. Dies hat zur Folge, dass die Anwender die automatische Insulinabgabe praktisch kaum noch unterbrechen, was dauerhaft gute Stoffwechselergebnisse garantiert.
Nach dem internationalen Expertenkonsensus [2] wird angestrebt, dass Menschen mit Typ-1-Diabetes einen Anteil der Zeit im Glukosezielbereich von 70-180 mg/dl (3,9 – 10,0 mmol/l), also eine TIR (Time in Range) von ≥70% erreichen sollen, wobei nur <1% der Werte unterhalb 54 mg/dl (3,0 mmol/l) und <4% unterhalb 70 mg/dl (3,9 mmol/l) liegen sollen. In der Breite, also über eine größere Population von Menschen mit Typ-1-Diabetes lässt sich das mit anderen therapeutischen Optionen (ICT mit und ohne CGM-Unterstützung, klassische Insulinpumpentherapie (CSII), Sensorunterstützte Pumpentherapie (SuP)) nicht erreichen. Dies garantiert nur die Anwendung von AID-Systemen. Verschiedene Studien mit den verschiedenen Systemen zeigen in allen Altersklassen:
- HbA1c-Werte um 7% und darunter (bzw. des aus den Glukosewerten errechneten eHbA1c, bezeichnet als Glukosemanagement-Indikator (GMI))
- eine TIR von 70% - 74% in der 1. Generation von AID-Systeme und von 70-ca. 80% in der 2. Generation
- selten Hypoglykämien (Anteil der Zeit im Bereich <70 mg/dl von ca. 2-3%)
- sehr selten schwere Hypoglykämien und diabetische Ketoazidosen
- stabilere Glukoseverläufe (geringere Glukosevariabilität) als unter allen anderen therapeutischen Optionen
- Erzielung dieser normnahen Glukoseverläufe, obwohl der Aufwand für das Diabetesmanagement für die Betroffenen geringer ist, als unter anderen therapeutischen Optionen.
Diese Ergebnisse präsentierten auch Real-World-Daten über Populationen von > 100 000 AID-Nutzern [3]. Es gibt also gleichartige Resultate aus Studien und den Daten unter der Alltagsanwendung. Prinzipiell bedeutet dies, dass die Anwender von AID-Systemen ein geringes Risiko für akute Komplikationen und die Entwicklung diabetischer Folgeerkrankungen aufweisen. Der zweite Teil der Behauptung trifft nicht unbedingt zu, wenn vorher unter anderen Optionen der Insulinbehandlung langzeitig eine schlechte Diabeteseinstellung vorlag. Grundsätzlich ist aber der therapeutische Erfolgt nicht nur für die Menschen von AID-Systemen wesentlich, sondern sollte auch für die Kostenträger interessant sein. Schließlich sind diabetische Folgeerkrankungen nach wie vor die größten Kostentreiber im Rahmen der Diabetesbehandlung. Dies zumindest für Menschen mit Typ-1-Diabetes und AID-Anwendung weitgehend ausschließen zu können wäre langfristig ein Gewinn. Wie groß dieser sein kann lässt sich abschätzen. In einem Bericht von IQVIA im Jahr 2019, einem multinationalen Unternehmen zur Einschätzung von Entwicklungen in den Bereichen Gesundheitsinformationstechnologie und klinische Forschung wurde abgeschätzt, welche finanziellen Auswirkungen sich ergeben, wenn von der Anwendung eines CGM auf ein AID-System übergegangen wird [4]. Aus Studien zur alleinigen Anwendung von CGM (also kein AID) ergab sich für die TIR ein Basiswert von 58%. Wenn dieser durch Anwendung eines AID auf 70% gesteigert wird, so ergibt sich in den USA über einen Zeitraum von zehn Jahren für die Kostenträger eine Einsparung von mindestens 2 bis 4 Milliarden Dollar. Wird die TIR gar auf 80% erhöht, so beträgt diese Einsparung ca. 9,7 Milliarden Dollar. Umgerechnet auf Deutschland (Annahme: 320.000 Menschen mit Typ-1-Diabetes und 4,7 Millionen mit Typ-2-Diabetes) bedeutet dies bei der Verbesserung der TiR von 58% auf 70% eine Einsparung von mindestens 1,68 Milliarden Euro und bei der Verbesserung von 58% auf 80% von 2,43 Milliarden Euro über 10 Jahre.
Die klinische Evidenz der AID-Systeme ist umfassend. Die Eingabe des Begriffs "Hybrid Closed Loop Diabetes" in die Datenbank PubMed führt zu 534 Treffern, separat für die 2. Generation von AID Systemen ("Advance Hybrid Closed Loop Diabetes") zu 180 Treffern [5]. Natürlich ist die Beweiskraft der einzelnen Studien unterschiedlich, es liegt ein Mix von prospektiven Studien, randomisierten kontrollierten Studien, Real-World-Daten und Einzelberichten über verschieden lange Beobachtungszeiträume vor, aber darunter sind hinreichend viele Daten mit hoher Evidenzlage zu finden. Auf einige wenige wird nachfolgend eingegangen.
Evidenz der 1. Generation von AID-Systemen
Die erste Generation betraf zunächst vor allem das System MiniMed 670G. Die Zulassungsstudien für die verschiedenen Altersgruppen wurden gleich gestaltet. Auf eine Einlaufphase von einer Woche unter medizinischer Beobachtung in einem Hotel folgte der Übergang in den Auto-Modus und die weitere Beobachtung über 3 Monate. So ergab eine Untersuchung von 30 Jugendlichen (Alter: 16,5 ± 2,3 Jahre, Diabetesdauer: 7,7 ± 4,3 Jahre) und 94 Erwachsenen mit Typ-1-Diabetes (Alter: 44,6 ± 12,8 Jahre, Diabetesdauer: 26,4 ± 12,4 Jahre), dass der HbA1c-Wert bei den Jugendlichen von 7,7 ± 0,8 % auf 7,1 ± 0,6 % (p < 0,001) und bei den Erwachsenen von 7,3 ± 0,9 % auf 6,8 ± 0,6 % (p < 0,001) sank [6,7]. Gleichzeitig erhöhte sich der Anteil der Zeit im Glukosezielbereich (Time in Range; TIR) bei den Jugendlichen von 60,4 ± 10,9 % auf 67,2 ± 8,2 % (p < 0,001) und bei den Erwachsenen von 68,8 ± 11,9 % auf 73,8 ± 8,4 % (p < 0,001). In beiden Kohorten traten keine schweren Hypoglykämien oder diabetischen Ketoazidosen auf.
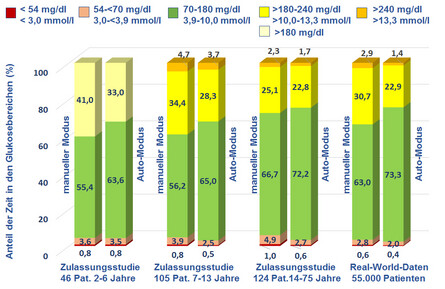
Abb. 2: Ergebnisse der Zulassungsstudien mit dem System MiniMed 670G in verschiedenen Altersgruppen [3,6,7].
Auch wenn das System nicht für Anwender unter 7 Jahren zugelassen ist, so zeigten sich zum Beispiel in einer in Deutschland durchgeführten Studie beeindruckende Ergebnisse bei 38 Kindern in den Altersklassen von 2-6 und 7-14 Jahren [8]. Die Kinder im Vorschulalter erreichten eine durchschnittliche TIR von 73 ± 6 % (Verbesserung gegenüber der vorherigen Sensorunterstützten Pumpentherapie (SuP) von 8 %) und die Schulkinder von 69 ± 8 % (Verbesserung gegenüber der SuP von15 %). Insgesamt verbesserte sich der HbA1c-Wert von 7,4 ± 0,9 % auf 6,9 ± 0,5 % (p = 0,002). Real-World-Daten von 123.355 Anwendern ergaben einen Anteil der Werte im Zielbereich von 70,4±11,2 % [9]. Das sind 16,9 Stunden/Tag. Die MiniMed 670G-Nutzer hatten ihre Daten anonymisiert in das Programm CareLInk heruntergeladen. Für die "Time below Range" <70 mg/dl ergab sich ein Anteil von 2,2± 2,1% (ca. 32 min/Tag) und für die "Time above Range" >180 mg/dl von 27,5±11,6% nachdem der Auto-Modus initiiert worden war. Der aus den Glukosedaten errechnete GMI betrug 7,0±0,4 %. Das belegt die vergleichbar guten Glukosedaten sowohl unter Studien- als auch Alltagsbedingungen.
Evidenz der 2. Generation von AID-Systemen
Aufgrund der automatischen Gabe eines Korrekturbolus (MiniMed 780G: alle 5 min mit Zielwert 120 mg/dl; t:slim X2 CONTROL IQ jede Stunde, wenn die Werte ≥ 180 mg/dl liegen) bzw. deren Einbeziehung in die basale Insulinabgabe (CAM APS FX) werden bei den AH-AID-Systemen noch bessere Glukosewerte erreicht als bei den H-AID-Systemen, wenn auch nicht mehr so deutlich verbessert, wie gegenüber anderen therapeutischen Optionen. Abb.3 belegt dies anhand eines Vergleiches von drei Systemen [10-12]. Es zeigt sich aber, dass alle drei Systeme bei erwachsenen Menschen mit Typ-1-Diabetes eine gute glykämische Einstellung bewerkstelligten. Absolut vergleichbar sind die Daten allerdings nicht, weil die Studiendesigns unterschiedlich sind und die Daten auch nicht mit den gleichen Studienteilnehmern erzielt wurden. Diese Thematik betrifft übrigens alle Studien mit Diabetestechnologie. Eine Verblindung der Studien ist praktisch nicht möglich, wodurch auch "Head to Head"-Vergleiche mit der gleichen Personengruppe schwer realisierbar sind.
Auch für die AH-AID-Systeme sind Daten von größeren Anwendergruppen unter Alltagsbedingungen analysiert worden. So ergab zum Beispiel eine Auswertung der Daten von 4 120 Nutzern der MiniMed 780G über mehrere Länder (Belgien, Finnland, Italien, den Niederlanden, Katar, Südafrika, Schweden, der Schweiz und Großbritannien) zwischen August 2020 und März 2021 (mittlere Beobachtungszeit: 54 ± 32 Tage), dass eine TIR von 76,2 ± 9,1%, eine TBR <70 mg/dl von 2,5 ± 2,1% und eine TAR >180 mg/dl von 21,3 ± 9,4% erreicht wurden [13]. Der errechnete GMI betrug 6,8 ± 0,3 %. Die Anwender nutzten zu 94,1 ± 11,4 % der Zeit den Auto-Modus des Systems.

Abb.3: Links: Anteil der Zeit im Glukosezielbereich (TIR) bzw. im Bereich < 54 mg/dl (3,0 mmol/l), erzielt mit verschiedenen AID-Systemen von unterschiedlichen erwachsenen Studienpopulationen. Rechts: Erreichter HbA1c-Wert nach Abschluss der Studien [10-12].
Ein weiteres Beispiel sind die Daten für das System mylife CamAPS FX. Dazu wurden Nutzerdaten verschiedener Altersgruppen aus 15 Ländern im Zeitraum zwischen dem 9. Mai 2022 und dem 3. Dezember 2022 betrachtet [14]. Eingeschlossen wurden die Daten von 1 805 Anwendern des Systems über mindestens 30 Tage im automatischen Abgabemodus nutzten. Die TIR betrug 72,6 ± 11,5 % für alle Anwender und stieg mit zunehmendem Alter von 66,9 ± 11,7 % für Benutzer ≤6 Jahre auf 81,8 ± 8,7 % für Benutzer ≥65 Jahre. Der Anteil der Zeit im Glukosebereich < 70 mg/dl (3,9 mmol/l) betrug 2,3 %. Für den mittleren GMI ergab sich ein Wert von 6,9%. Über 94,7 % der Zeit wurde der automatische Modus der Insulinabgabe genutzt.
Zusammenfassung
AID-Systeme haben sich für die Behandlung des Typ-1-Diabetes etabliert. Davon zeugen nahezu eine Millionen Anwender in einigen entwickelten Industrieländern in der Welt. Mit diesen Systemen wird nicht nur eine sehr gute Glykämie erreicht mit nahe- normoglykämischen Werten, die Nutzer dieser Systeme werden gleichzeitig effektiv in ihrem Diabetesmanagement unterstützt. Der "Human-Faktor" wird zurückgedrängt, läuft doch ein Teil der Insulinabgabe automatisch ab. Das entlastet die Nutzer massiv. Die bisher vorliegende Evidenz für AID-Systeme ist ausreichend und belegt absolut deren Effektivität. Schwerwiegende akute Komplikationen und vermutlich auch diabetische Folgeerkrankungen werden bei den Anwendern solcher Systeme in der Zukunft eher selten sein, womit AID-Systeme nicht nur den Menschen mit Diabetes helfen, sondern auch noch kosteneffektiv sind.
|
|
Erschienen in: Diabetes-Forum, 2023; 35 (10) Seite 32-35


