Neben Diabetes, Hypertonie und Nikotinkonsum ist die Hyperlipidämie ein wichtiger Risikofaktor für Herz-Kreislauf-Ereignisse. (1, 2) Patienten, die mit Statinen nicht gut eingestellt werden können oder diese nicht vertragen, profitieren von der Behandlung mit Alirocumab, einem Lipidsenker aus der Wirkstoffklasse der PCSK9-Inhibitoren. (3)

„Erhöhte Blutfettwerte gehören zu den wichtigsten Risikofaktoren für kardiovaskuläre Ereignisse“, betont Prof. Dr. Matthias Blüher, Leipzig, „und eine Normalisierung des Low-Density-Lipoprotein- oder LDL-Cholesterins kann dieses Risiko vermindern.“ (1, 2, 4 – 6)
Laut der 2016 aktualisierten Leitlinie der Europäischen Gesellschaft für Kardiologie (ESC) und der Europäischen Atherosklerose-Gesellschaft (EAS) ist der Zielwert des LDL-Cholesterins für Hypercholesterinämiepatienten
- mit niedrigem oder moderatem kardiovaskulären Risiko:< 115 mg/ dl (< 3,0 mmol/l);
- mit hohem kardiovaskulären Risiko: < 100 mg/ dl (< 2,6 mmol/l); bei Ausgangswerten zwischen 100 und 200 mg/dl (2,6 – 5,2 mmol/l) sollte der Wert mindestens halbiert werden;
- mit sehr hohem kardiovaskulären Risiko: < 70 mg/dl (< 1,8 mmol/l); bei Ausgangswerten zwischen 70 und 135 mg/dl (1,8 – 3,5 mmol/l) sollte der Wert mindestens halbiert werden. (7)
Etwa 70 % der Menschen mit Hypercholesterinämie in Deutschland erreichen jedoch ihren Zielwert für das LDL-Cholesterin nicht. (8)
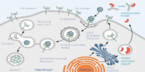
PCSK9-Inhibitoren verhindern Abbau des LDL-Rezeptors
Alirocumab (Praluent®) ist ein Hemmstoff von Proproteinkonvertase-Subtilisin/Kexin Typ 9 (PCSK9). Bindet PCSK9 an den LDL-Cholesterin-Rezeptor, wird dieser zusammen mit dem LDL-Cholesterin in der Leberzelle abgebaut und steht nicht mehr zur Verfügung.
PCSK9-Hemmstoffe wie Alirocumab verhindern dies und sorgen dafür, dass der LDL-Rezeptor mehrfach „recycelt“ werden und an die Zelloberfläche zurückkehren kann, wo er weiteres LDL-Cholesterin aus dem Blutplasma bindet. Damit sinkt der LDL-Cholesterinspiegel im Blut ab. (3, 9) (Abb. 1)
Je nach Indikation Zusatz- oder Monotherapie
Alirocumab ist begleitend zu einer Diät zugelassen zur Behandlung Erwachsener mit primärer Hypercholesterinämie (heterozygote familiäre und nicht familiäre) oder gemischter Dyslipidämie. Es wird entweder in Kombination mit einem Statin und ggf. weiteren Lipidsenkern angewendet, wenn die Patienten mit einer maximal verträglichen Statintherapie ihre Zielwerte nicht erreichen. Oder es wird in Monotherapie oder zusammen mit anderen Lipidsenkern bei Patienten mit Statinintoleranz oder Kontraindikation gegen Statine eingesetzt. (3)
Laut Beschluss des Gemeinsamen Bundesausschusses (G-BA) zur Verordnungseinschränkung ist Alirocumab zudem für eine klar definierte Patientengruppe mit hohem kardiovaskulären Risiko erstattungsfähig und wirtschaftlich. Dies gilt für Patienten mit primärer Hypercholesterinämie (familiär heterozygot oder nicht familiär) oder gemischter Dyslipidämie bei therapierefraktären Verläufen mit einer gesicherten vaskulären Erkrankung sowie regelhaft weiteren Risikofaktoren, die ihre LDL-C-Zielwerte trotz maximaler diätetische und medikamentöser Therapie über 12 Monate nicht erreichen. (10) In der aktuellen ESC-/EAS-Leitlinie sind PCSK9-Hemmstoffe wie Alirocumab bereits berücksichtigt. (7)
ODYSSEY-Studienprogramm überzeugt
Das Phase-III-Studienprogramm für Alirocumab, ODYSSEY, umfasst weltweit mehr als 15 doppelblinde, randomisierte, kontrollierte Zulassungsstudien mit insgesamt etwa 23.500 Teilnehmern. Alirocumab hat im klinischen Studienprogramm im Vergleich zu Placebo oder zu einem aktiven Komparator eine deutliche Reduktion des LDL-Cholesterins gezeigt. (3, 11)
So konnten in der Studie ODYSSEY LONG TERM 79% der Patienten, die mit Alirocumab behandelt wurden, ihren LDL-Cholesterin-Zielwert von < 70 mg/dl (< 1,8 mmol/l) tatsächlich erreichen. In der Kontrollgruppe mit Placebo schafften dies nur 8 %. (11)
Auch in den Studien ODYSSEY FH I, ODYSSEY FH II und ODYSSEY HIGH FH – alle mit Patienten, die an heterozygoter familiärer Hypercholesterinämie (HeFH) litten – war die Therapie mit Alirocumab erfolgreich. Die LDL-Cholesterinspiegel wurden bei diesen Hochrisikopatienten zwischen 46% und 49% abgesenkt im Vergleich zu Studienbeginn. In den Kontrollgruppen mit Placebo sank der Wert dagegen um durchschnittlich 7% bzw. es kam sogar zu einem leichten Anstieg des LDL-Cholesterins um 3% bzw. 9%. (12, 13)
In die Studie ODYSSEY ESCAPE waren nur Patienten eingeschlossen, die wegen therapieresistenter hoher Cholesterinwerte eine Lipidapherese benötigten. Unter der Therapie mit Alirocumab konnte ihr LDL-Cholesterin um etwa 50 % reduziert werden. Die Häufigkeit der Apheresetherapie wurde im Vergleich zu Placebo um 75 % vermindert. (14)
Diabetespatienten gehören per se zur Höchstrisikogruppe
Hat ein Patient mit Hypercholesterinämie zusätzlich einen Diabetes mellitus mit Endorganschaden oder einen zusätzlichen Risikofaktor, gehört er von vornherein zur Gruppe mit dem höchsten kardiovaskulären Risiko und hat einen LDL-Cholesterin-Zielwert < 70 mg/dl (< 1,8 mmol/l). (7) Dies bekräftigt Prof. Dr. Dirk Müller-Wieland, Aachen: „Patienten mit Diabetes haben per se ein Risiko-Äquivalent für eine koronare Herzerkrankung: Myokardinfarkte kommen in beiden Gruppen ähnlich häufig vor.“ (15) Das sei bei der Behandlung zu berücksichtigen, sonst drohe Diabetespatienten eine Untertherapie.
Die Behandlung mit Alirocumab bessert bei diesen Patienten die Lipidwerte und hat dabei auf die Diabeteseinstellung keinen störenden Einfluss: Nüchternplasmaglukose und HbA1c-Wert bleiben nach bisher verfügbaren ODYSSEY
Studiendaten jeweils mit oder ohne Alirocumab gleich. (16)
Noch nicht abgeschlossen ist ODYSSEY OUTCOMES, eine Endpunktstudie, in der untersucht wird, ob und wie die Behandlung mit Alirocumab die Zahl kardiovaskulärer Ereignisse bei Patienten mit Hypercholesterinämie und nach akutem Koronarsyndrom beeinflussen kann. Die Ergebnisse werden für das erste Quartal des Jahres 2018 erwartet. (17)